Teil B – Kraftstoffe
1
In der Bundesrepublik Deutschland betrug im Jahr 2021 der Anteil neu zugelassener PKW mit Benzinmotor  mit Dieselmotor
mit Dieselmotor  und mit Elektroantrieb
und mit Elektroantrieb  Die restlichen
Die restlichen  entfielen auf Hybrid-Fahrzeuge.
entfielen auf Hybrid-Fahrzeuge.
| Kraftstoffart | typische Bestandteile | Siedebereich |
|---|---|---|
| Ottokrafstoff (Benzin) | n-Heptan 2,2,4-Trimethylpentan | |
| Diesel | n-Hexadecan
Methylnaphthalin
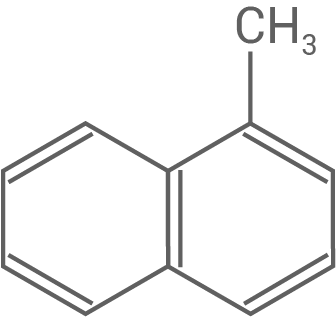
|
1.1
Gib für 2,2,4-Trimethylpentan die Strukturformel an.
Benenne die chemischen Bindungen im Molekül nach dem Orbitalmodell.
Benenne die chemischen Bindungen im Molekül nach dem Orbitalmodell.
(02 BE)
1.2
Erkläre mithilfe der Angaben in der Tabelle die unterschiedlichen Siedebereiche der Kraftstoffe.
(02 BE)
2
Ottokraftstoffen wird Bioethanol zugesetzt. Einige Hersteller fügen auch Phenole als Antioxidationsmittel zu.
2.1
Begründe die Mischbarkeit von Ethanol sowohl mit Wasser als auch mit Kohlenwasserstoffen.
(02 BE)
2.2
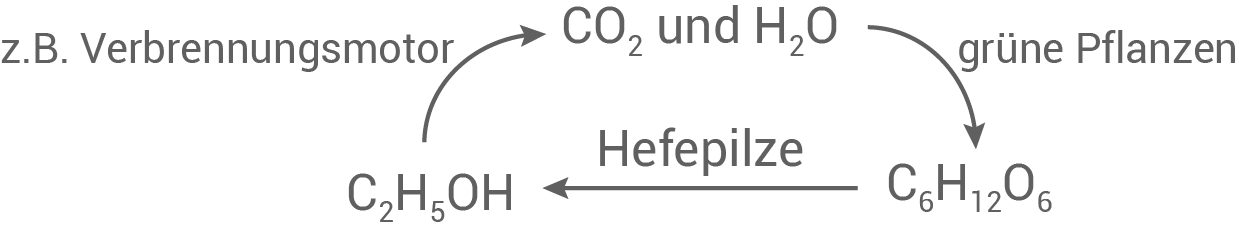
Erläutere den dargestellten Stoffkreislauf.

(03 BE)
2.3
Gib für Phenol (Benzenol) drei mesomere Grenzformeln an.
(02 BE)
2.4
Begründe die unterschiedlichen  -Werte von Phenol und p-Nitrophenol (4-Nitrobenzol).
-Werte von Phenol und p-Nitrophenol (4-Nitrobenzol).
| Phenol | |
| p-Nitrophenol |
(03 BE)
3
In einem Verbrennungsmotor reagieren Stickstoff und Sauerstoff zu Stickstoffmonooxid. Es stellt sich folgendes chemisches Gleichgewicht ein.


 Bei
Bei  reagieren
reagieren  Stickstoff und
Stickstoff und  Sauerstoff unter Bildung von
Sauerstoff unter Bildung von  Stickstoffmonooxid.
Berechne die Gleichgewichtskonstante
Stickstoffmonooxid.
Berechne die Gleichgewichtskonstante 
Wähle eine der Aufgaben 4 oder 5 aus und bearbeite diese.
4
AdBlue® ist eine  ige Harnstofflösung mit einer Dichte
ige Harnstofflösung mit einer Dichte  Sie dient zur Abgasnachbehandlung bei Fahrzeugen mit Dieselmotor. Der enthaltene Harnstoff wird mit Wasserdampf im Abgasstrom vereinfacht nach folgender Reaktionsgleichung zersetzt.
Sie dient zur Abgasnachbehandlung bei Fahrzeugen mit Dieselmotor. Der enthaltene Harnstoff wird mit Wasserdampf im Abgasstrom vereinfacht nach folgender Reaktionsgleichung zersetzt.


 Ammoniak reagiert anschließend am SCR-Katalysator (selectiv catalytic reduction) mit Stickstoffmonooxid und Stickstoffdioxid zu u.a. Stickstoff.
Ammoniak reagiert anschließend am SCR-Katalysator (selectiv catalytic reduction) mit Stickstoffmonooxid und Stickstoffdioxid zu u.a. Stickstoff.
4.1
Berechne die Masse des Ammoniaks, die aus einem Liter AdBlue® gebildet werden kann.
(03 BE)
4.2
Entwickle eine Reaktionsgleichung für die Reaktion am SCR-Katalysator.
Begründe den Nutzen dieser Reaktion.
Begründe den Nutzen dieser Reaktion.
(02 BE)
5
Die technische Herstellung von Harnstoff  erfolgt schrittweise durch zwei Gleichgewichtsreaktionen.
Schritt I:
erfolgt schrittweise durch zwei Gleichgewichtsreaktionen.
Schritt I:
Umsetzung der Gase Kohlenstoffdioxid und Ammoniak im Hochdruckreaktor bei in einer exothermen Reaktion zum Salz Ammoniumcarbamat
in einer exothermen Reaktion zum Salz Ammoniumcarbamat 
Schritt II:
Ammoniumcarbamat reagiert in einer endothermen Reaktion zu Harnstoff und Wasser. Die molare Standardreaktionsenthalpie der Reaktion beträgt
Umsetzung der Gase Kohlenstoffdioxid und Ammoniak im Hochdruckreaktor bei
Schritt II:
Ammoniumcarbamat reagiert in einer endothermen Reaktion zu Harnstoff und Wasser. Die molare Standardreaktionsenthalpie der Reaktion beträgt
5.1
Entwickle für beide Reaktionsschritte die Reaktionsgleichungen.
(02 BE)
5.2
Begründe für den ersten Reaktionsschritt die gewählte Reaktionsbedingung.
(01 BE)
5.3
Berechne die molare Standardbildungsenthalpie des Ammoniumcarbamats.
(02 BE)
6
Material
Die Elektromobilität beruht u.a. auf der Nutzung von Wasserstoff-Brennstoffzellen.
Die Abbildung zeigt schematisch die Funktionsweise einer solchen Brennstoffzelle zum Betreiben eines Elektromotors.
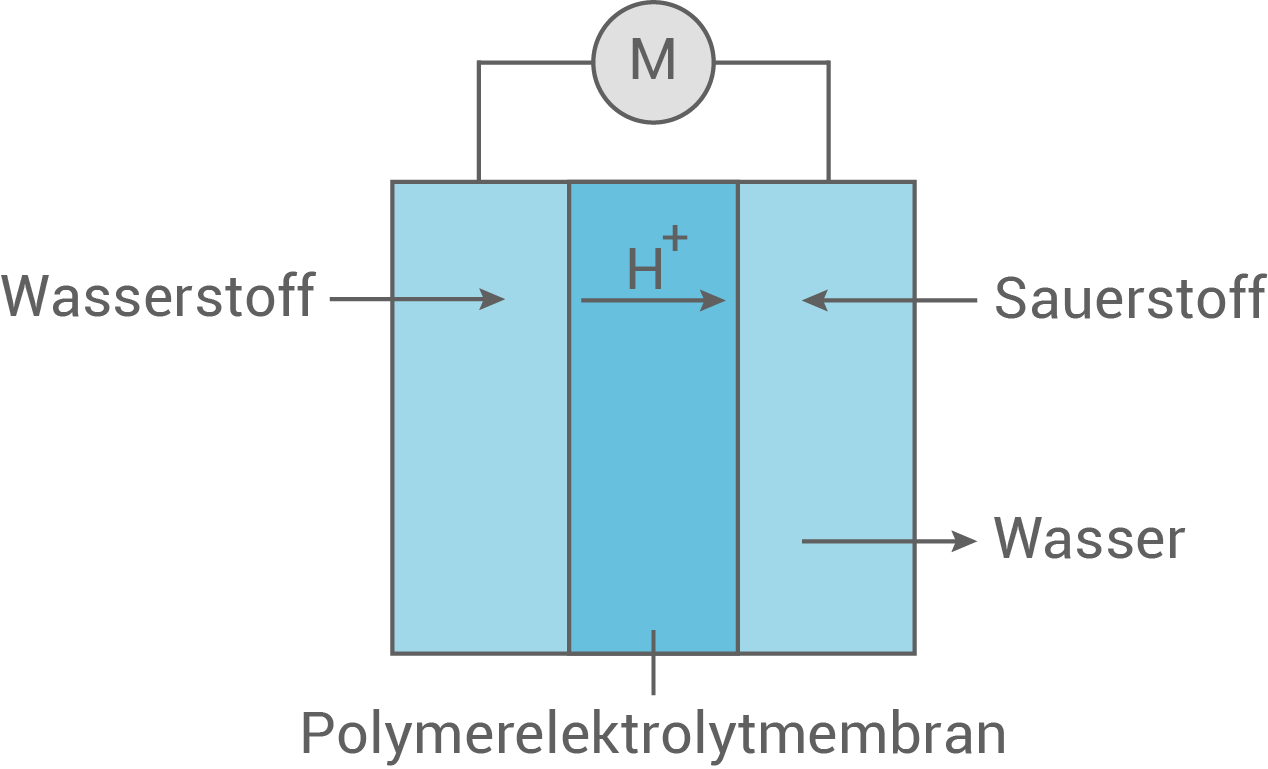 Der bei der Chlor-Alkali-Elektrolyse (Elektrolyse von wässriger Natriumchlorid- oder Kaliumchloridlösung) anfallende Wasserstoff könnte u.a. auch zur Betankung entsprechender Elektrofahrzeuge genutzt werden.
Alternativ könnten Brennstoffzellen mit Methanol betrieben werden.
Zellreaktion der Methanol-Brennstoffzelle:
Der bei der Chlor-Alkali-Elektrolyse (Elektrolyse von wässriger Natriumchlorid- oder Kaliumchloridlösung) anfallende Wasserstoff könnte u.a. auch zur Betankung entsprechender Elektrofahrzeuge genutzt werden.
Alternativ könnten Brennstoffzellen mit Methanol betrieben werden.
Zellreaktion der Methanol-Brennstoffzelle: 


Die Abbildung zeigt schematisch die Funktionsweise einer solchen Brennstoffzelle zum Betreiben eines Elektromotors.

6.1
Entwickle ausgehend von den Teilgleichungen für die Anoden- und Kathodenreaktion die Reaktionsgleichung für die Zellreaktion einer Wasserstoff-Brennstoffzelle.
(03 BE)
6.2
Berechne ausgehend von der Teilgleichung der Kathodenreaktion der Chlor-Alkali-Elektrolyse das Volumen an Wasserstoff unter Standardbedingungen, das täglich bei einer Stromstärke  gewonnen wird. Die Stromausbeute beträgt
gewonnen wird. Die Stromausbeute beträgt 
(03 BE)
6.3
Beurteile, ob die Methanol-Brennstoffzelle eine geeignete Alternative zur Wasserstoff-Brennstoffzelle darstellt.
(02 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Strukturformel
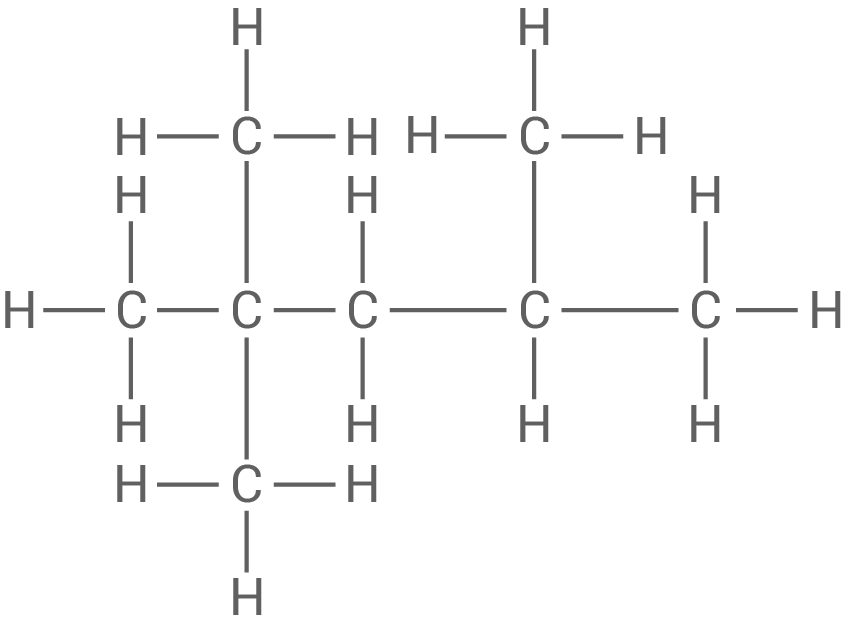 Benennung der chemischen Bindung
Benennung der chemischen Bindung

2,2,4-Trimethylpentan
-
-
-Bindung Das Molekül besteht ausschließlich aus Einfachbindungen, die nach dem Orbitalmodell als
-Bindungen klassifiziert werden. Diese Bindungen sind dadurch gekennzeichnet, dass das Molekülorbital rotationssymmetrisch um die Verbindungslinie der Atomkerne angeordnet ist. Die Kohlenstoffatome im Molekül sind alle
-hybridisiert.
-s-
-Bindung In den Bindungen zwischen einem Kohlenstoffatom und einem Wasserstoffatom überlappt eines der
-Hybridorbitale des Kohlenstoffatoms mit dem
-Orbital des Wasserstoffatoms.
1.2
Unterschiedliche Siedebereiche
- In Diesel besitzen die einzelnen Bestandteile größere molare Massen.
- Für den Übergang zum gasförmigen Zustand ist bei Diesel ein höherer Energieaufwand erforderlich
- Um die VAN-DER-WAALS-Kräfte im Diesel zwischen den größeren Molekülen zu überwinden, ist ein höherer Energieaufwand nötig. Der Übergang in den gasförmigen Zustand zeigt somit einen höheren Siedebereich. Für größere Moleküle im Diesel ist es erforderlich, einen erhöhten Energieaufwand aufzubringen, um die VAN-DER-WAALS-Kräfte zu überwinden, wenn sie vom flüssigen in den gasförmigen Zustand übergehen. Dies ist aufgrund ihres höheren Siedebereichs der Fall.
2.1
Mischbarkeit von Ethanol
 in beiden Fällen mischbar
in beiden Fällen mischbar
- mit Wasser: die polaren Hydroxygruppen bilden Wasserstoffbrückenbindungen aus
- mit Kohlenwasserstoffen: die unpolare Ethylgruppe (Alkylrest) wechselwirkt mit den unpolaren Kohlenwasserstoff-Molekülen durch VAN-DER-WAALS-Kräfte
2.2
Erläuterung des Stoffkreislaufs
Das Fließschema zeigt eine spezielle Form des Kohlenstoffdioxid-Kreislaufs. Grüne Pflanzen nutzen Kohlenstoffdioxid und Wasser zur Photosynthese, um Glucose zu produzieren, wobei Sauerstoff freigesetzt wird:


 Hefepilze wandeln Glucose durch alkoholische Gärung in Ethanol um, wobei Kohlenstoffdioxid entsteht:
Hefepilze wandeln Glucose durch alkoholische Gärung in Ethanol um, wobei Kohlenstoffdioxid entsteht:


 Wird Ethanol dem Benzin beigemischt (z. B. "E10" enthält
Wird Ethanol dem Benzin beigemischt (z. B. "E10" enthält  Ethanol), wird Ethanol vollständig zu Kohlenstoffdioxid und Wasser oxidiert:
Ethanol), wird Ethanol vollständig zu Kohlenstoffdioxid und Wasser oxidiert:



2.3
Mesomere Grenzformeln für Phenol
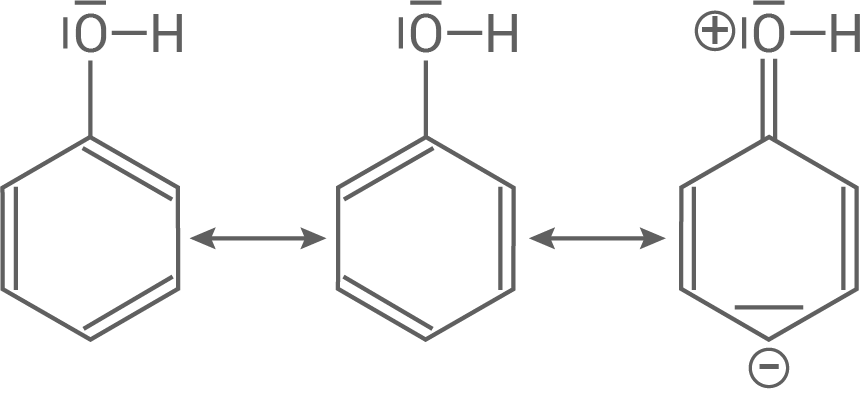

2.4
Unterschiedliche  -Werte von Phenol und p-Nitrophenol
Phenol und p-Nitrophenol enthalten beide eine Hydroxygruppe am aromatischen Ring. In wässriger Lösung spaltet diese Gruppe ein Proton ab, was beide Verbindungen zu BRØNSTED-Säuren macht. Aufgrund des kleineren
-Werte von Phenol und p-Nitrophenol
Phenol und p-Nitrophenol enthalten beide eine Hydroxygruppe am aromatischen Ring. In wässriger Lösung spaltet diese Gruppe ein Proton ab, was beide Verbindungen zu BRØNSTED-Säuren macht. Aufgrund des kleineren  -Werts ist p-Nitrophenol eine stärkere Säure als Phenol.
Der wesentliche Unterschied zwischen den beiden Molekülen liegt im Vorhandensein einer Nitrogruppe bei p-Nitrophenol, die bei Phenol fehlt. Diese Nitrogruppe hat durch ihre
-Werts ist p-Nitrophenol eine stärkere Säure als Phenol.
Der wesentliche Unterschied zwischen den beiden Molekülen liegt im Vorhandensein einer Nitrogruppe bei p-Nitrophenol, die bei Phenol fehlt. Diese Nitrogruppe hat durch ihre  - und
- und  -Effekte eine stark elektronenziehende Wirkung auf das Molekül. Dadurch wird auch die Hydroxygruppe in der para-Stellung beeinflusst, was die Bindung zwischen Sauerstoff und Wasserstoff stärker polarisiert und die Protonenabgabe erleichtert.
-Effekte eine stark elektronenziehende Wirkung auf das Molekül. Dadurch wird auch die Hydroxygruppe in der para-Stellung beeinflusst, was die Bindung zwischen Sauerstoff und Wasserstoff stärker polarisiert und die Protonenabgabe erleichtert.
3
Berechnung der Gleichgewichtskonstanten  Es gilt:
Es gilt:
![\(K_c= \dfrac{\text{[Produkte]}}{\text{[Edukte]}}\)](https://mathjax.schullv.de/e3c0bb192d8d2232ff2b1ea9dfc5d96cca00b3c43a8db4c90852f5c10a469be7?color=5a5a5a) Da es sich um ein chemisches Gleichgewicht handelt, leiten sich die Stoffmengenkonzentrationen der Produkte und Edukte aus dem Stoffmengenverhältnis (Reaktionsgleichung) ab.
Da es sich um ein chemisches Gleichgewicht handelt, leiten sich die Stoffmengenkonzentrationen der Produkte und Edukte aus dem Stoffmengenverhältnis (Reaktionsgleichung) ab.
Es folgt:![\(\begin{array}[t]{rll}
n(N_2)&=& 80\,\text{mol} & \\[5pt]
n(O_2)&=& 20\,\text{mol} & \\[10pt]
n(NO) &=& \dfrac{m}{M} = \dfrac{66\,\text{g}}{30\,\text{g}\cdot\text{mol}^{-1}} = 2,2 \,\text{mol} & \\[5pt]
\end{array}\)](https://mathjax.schullv.de/2cca73ecc3577c9ecd4783f827930a4d82b84c77b75d67f63abd68391cc23263?color=5a5a5a)
![\(\begin{array}[t]{rll}
K_c&=&\dfrac{[NO]^2}{[N_2] \cdot [O_2]} & \\[5pt]
&=& \dfrac{(2,2 \,\text{mol)}^2}{80\,\text{mol} \cdot 20\,\text{mol}} & \\[5pt]
&\approx& 0,003
\end{array}\)](https://mathjax.schullv.de/d3063ebaab30e2a3856ed5ea9439207c3e75e4bbc1af543e600bd180ae60e101?color=5a5a5a) Die Gleichgewichtskonstante beträgt ca.
Die Gleichgewichtskonstante beträgt ca. 
Es folgt:
4.1
Masse des Ammoniaks
Mit der gegebenen Dichte kann zunächst die Masse an AdBlue® berechnet werden:
![\(\begin{array}[t]{rll}
m&=& \rho \cdot V & \\[5pt]
&=& 1,087\,\text{g} \cdot \text{cm}^{-3} \cdot 1000 \,\text{cm}^{3}& \\[5pt]
&=& 1087 \,\text{g}
\end{array}\)](https://mathjax.schullv.de/c66759fb657c70450ebef15efdc2933d633af278c3f6fee4975f3e653d456101?color=5a5a5a) Da es sich um eine
Da es sich um eine  ige Harnstofflösung handelt, gilt:
ige Harnstofflösung handelt, gilt:
 Weiterhin folgt aus der Reaktionsgleichung:
Weiterhin folgt aus der Reaktionsgleichung:
 Daraus folgt:
Die Masse von Ammoniak, die aus einem Liter AdBlue® gebildet wird, beträgt ca.
Daraus folgt:
Die Masse von Ammoniak, die aus einem Liter AdBlue® gebildet wird, beträgt ca. 
4.2
Reaktionsgleichung für die Reaktion am SCR-Katalysator


 Nutzen der Reaktion
Der Anteil an giftigen Stickstoffoxiden im Abgas wird reduziert.
Nutzen der Reaktion
Der Anteil an giftigen Stickstoffoxiden im Abgas wird reduziert.
5.1
Reaktionsgleichungen für beide Reaktionsschritte
Schritt 1: 

 Schritt 2:
Schritt 2: 


5.2
Begründung der Reaktionsbedingung
Das Prinzip des kleinsten Zwangs besagt: Wirkt auf ein chemisches System im Gleichgewicht ein äußerer Zwang, so stellt sich ein neues Gleichgewicht ein, sodass die Wirkung dieses Zwanges immer kleiner wird.
Bei einer Druckerhöhung verschiebt sich das Gleichgewicht so, dass die Reaktion bei der das Volumen abnimmt bevorzugt wird.
Im ersten Schritt der Reaktion bilden ein Mol Ammoniak und ein Mol Kohlenstoffdioxid zusammen ein Mol des Feststoffs Ammoniumcarbamat. Dabei kommt es zu einer deutlichen Volumenabnahme, die durch erhöhten Druck gefördert wird. Diese Druckerhöhung hemmt die Rückreaktion und verhindert weitgehend den Zerfall des Ammoniumcarbamats.
Im ersten Schritt der Reaktion bilden ein Mol Ammoniak und ein Mol Kohlenstoffdioxid zusammen ein Mol des Feststoffs Ammoniumcarbamat. Dabei kommt es zu einer deutlichen Volumenabnahme, die durch erhöhten Druck gefördert wird. Diese Druckerhöhung hemmt die Rückreaktion und verhindert weitgehend den Zerfall des Ammoniumcarbamats.
5.3
Berechnung der molaren Standardbildungsenthalpie des Ammoniumcarbamats
Für die Berechnung gilt:
Durch Einsetzen der gegebenen Werte und Umformung ergibt sich:
Die molare Standardbildungsenthalpie für Ammoniumcarbamat beträgt 
6.1
Reaktionsgleichungen
6.2
Berechnung des Volumens
Es wird folgende Reaktionsgleichung betrachtet:


 Aus dem FARADAYschen Gesetz folgt:
Aus dem FARADAYschen Gesetz folgt:



![\(\begin{array}[t]{rll}
V (H_2)&=& \dfrac{I \cdot t \cdot V_m \cdot 0,8}{z \cdot F}& \\[5pt]
&=& \dfrac{400\,000\,\text{A} \cdot 24,5\,\text{L} \cdot \text{mol}^{-1} \cdot 0,8} {2 \cdot 26,8 \,\text{Ah} \cdot \text{mol}^{-1}} & \\[5pt]
&=& 3 \ 510\ 448 \,\text{L} & \\[5pt]
&\approx & 3\ 510\,\text{m}^3
\end{array}\)](https://mathjax.schullv.de/68d7814241e7232bd1ef132151d516842bcb3e958e1a1bf9616dabb35d5c7440?color=5a5a5a) Unter Standardbedingungen können bei einer Stromstärke von
Unter Standardbedingungen können bei einer Stromstärke von  und einer Stromausbeute von
und einer Stromausbeute von  täglich etwa
täglich etwa  Wasserstoff erzeugt werden.
Wasserstoff erzeugt werden.
6.3
Beurteilung der Methanol-Brennstoffzelle
Da bei der Verbrennung von Methanol in der Brennstoffzelle neben Wasser auch das Treibhausgas Kohlenstoffdioxid entsteht, stellt die Methanol-Brennstoffzelle keine umweltfreundliche Alternative zur Wasserstoff-Brennstoffzelle dar, die lediglich Wasserdampf als Reaktionsprodukt erzeugt.