Teil C – Experimente: Salze der Ethansäure und Calciumverbindungen
Hinweis: Von den nachfolgenden Aufgabenteilen C1 und C2 soll in der Prüfung nur einer bearbeitet werden.
 oder kristallwasserhaltig
oder kristallwasserhaltig  in den Handel.
in den Handel.
Aufgabe C1
Die Salze der Ethansäure (Essigsäure) werden als Acetate bezeichnet. Natriumacetat kommt wasserfrei
1
Prüfe experimentell, ob es sich bei dem vorgelegten Salz um wasserhaltiges oder um wasserfreies Natriumacetat handelt.
Experiment A
Vertreibe in einer Reibschale einen Spatel Natriumacetat mit einem Spatel weißem Kupfer -sulfat.
-sulfat.
Vertreibe in einer Reibschale einen Spatel Natriumacetat mit einem Spatel weißem Kupfer
1.1
Führe das Experiment durch. Gib deine Beobachtungen an.
(01 BE)
1.2
Erläutere deine Entscheidung über das vorliegende Salz.
(03 BE)
2
Experiment B
Versetze in einem Reagenzglas unter Schütteln ca. Natriumacetatlösung tropfenweise mit Silber
Natriumacetatlösung tropfenweise mit Silber -nitratlösung bis zur verbleibenden Veränderung.
-nitratlösung bis zur verbleibenden Veränderung.
Erhitze das Gemisch mit Siedesteinen bis zum Sieden. Kühle es nach kurzer Wartezeit im Wasserbad ab.
Versetze in einem Reagenzglas unter Schütteln ca.
Erhitze das Gemisch mit Siedesteinen bis zum Sieden. Kühle es nach kurzer Wartezeit im Wasserbad ab.
2.1
Führe das Experiment durch. Gib deine Beobachtungen an.
(02 BE)
2.2
Diskutiere die Temperaturabhängigkeit der Gleichgewichtslage des chemischen Gleichgewichts.



(02 BE)
3
Experiment C
Dampfe ca. des Reagenzglasinhalts aus Experiment B ein.
des Reagenzglasinhalts aus Experiment B ein.
Dampfe ca.
3.1
Führe das Experiment durch. Gibt deine Beobachtungen an.
(01 BE)
3.2
Vervollständige die vereinfachte Reaktionsgleichung für Experiment C. Nenne die Reaktionsart.



(02 BE)
4
Die "Eisenchloridprobe" ist ein Hinweis auf Acetat-Ionen.
Experiment D
Versetze in einem Reagenzglas unter Schütteln ca. Natriumacetatlösung mit ca.
Natriumacetatlösung mit ca.  Eisen
Eisen -chloridlösung. Erhitze das Gemisch mit Siedesteinen bis zum Sieden.
-chloridlösung. Erhitze das Gemisch mit Siedesteinen bis zum Sieden.
Filtriere die Lösung und prüfe das Filtrat mit Kaliumhexacyanidoferrat -lösung auf Eisen
-lösung auf Eisen -Ionen.
-Ionen.
Versetze in einem Reagenzglas unter Schütteln ca.
Filtriere die Lösung und prüfe das Filtrat mit Kaliumhexacyanidoferrat
4.1
Führe das Experiment durch. Gib deine Beobachtungen an.
(02 BE)
4.2
Gib dein Prüfergebnis an.
(01 BE)
4.3
Bei der Reaktion bilden sich Hexaacetatodihydroxidotrieisen -Ionen.
-Ionen.
![\([Fe_3(OH)_2(CH_3COO)_6]^x\)](https://mathjax.schullv.de/47f24446e7e011de8ad419408b2c192d48ed9afbf2b0dbbe39c628e5645cebbe?color=5a5a5a) Gib die Ladung des Komplex-Ions an.
Gib die Ladung des Komplex-Ions an.
(01 BE)
(15 BE)
Aufgabe C2
1
Untersuche chemische Reaktionen von Calciumverbindungen.
Experiment A
Erhitze zwei bis drei Minuten die bereitgestellte Menge Calciumcarbonat im Reagenzglas kräftig. Pipettiere während des Erhitzens mit einer gläsernen Pipette mindestens fünfmal Gas aus dem Reagenzglas in ein Halbmikroreagenzglas mit Calciumhydroxidlösung (Kalkwasser). Experiment B
Gib in das abgekühlte Reagenzglas aus Experiment A ca. destilliertes Wasser. Schüttle und ermittle anschließend den pH-Wert der Suspension.
destilliertes Wasser. Schüttle und ermittle anschließend den pH-Wert der Suspension.
Erhitze zwei bis drei Minuten die bereitgestellte Menge Calciumcarbonat im Reagenzglas kräftig. Pipettiere während des Erhitzens mit einer gläsernen Pipette mindestens fünfmal Gas aus dem Reagenzglas in ein Halbmikroreagenzglas mit Calciumhydroxidlösung (Kalkwasser). Experiment B
Gib in das abgekühlte Reagenzglas aus Experiment A ca.
1.1
Führe die Experimente durch. Gib deine Beobachtungen und den Messwert an.
(03 BE)
1.2
Ordne die chemischen Reaktionen aus den Experimenten A und B den Reaktionen des technischen Kalkkreislaufs zu. Entwickle für a bis c jeweils eine Reaktionsgleichung.
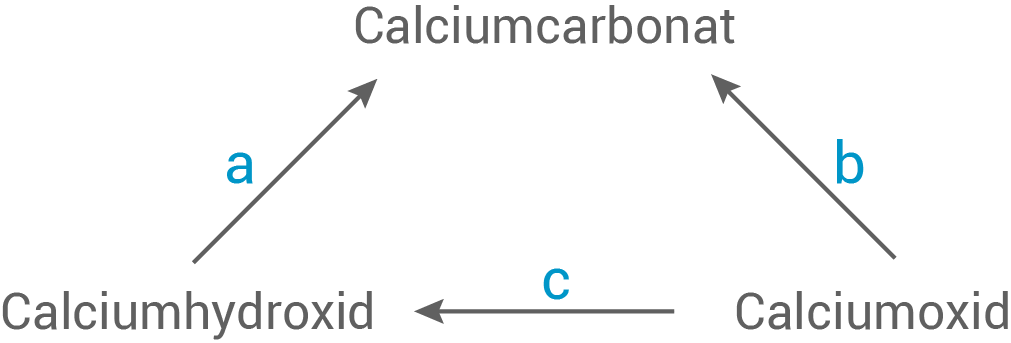

(04 BE)
2
Untersuche eine gesättigte Calciumsulfatlösung quantitativ.
 Anleitung:
Anleitung:
Gib Analyselösung in den Erlenmeyerkolben und fülle mit destilliertem Wasser auf ca.
Analyselösung in den Erlenmeyerkolben und fülle mit destilliertem Wasser auf ca.  auf. Versetze den Inhalt des Erlenmeyerkolbens mit ca.
auf. Versetze den Inhalt des Erlenmeyerkolbens mit ca.  Pufferlösung
Pufferlösung  und anschließend mit Eriochromschwarz-T-Verreibung bis zur weinroten Färbung. Titriere mit einer Lösung der Ethylendiamintetraessigsäure
und anschließend mit Eriochromschwarz-T-Verreibung bis zur weinroten Färbung. Titriere mit einer Lösung der Ethylendiamintetraessigsäure  bis zum Farbumschlag nach blau.
bis zum Farbumschlag nach blau.
Wiederhole die Titration ein zweites Mal.
Experiment C
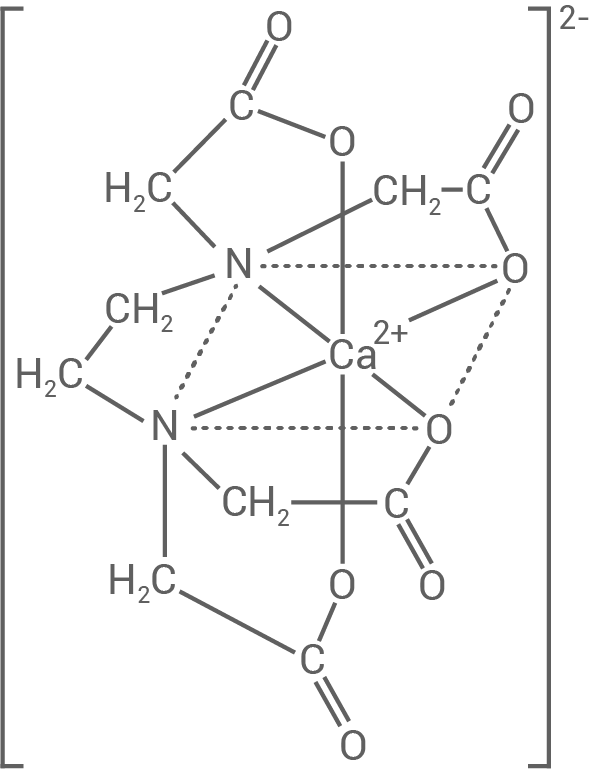
Bestimme die Stoffmengenkonzentration der Calcium-Ionen in der gesättigten Lösung mithilfe einer komplexometrischen Titration. Calcium-Ionen reagieren bei dieser Titration mit einer Ethylendiamintetraessigsäurelösung zu
einer Ethylendiamintetraessigsäurelösung zu ![\([Ca\text{(edta)}]^{2-},\)](https://mathjax.schullv.de/d6a3c912ede7be7ae3260b322a3bd02bef9efcdd1b149ef64bd11856bbdfb82e?color=5a5a5a) einem Komplex mit der abgebildeten Struktur.
Als Indikator dient Eriochromschwarz-T in Verreibung mit Natriumchlorid.
einem Komplex mit der abgebildeten Struktur.
Als Indikator dient Eriochromschwarz-T in Verreibung mit Natriumchlorid.
Bestimme die Stoffmengenkonzentration der Calcium-Ionen in der gesättigten Lösung mithilfe einer komplexometrischen Titration. Calcium-Ionen reagieren bei dieser Titration mit

Gib
Wiederhole die Titration ein zweites Mal.
2.1
Führe das Experiment durch. Gib deine Messwerte an.
(03 BE)
2.2
Berechne ausgehend von deinen Messwerten die Stoffmengenkonzentration der Calcium-Ionen. Ermittle anschließend rechnerisch mithilfe dieser Stoffmengenkonzentration das Löslichkeitsprodukt des Calciumsulfats.
(04 BE)
2.3
Begründe die Zuordnung des abgebildeten Komplex-Ions zu den Chelatkomplexen.
(01 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Lösung C1
1.1
Beobachtungen
Es ist eine Blaufärbung zu erkennen.
Es ist eine Blaufärbung zu erkennen.
1.2
Entscheidung über das vorliegende Salz
Die gegebene Stoffprobe besteht aus wasserhaltigem Natriumacetat. Wasserfreies Kupfer -sulfat dient als Nachweismittel für Wasser, da sich das Salz in Anwesenheit von Wasser aufgrund der Bildung des Salzhydrats blau färbt. Dies kann durch folgende Reaktionsgleichung veranschaulicht werden:
-sulfat dient als Nachweismittel für Wasser, da sich das Salz in Anwesenheit von Wasser aufgrund der Bildung des Salzhydrats blau färbt. Dies kann durch folgende Reaktionsgleichung veranschaulicht werden:



 oder
oder


![\([Cu(H_2O)_5]SO_4\)](https://mathjax.schullv.de/127135f1c9a8b5bd9d685cd525c491cd0ef81726ee3f91feb74c86ae6209676e?color=5a5a5a)
 oder
oder


![\([Cu(H_2O)_6]^{2+}\)](https://mathjax.schullv.de/8214802d655d2d6780a8fd213b04667589b951cd48b31525822220976914c93d?color=5a5a5a)
2.1
Beobachtungen
Es wird ein weißer Niederschlag gebildet, der sich beim Erhitzen löst und schließlich wieder beim Abkühlen bildet.
Es wird ein weißer Niederschlag gebildet, der sich beim Erhitzen löst und schließlich wieder beim Abkühlen bildet.
2.2
Temperaturabhängigkeit der Gleichgewichtslage
Dsa Prinzip des kleinsten Zwangs besagt: Wirkt auf ein chemisches System im Gleichgewicht ein äußerer Zwang, so stellt sich ein neues Gleichgewicht ein, sodass die Wirkung dieses Zwanges immer kleiner wird.
Das Gleichgewicht lautet hier:



- Hohe Temperaturen begünstigen nach dem Prinzip des kleinsten Zwangs endotherme Reaktionen, welches hier die Hinreaktion ist.
der Niederschlag löst sich auf
- Niedrige Temperaturen begünstigen exotherme Reaktionen, hier die Rückreaktion.
der Niederschlag fällt aus
3.1
Beobachtungen
Kurz vor dem Abschluss des Eindampfens wird die zunächst klare Lösung zunehmend grau bis schwarz, und sobald das Wasser vollständig verdampft ist, bildet sich an der Innenwand des Reagenzglases ein silbrig glänzender Belag – ein Silberspiegel.
Kurz vor dem Abschluss des Eindampfens wird die zunächst klare Lösung zunehmend grau bis schwarz, und sobald das Wasser vollständig verdampft ist, bildet sich an der Innenwand des Reagenzglases ein silbrig glänzender Belag – ein Silberspiegel.
3.2
Vervollständigung der Reaktionsgleichung


 Reaktionsart
Es handelt sich um eine Redoxreaktion.
Reaktionsart
Es handelt sich um eine Redoxreaktion.
4.1
Beobachtungen
Das Gemisch färbt sich rot. Beim Erhitzen entsteht rasch ein rotbrauner Niederschlag. Nach dem Filtrieren der Suspension und dem Hinzufügen einiger Tropfen Kaliumhexacyanidoferrat -Lösung zum nahezu farblosen Filtrat tritt keine Veränderung auf.
-Lösung zum nahezu farblosen Filtrat tritt keine Veränderung auf.
Das Gemisch färbt sich rot. Beim Erhitzen entsteht rasch ein rotbrauner Niederschlag. Nach dem Filtrieren der Suspension und dem Hinzufügen einiger Tropfen Kaliumhexacyanidoferrat
4.2
Prüfergebnis
Es sind keine Eisen -Ionen nachweisbar.
-Ionen nachweisbar.
4.3
Ladung des Komplex-Ions
Das Komplex-Ion trägt eine einfache positive Ladung: ![\([Fe_3(OH)_2(CH_3COO)_6]^+\)](https://mathjax.schullv.de/0b2de1224a01d4e2af7128660d6f471d42080ab1e758262dc29102d48f647f6f?color=5a5a5a)
Lösung C2
1.1
Beobachtungen und Messwert
Experiment A: weißer Niederschlag im Kalkwasser
Experiment B:
Experiment A: weißer Niederschlag im Kalkwasser
Experiment B:
1.2
Zuordnung
Experiment A: a) und b)
Experiment B: c) Reaktionsgleichungen Beim Erhitzen zerfällt Calciumcarbonat thermisch in Calciumoxid und Kohlenstoffdioxid: b)


 Durch Zugabe von Wasser wird Calciumoxid (Branntkalk) in Calciumhydroxid (Löschkalk) umgewandelt:
c)
Durch Zugabe von Wasser wird Calciumoxid (Branntkalk) in Calciumhydroxid (Löschkalk) umgewandelt:
c) 






 Wenn Calciumhydroxid mit Kohlenstoffdioxid reagiert, entsteht Calciumcarbonat:
a)
Wenn Calciumhydroxid mit Kohlenstoffdioxid reagiert, entsteht Calciumcarbonat:
a) 



Experiment B: c) Reaktionsgleichungen Beim Erhitzen zerfällt Calciumcarbonat thermisch in Calciumoxid und Kohlenstoffdioxid: b)
2.1
Messwerte
hier:
hier:
2.2
Stoffmengenkonzentration der Calcium-Ionen
Es gilt:
![\(\begin{array}[t]{rll}
n (Ca^{2+})&=& n (H_2\text{edta}^{2-}) &\\[5pt]
&=& c \cdot V &\\[5pt]
&=& 0,025\,\text{mol} \cdot \text{L}^{-1} \cdot 32\,\text{mL} &\\[5pt]
&\approx & 0,0008 \,\text{mol}
\end{array}\)](https://mathjax.schullv.de/a216a2646738ab0d50c75519e3cf9763d63d9f53fcc1c7e4991a63ea405906a2?color=5a5a5a) Mit der Stoffmenge kann nun aus dem gegebenen Volumen der Analyselösung die Stoffmengenkonzentration ermittelt werden:
Mit der Stoffmenge kann nun aus dem gegebenen Volumen der Analyselösung die Stoffmengenkonzentration ermittelt werden:
![\(\begin{array}[t]{rll}
c &=& \dfrac{n}{V} & \\[5pt]
&=& \dfrac{0,0008 \,\text{mol}}{0,1\,\text{L}} & \\[5pt]
&=& 0,008 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://mathjax.schullv.de/66949c7be320ddc9d749ff71cf6a657df2e6e550778d05fc49c7ae73197301b6?color=5a5a5a) Die Stoffmengenkonzentration der Calcium-Ionen beträgt (hier)
Die Stoffmengenkonzentration der Calcium-Ionen beträgt (hier)  Löslichkeitsprodukt des Calciumsulfats
Calciumsulfat dissoziiert gemäß der folgenden Reaktionsgleichung:
Löslichkeitsprodukt des Calciumsulfats
Calciumsulfat dissoziiert gemäß der folgenden Reaktionsgleichung:


 Es gilt:
Es gilt:
![\(\begin{array}[t]{rll}
K_L (A_XB_Y) &=& c^x (A^{m+}) \cdot c^y(B^{n-}) & \\[5pt]
&=& (0,008 \,\text{mol}\cdot \text{L}^{-1})^2 & \\[5pt] &\approx & 6 \cdot 10^{-5} \,\text{mol}^2 \cdot \text{L}^{-2}
\end{array}\)](https://mathjax.schullv.de/bc737d7f83cb122c75433ae0f65dc65e26b15df2b711e574f70143a18f1852aa?color=5a5a5a) Das Löslichkeitsprodukt des Calciumsulfats beträgt (hier)
Das Löslichkeitsprodukt des Calciumsulfats beträgt (hier) 
2.3
Begründung der Zuordnung
Bei dem abgebildeten Komplex-Ion handelt es sich um ein Chelatkomplex, da die Liganden mehrzähnig sind und über mehrere Haftatome an das Zentralteilchen binden.