HT 1 – Ameisensäure
- Stelle am Beispiel der Reaktion von Ameisensäure mit Wasser die Säure-Base-Theorie nach Brönsted dar. Begründe anhand der Molekülstruktur, dass Ameisensäure-Moleküle als Brönstedsäure fungieren.
(12 Punkte)
- Stelle die beiden Reaktionsgleichungen für die Ameisensäure-Herstellung aus Methanol und Kohlenstoffmonoxid auf. Gib den Reaktionstyp für die säurekatalysierte Reaktion von Ameisensäuremethylester und Wasser zu Ameisensäure an. Erläutere unter Verwendung geeigneter Strukturformeln einen möglichen Ablauf dieser Reaktion in Einzelschritten (M 1).
(20 Punkte)
- Stelle für den Nachweis der Ameisensäure mit Silber-Ionen eine Reaktionsgleichung auf. Begründe mithilfe der Oxidationszahlen und unter Angabe von Reaktionsgleichungen für die Teilreaktionen, dass es sich um eine Redoxreaktion handelt. Beurteile anhand zweier Aspekte die Eignung von Silber-Ionen für diesen Nachweis (M 2).
(16 Punkte)
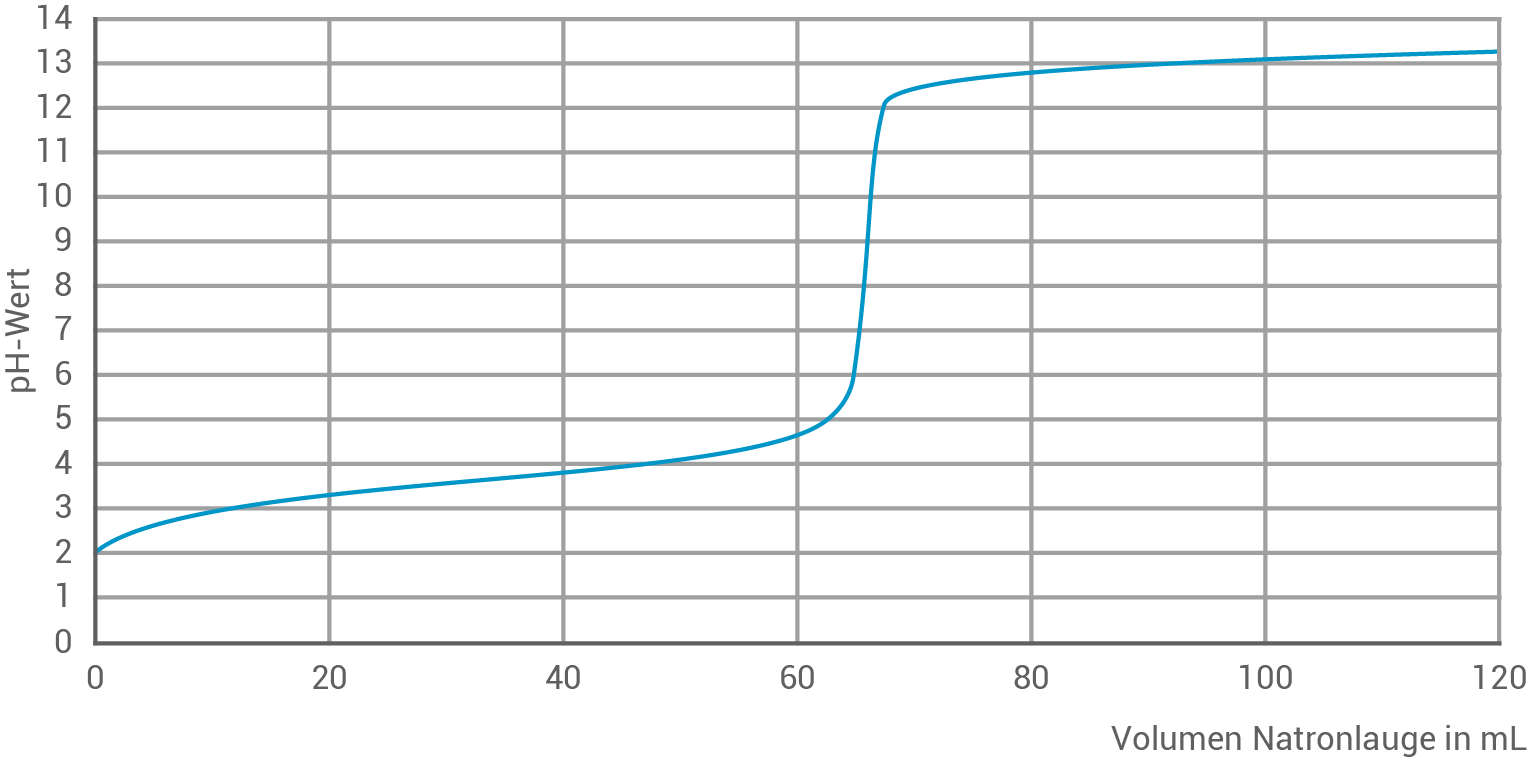
- Erstelle eine beschriftete Skizze einer Apparatur zur Titration einer Ameisensäurelösung mit Natronlauge (M 4). Ermittle grafisch den pH-Wert am Äquivalenzpunkt (Abbildung 1) und begründe die Lage des Äquivalenzpunkts. Beurteile anhand einer kommentierten Berechnung des Ameisensäuregehaltes, ob die im Experiment untersuchte Behandlungslösung für den Einsatz im Bienenstock geeignet ist (M 3).
(18 Punkte)
Fachspezifische Vorgaben:
Ameisensäure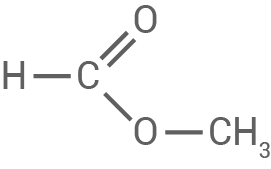
Strukturformel von Ameisensäuremethylester
Titration von  einer Ameisensäureprobe
einer Ameisensäureprobe
mit Natronlauge
mit Natronlauge

Abbildung 1:
Ausschnitt aus einer Titrationskurve einer Ameisensäurelösung mit Natronlauge
Ausschnitt aus einer Titrationskurve einer Ameisensäurelösung mit Natronlauge
Zusatzinformationen:
In ammoniakalischer Silbernitratlösung  liegen Silber-Ionen in Form eines Silberdiamminkomplexes vor
liegen Silber-Ionen in Form eines Silberdiamminkomplexes vor ![\([Ag(NH_3)_2]^+\)](https://mathjax.schullv.de/58d9563e3b909b20a29802237a5b3d83257ec2c2bd400e2459fd1fae9d160a50?color=5a5a5a) vereinfachend kann von
vereinfachend kann von  -Ionen ausgegangen werden.
-Ionen ausgegangen werden.

 Massenanteil
Massenanteil 

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Säure-Base-Theorie nach Brönsted am Beispiel von Ameisensäure
Die Reaktionsgleichung lautet:


 Eine Brönsted-Säure wird auch Protonendonator genannt und gibt Protonen ab. Eine Brönsted-Base ist der Protonenakzeptor und nimmt Protonen auf. Jede Brönsted-Säure bzw. Base besitzt eine korrespondierende Base bzw. Säure, die die Protonen aufnimmt bzw. abgibt. Diese nennt man Säure-Base-Paare.
Bei der Reaktion von Ameisensäure mit Wasser hat man zwei Säure-Base-Paare:
Eine Brönsted-Säure wird auch Protonendonator genannt und gibt Protonen ab. Eine Brönsted-Base ist der Protonenakzeptor und nimmt Protonen auf. Jede Brönsted-Säure bzw. Base besitzt eine korrespondierende Base bzw. Säure, die die Protonen aufnimmt bzw. abgibt. Diese nennt man Säure-Base-Paare.
Bei der Reaktion von Ameisensäure mit Wasser hat man zwei Säure-Base-Paare:
 als Brönsted-Säure und
als Brönsted-Säure und  als Brönsted-Base. Folglich handelt es sich bei
als Brönsted-Base. Folglich handelt es sich bei  um die korrespondierende Brönsted-Base und bei
um die korrespondierende Brönsted-Base und bei  um die korrespondierende Brönsted-Säure.
Begründung anhand der Molekülstruktur
In der Molekülstruktur der Ameisensäure ist die funktionelle Gruppe
um die korrespondierende Brönsted-Säure.
Begründung anhand der Molekülstruktur
In der Molekülstruktur der Ameisensäure ist die funktionelle Gruppe  (Carboxylgruppe) vorhanden. Diese Gruppe enthält ein leicht abspaltbares Proton
(Carboxylgruppe) vorhanden. Diese Gruppe enthält ein leicht abspaltbares Proton  das an das Sauerstoffatom der Hydroxygruppe
das an das Sauerstoffatom der Hydroxygruppe  gebunden ist. Durch die Elektronegativität des Sauerstoffatoms wird die Bindung zwischen Sauerstoff und Wasserstoff polarisiert, was das Proton besonders leicht abspaltbar macht. Das Sauerstoffatom zieht die Bindungselektronen stärker an sich, wodurch das Proton als
gebunden ist. Durch die Elektronegativität des Sauerstoffatoms wird die Bindung zwischen Sauerstoff und Wasserstoff polarisiert, was das Proton besonders leicht abspaltbar macht. Das Sauerstoffatom zieht die Bindungselektronen stärker an sich, wodurch das Proton als  leicht abgegeben werden kann. Dies macht Ameisensäure zu einer typischen Brönstedsäure.
leicht abgegeben werden kann. Dies macht Ameisensäure zu einer typischen Brönstedsäure.
2.
Reaktionsgleichungen für die Ameisensäure-Herstellung
Schritt 1:Reaktion von Methanol mit Kohlenstoffmonoxid
 Schritt 2: Hydrolyse von Ameisensäuremethylester zu Ameisensäure
Schritt 2: Hydrolyse von Ameisensäuremethylester zu Ameisensäure
 Reaktionstyp und Ablauf der säurekatalysierten Reaktion
Bei der Reaktion von Ameisensäuremethylester mit Wasser findet eine säurekatalysierte Hydrolyse statt, welche die Umkehrung einer Veresterung darstellt. Hier wird die Methoxy-Gruppe
Reaktionstyp und Ablauf der säurekatalysierten Reaktion
Bei der Reaktion von Ameisensäuremethylester mit Wasser findet eine säurekatalysierte Hydrolyse statt, welche die Umkehrung einer Veresterung darstellt. Hier wird die Methoxy-Gruppe  des Methylesters durch eine Hydroxy-Gruppe
des Methylesters durch eine Hydroxy-Gruppe  ersetzt, wodurch Ameisensäure und Methanol entstehen.
ersetzt, wodurch Ameisensäure und Methanol entstehen.
- Protonierung des Esters am Carbonylsauerstoff : Das Carbonylsauerstoffatom im Ameisensäuremethylester wird durch ein Proton (von der Säure) protoniert. Dies erhöht die positive Ladung am Kohlenstoff, wodurch dieser reaktiver für den nukleophilen Angriff wird.
- Nukleophiler Angriff des Wassers: Das Wassermolekül (als Nukleophil) greift das positivierte Carbonylkohlenstoffatom an und bildet ein tetraedrisches Zwischenprodukt.
- Umlagerung und Abspaltung von Methanol: Im nächsten Schritt wird das Proton auf die Methoxy-Gruppe übertragen, was diese in Methanol
- Bildung der Ameisensäure:
Im letzten Schritt wird ein Proton abgespalten und Ameisensäure gebildet.
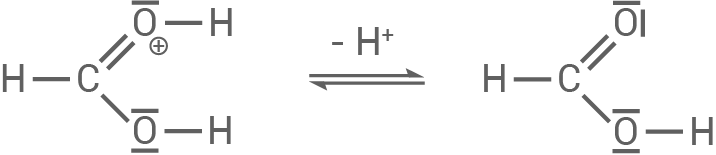
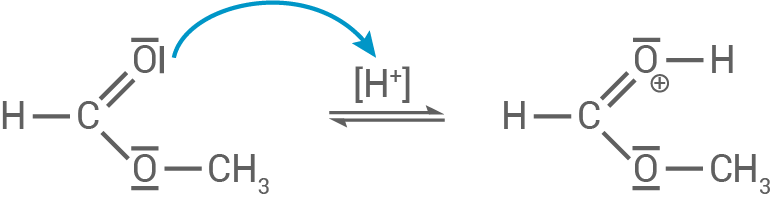
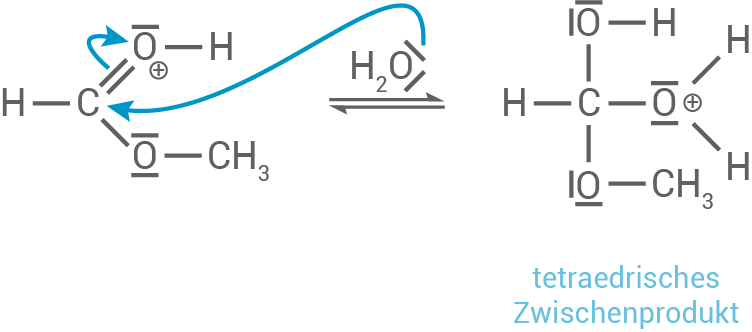
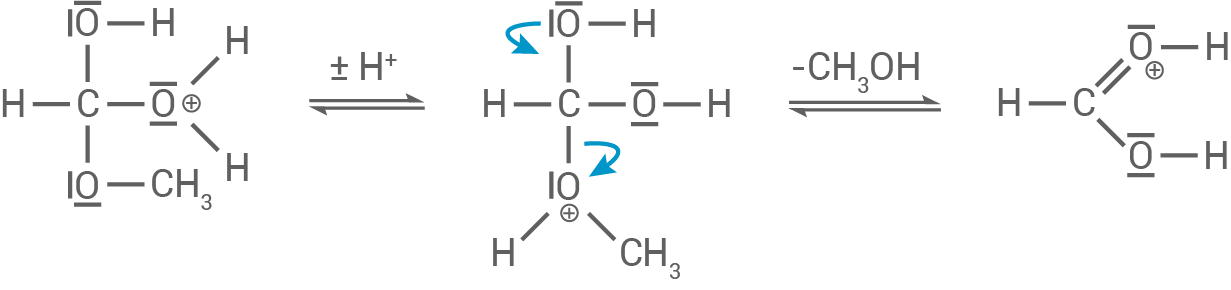
3.
Nachweis der Ameisensäure mit Silber-Ionen


 Teilreaktionen (Redoxprozess)
In dieser Reaktion wird die Ameisensäure
Teilreaktionen (Redoxprozess)
In dieser Reaktion wird die Ameisensäure  zu Kohlendioxid
zu Kohlendioxid  oxidiert. Dabei steigt die Oxidationszahl des Kohlenstoffs von
oxidiert. Dabei steigt die Oxidationszahl des Kohlenstoffs von  auf
auf  und es werden zwei Elektronen abgegeben. Gleichzeitig werden die Silber-Ionen
und es werden zwei Elektronen abgegeben. Gleichzeitig werden die Silber-Ionen  zu elementarem Silber
zu elementarem Silber  reduziert, wobei die Oxidationszahl des Silbers von
reduziert, wobei die Oxidationszahl des Silbers von  auf
auf  sinkt und zwei Elektronen aufgenommen werden. Somit handelt es sich um eine Redoxreaktion, bei der Ameisensäure als Reduktionsmittel und die Silber-Ionen als Oxidationsmittel wirken. Das entstehende elementare Silber bildet einen feinen, glänzenden Silberspiegel an der Gefäßwand.
Beurteilung der Eignung von Silber-Ionen für den Nachweis der Ameisensäure
Die Reaktion mit Silber-Ionen eignet sich gut zum Nachweis von Ameisensäure, da die Reaktion einen visuellen und eindeutigen Hinweis liefert: Den charakteristischen Silberspiegel. Silber-Ionen sind zudem leicht zu reduzieren, was zu einem klaren Ergebnis führt, da nur wenige organische Säuren eine vergleichbare Redoxreaktion mit Silber zeigen.
sinkt und zwei Elektronen aufgenommen werden. Somit handelt es sich um eine Redoxreaktion, bei der Ameisensäure als Reduktionsmittel und die Silber-Ionen als Oxidationsmittel wirken. Das entstehende elementare Silber bildet einen feinen, glänzenden Silberspiegel an der Gefäßwand.
Beurteilung der Eignung von Silber-Ionen für den Nachweis der Ameisensäure
Die Reaktion mit Silber-Ionen eignet sich gut zum Nachweis von Ameisensäure, da die Reaktion einen visuellen und eindeutigen Hinweis liefert: Den charakteristischen Silberspiegel. Silber-Ionen sind zudem leicht zu reduzieren, was zu einem klaren Ergebnis führt, da nur wenige organische Säuren eine vergleichbare Redoxreaktion mit Silber zeigen.
4.
Skizze zur Titration einer Ameisensäurelösung mit Natronlauge
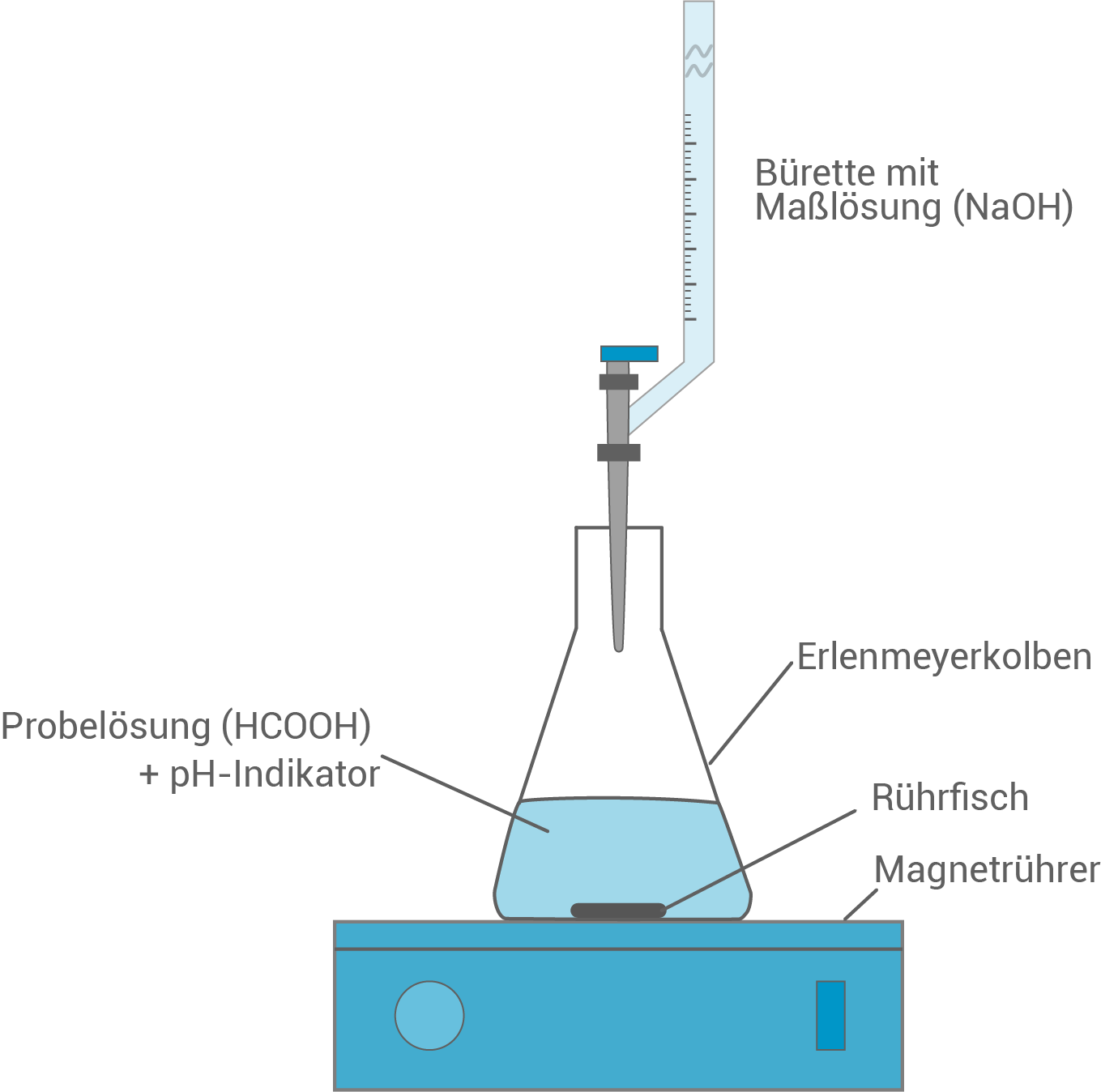 Grafische Ermittlung des pH-Wertes am Äquivalenzpunkt
Der Äquivalenzpunkt in einer Titration ist der Punkt, an dem die Menge der zugegebenen Base genau der Menge der in der Lösung vorhandenen Säure entspricht, sodass alle Säuremoleküle neutralisiert sind. In der Titrationskurve ist dieser Punkt als ein deutlicher Sprung im pH-Wert zu erkennen. In diesem Experiment wird der Äquivalenzpunkt bei einem Volumen von ca.
Grafische Ermittlung des pH-Wertes am Äquivalenzpunkt
Der Äquivalenzpunkt in einer Titration ist der Punkt, an dem die Menge der zugegebenen Base genau der Menge der in der Lösung vorhandenen Säure entspricht, sodass alle Säuremoleküle neutralisiert sind. In der Titrationskurve ist dieser Punkt als ein deutlicher Sprung im pH-Wert zu erkennen. In diesem Experiment wird der Äquivalenzpunkt bei einem Volumen von ca.  zugegebener Natronlauge erreicht. Der pH-Wert am Äquivalenzpunkt beträgt demnach etwa
zugegebener Natronlauge erreicht. Der pH-Wert am Äquivalenzpunkt beträgt demnach etwa  Dieser leicht basische Wert entsteht, weil es sich bei Ameisensäure um eine schwache Säure handelt, die mit einer starken Base (Natronlauge) titriert wird. Am Äquivalenzpunkt bleibt das konjugierte Basen-Anion der Ameisensäure, das Formiat-Ion
Dieser leicht basische Wert entsteht, weil es sich bei Ameisensäure um eine schwache Säure handelt, die mit einer starken Base (Natronlauge) titriert wird. Am Äquivalenzpunkt bleibt das konjugierte Basen-Anion der Ameisensäure, das Formiat-Ion  in der Lösung zurück. Dieses Ion reagiert basisch und erhöht daher den pH-Wert leicht über
in der Lösung zurück. Dieses Ion reagiert basisch und erhöht daher den pH-Wert leicht über  Die Lage des Äquivalenzpunktes bei
Die Lage des Äquivalenzpunktes bei  ist typisch für die Titration einer schwachen Säure mit einer starken Base.
Berechnung des Ameisensäuregehaltes
Mit dem Volumen der zugefügten Natronlauge und deren Stoffmengenkonzentration kann zunächst die Stoffmenge der zugefügten Natronlauge berechnet werden:
ist typisch für die Titration einer schwachen Säure mit einer starken Base.
Berechnung des Ameisensäuregehaltes
Mit dem Volumen der zugefügten Natronlauge und deren Stoffmengenkonzentration kann zunächst die Stoffmenge der zugefügten Natronlauge berechnet werden:
![\(\begin{array}[t]{rll}
n (NaOH) &=& c(NaOH) \cdot V(NaOH) & \\[5pt]
&=& 1,0 \, \text{mol} \cdot \text{L}^{-1} \cdot 65,0 \, \text{mL} & \\[5pt]
&=& 1,0 \, \text{mol} \cdot \text{L}^{-1} \cdot 0,065 \, \text{L} & \\[5pt]
&=& 0,065 \, \text{mol}
\end{array}\)](https://mathjax.schullv.de/a16f60d4ea2eeb07cbe383c1318ee6af8628a95d98d92f2fe0c56e2f7be3f8d3?color=5a5a5a) Da sich am Äquivalenzpunkt die Stoffmengen der Säure und der Base entsprechen, ergibt sich:
Da sich am Äquivalenzpunkt die Stoffmengen der Säure und der Base entsprechen, ergibt sich:
 Darauffolgend kann nun die Masse der Ameisensäure berechnet werden:
Nun wird der Massenanteil der Ameisensäure in der Behandlungslösung berechnet:
Darauffolgend kann nun die Masse der Ameisensäure berechnet werden:
Nun wird der Massenanteil der Ameisensäure in der Behandlungslösung berechnet:
![\(\begin{array}[t]{rll}
w &=& \dfrac{m(HCOOH)}{m\,_\text{Lösung}} \cdot 100\% & \\[5pt]
&=& \dfrac{2,992 \,\text{g}}{5,0 \,\text{g}} \cdot 100\% & \\[5pt]
&=& 59,84\% \approx 60\%
\end{array}\)](https://mathjax.schullv.de/901db867d9ca9a38fc829a9aec94dbd645c3c5823c8d72ae7422d36bb59278b0?color=5a5a5a) Beurteilung der Eignung für den Einsatz im Bienenstock
Ein Massenanteil von ca.
Beurteilung der Eignung für den Einsatz im Bienenstock
Ein Massenanteil von ca.  Ameisensäure entspricht der üblichen Konzentration, die zur Bekämpfung der Varroamilbe in der Imkerei eingesetzt wird. Diese Konzentration ist ausreichend hoch, um die Milben abzutöten, aber auch kontrolliert genug, um bei sachgemäßer Anwendung keine Schäden bei den Bienen zu verursachen. Die Ameisensäure verdunstet langsam und erreicht so eine effektive Konzentration im Bienenstock, die über einen bestimmten Zeitraum aufrechterhalten werden kann. Somit ist die im Experiment untersuchte Behandlungslösung für den Einsatz im Bienenstock geeignet und stellt eine wirksame Maßnahme zur Bekämpfung der Varroamilbe dar, ohne das Wohl der Bienen zu gefährden.
Ameisensäure entspricht der üblichen Konzentration, die zur Bekämpfung der Varroamilbe in der Imkerei eingesetzt wird. Diese Konzentration ist ausreichend hoch, um die Milben abzutöten, aber auch kontrolliert genug, um bei sachgemäßer Anwendung keine Schäden bei den Bienen zu verursachen. Die Ameisensäure verdunstet langsam und erreicht so eine effektive Konzentration im Bienenstock, die über einen bestimmten Zeitraum aufrechterhalten werden kann. Somit ist die im Experiment untersuchte Behandlungslösung für den Einsatz im Bienenstock geeignet und stellt eine wirksame Maßnahme zur Bekämpfung der Varroamilbe dar, ohne das Wohl der Bienen zu gefährden.
