HT 1 – Galvanische Elemente nach GROVE und BUNSEN
1.
Beschreibe den Aufbau des GROVE-Elements unter Zuordnung der Pole. Gib die Teilgleichungen sowie die Gesamtgleichung der im GROVE-Element ablaufenden Redoxreaktion bei Betrieb an. Berechne die in Versuch 1 geflossene Ladungsmenge 
(18 Punkte)
2.
Gib die Gleichung der Kathodenreaktion sowie die Gesamtgleichung der im BUNSEN-Element ablaufenden Redoxreaktion bei Betrieb an. Berechne die theoretische Spannung  des in Versuch 2 beschriebenen Elements. Begründe die NERNST-Gleichung für die Dichromat-Halbzelle.
des in Versuch 2 beschriebenen Elements. Begründe die NERNST-Gleichung für die Dichromat-Halbzelle.
(16 Punkte)
3.
Deute die Beobachtungen nach Zugabe von Bromwasserstoffsäure bei der Wiederholung von Versuch 2. Begründe auch anhand einer Reaktionsgleichung ihre Deutung. Begründe anhand der Beobachtungen, dass bei der Wiederholung des Versuchs 2 ein Zink-Brom-Element vorliegt.
(16 Punkte)
4.
Prüfe das vorgeschlagene Modellexperiment hinsichtlich seiner Funktionalität als galvanisches Element. Gib die im Betrieb darin ablaufenden Prozesse auf Teilchenebene an. Beurteile vergleichend die Weiterentwicklung der drei beschriebenen galvanischen Elemente anhand der eingesetzten Stoffe und Materialien auch hinsichtlich Umwelteigenschaften und Störanfälligkeit.
Fachspezifische Vorgaben:
(16 Punkte)
1839 hatte WILLIAM GROVE ein galvanisches Element entwickelt, in dem ein Zinkblech in verdünnte Schwefelsäure  und ein Platinblech als Kathode in Salpetersäure
und ein Platinblech als Kathode in Salpetersäure  eintaucht. Die Lösungen wurden durch einen porösen, ionendurchlässigen Tonzylinder getrennt (Abbildung 1). Das Element lieferte für die damalige Zeit hohe Stromstärken, jedoch wurde beim Betrieb das Platin angegriffen und als Produkt entstand gasförmiges Stickstoffdioxid
eintaucht. Die Lösungen wurden durch einen porösen, ionendurchlässigen Tonzylinder getrennt (Abbildung 1). Das Element lieferte für die damalige Zeit hohe Stromstärken, jedoch wurde beim Betrieb das Platin angegriffen und als Produkt entstand gasförmiges Stickstoffdioxid  ROBERT BUNSEN entwickelte 1841 das Element weiter, indem er das Platin durch poröse Kohle ersetzte. Als Elektrolyten nutzte er eine saure Kaliumdichromat-Lösung
ROBERT BUNSEN entwickelte 1841 das Element weiter, indem er das Platin durch poröse Kohle ersetzte. Als Elektrolyten nutzte er eine saure Kaliumdichromat-Lösung  die die Salpetersäure ersetzte. Die von BUNSEN entwickelte Batterie war damals die leistungsfähigste Stromquelle.
die die Salpetersäure ersetzte. Die von BUNSEN entwickelte Batterie war damals die leistungsfähigste Stromquelle.
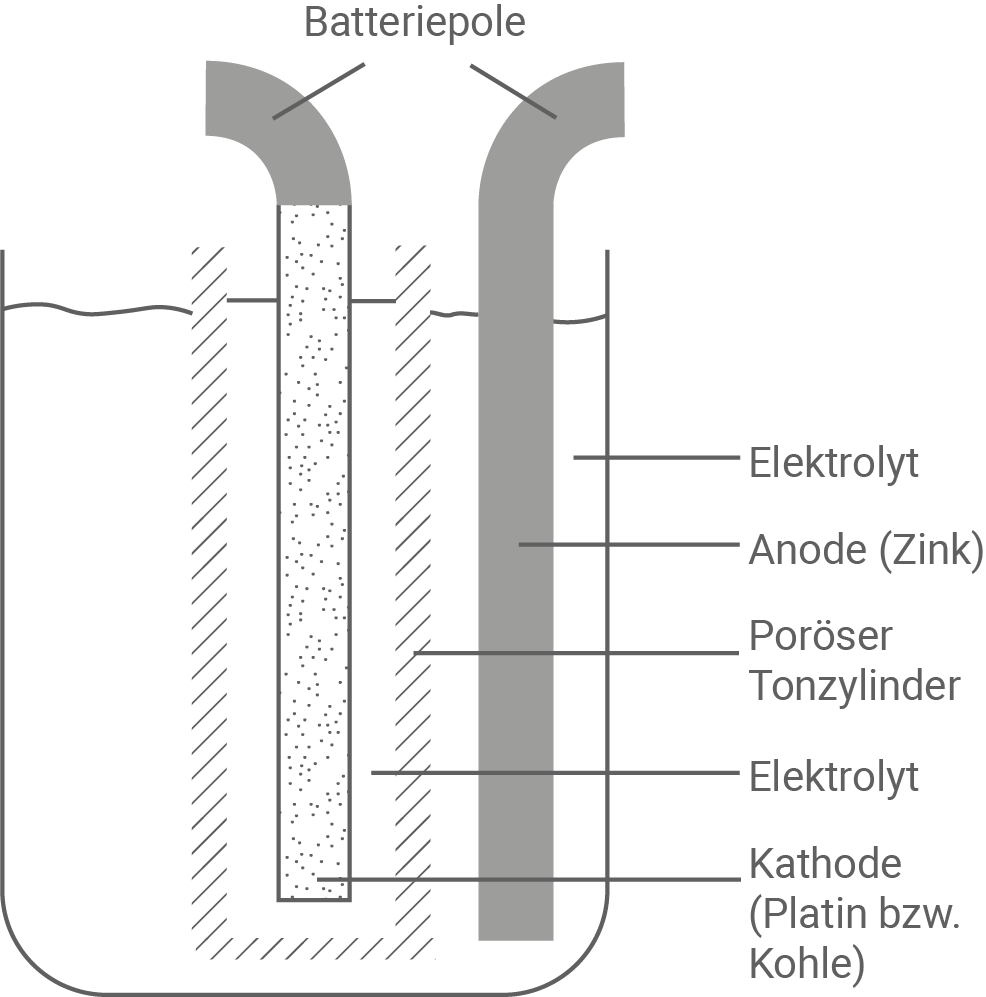
Abbildung 1: Historischer Aufbau der galvanischen Elemente von GROVE und BUNSEN
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Beschreibung des Aufbaus vom GROVE-Element und Zuordnung der Pole
 Wie viel Zink umgesetzt wurde, ergibt sich aus der Differenz der Massen vor und nach dem Versuch:
Wie viel Zink umgesetzt wurde, ergibt sich aus der Differenz der Massen vor und nach dem Versuch:
![\(\begin{array}[t]{rll}
m(Zn) &=& 45,00 \,\text{g} - 26,04 \,\text{g} & \\[5pt]
&=& 18,96 \,\text{g} & \\[10pt]
n (Zn )&=& \dfrac{m(Zn)}{M(Zn)} & \\[5pt]
&=& \dfrac{18,96 \,\text{g}}{65,38 \,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx & 0,29 \,\text{mol} & \\[10pt]
Q &=& n(Zn) \cdot z \cdot F & \\[5pt]
&=& 0,29 \,\text{mol} \cdot 2 \cdot 96485\,\dfrac{\text{A} \cdot \text{s}}{\text{mol}} & \\[5pt]
&\approx& 55960 \,\text{A} \cdot \text{s}
\end{array}\)](https://mathjax.schullv.de/54ebc44db12810c4e46ba27c1e543c70b988e9a7763a79b0fed9fe5ad550d3e3?color=5a5a5a)
- Das GROVE-Element ist aufgebaut wie ein klassisches galvanisches Element: 2 Halbzellen, die durch einen porösen Tonzylinder getrennt sind.
- Eine Zinkelektrode bildet die Zink-Halbzelle, wobei diese in Schwefelsäure (Elektrolyt) eintaucht. Die Zinkelektrode stellt den Minuspol der Batterie dar.
- Eine Platinelektrode, getaucht in Salpetersäure (Elektrolyt), bildet die zweite Halbzelle. Diese stellt den Pluspol der Batterie dar.
2.
Kathodenreaktion und Gesamtgleichung
Berechnung der theoretischen Spannung
Es gilt:
![\(\begin{array}[t]{rll}
U &= & E_{\text{A}}-E_{\text{D}} & \\[10pt]
\end{array}\)](https://mathjax.schullv.de/8d407133e0d0412dac8d13ada3f1d4a9ebd48695a06fc2620c549fb3c2534791?color=5a5a5a) Dafür wird berechnet:
Einsetzen:
Dafür wird berechnet:
Einsetzen:
![\(\begin{array}[t]{rll}
U &= & 1,41 \,\text{V} - (-0,85 \,\text{V}) & \\[5pt]
&= & 2,26 \,\text{V} & \\[5pt]
\end{array}\)](https://mathjax.schullv.de/e06e4aeed2c5f3609fd1355e0945749b3ded4edcf280b5d29c57c01e70b5acd9?color=5a5a5a) Begründung der NERNST-Gleichung für die Dichromat-Halbzelle
Begründung der NERNST-Gleichung für die Dichromat-Halbzelle
- Wird das Chrom
-Ionen/Dichromat-Ionen-Redoxsystem auf die NERNST-Gleichung angewendet, führt dies zur angegebenen Gleichung.
- Die reduzierte Form des Redoxsystems wird dargestellt durch die Chrom
-Ionen; die oxidierte Form durch Dichromat-Ionen.
- Die NERNST-Gleichung stellt im Quotienten die stöchiometrischen Koeffizienten des Redoxsystems als Exponenten dar.
3.
Deutung der Beobachtungen nach Zugabe von Bromwasserstoffsäure
- Es lässt sich eine braune Färbung beobachten, die auf die Bildung von elementarem Brom hindeutet.
- Das Redoxsystem im Bunsen-Element verändert sich, wodurch eine andere Potenzialdifferenz zwischen den Halbzellen herrscht. Folglich wird eine andere Spannung gemessen.
- Durch die Dichromat-Ionen werden die Bromid-Ionen zu elementarem Brom oxidiert. Außerdem entstehen Wasser und Chrom
-Ionen.
- Durch die Redoxpotentiale wird gezeigt, dass Dichromat-Ionen durch Bromid-Ionen reduziert werden können. Die Bromid-Ionen wirken also als Reduktionsmittel.
- Die Potentialdifferenz der Standardpotentiale
und
entspricht ungefähr der Ruhespannung.
- Die Reaktion mit Bromid-Ionen bewirkt, dass fast keine Dichromat-Ionen mehr in der Lösung vorliegen. Weiterhin entsteht elementares Brom.
- Das in der kathodischen Halbzelle vorliegende Chrom
-Ionen/Dichromat-Ionen-Redoxsystem wird durch ein Bromid/Brom-Redoxsystem abgelöst.
4.
Prüfung der Funktionalität als galvanisches Element
 eingesetzte Stoffe und Materialien, Umwelteigenschaften, Störanfälligkeit
eingesetzte Stoffe und Materialien, Umwelteigenschaften, Störanfälligkeit
- Durch das Redoxpotential der Zinkhalbzelle fungiert diese als Donatorhalbzelle.
- Die Peroxidisulfat-Ionen liegen in der Akzeptorhalbzelle in saurer Lösung vor und wirken als ein sehr gutes Oxidationsmittel. Kommt es an der Kohleelektrode zur Reduktion, entstehen Sulfat-Ionen.
- Zwischen den beiden Halbzellen kommt es zu einem Ladungsaustausch, der durch eine kationendurchlässige Membran gewährleistet wird.
- Der Versuchsaufbau zeigt ein funktionsfähiges galvanisches Element.
- Es kommt zur Oxidation der Zink-Atome zu Zink-Ionen, die sich im Elektrolyten lösen.
- Über den äußeren Draht wandern die Elektronen von der Zinkelektrode zur Kohleelektrode.
- An der Kohleelektrode werden die Peroxodisulfat-Ionen aus dem Elektrolyten zu Sulfat-Ionen reduziert.
- Durch Diffusion der positiv geladenen Zink-Ionen durch die Membran, wird die Ladung ausgeglichen.
- Alle beschriebenen Elementen zeigen den gleichen Aufbau der Zink-Halbzelle.
- Die teure Platinelektrode im BUNSEN-Element wird im GROVE-Element durch eine günstige Kohleelektrode ersetzt. Die Salpetersäure, die als Oxidationsmittel fungiert, wird durch eine Kaliumdichromat-Lösung ersetzt. Hierbei handelt es sich zwar auch um einen Stoff mit hohem Gefahrenpotential, jedoch wird die Bildung von giftigem, gasförmigen Stickstoffdioxid vermieden.
- Das Modellexperiment zeigt als Oxidationsmittel den Einsatz einer Kaliumperoxodisulfat-Lösung. Der Vorteil hierbei ist ein weit geringeres Gefahrenpotential für die Umwelt im Vergleich zu den Elektrolyten im Kathodenraum der historischen Elemente.
- Bei den anderen Elementen ist es möglich, dass oxidierend wirkende Ionen in den Elektrolyten der Anodenräume wandern. Dies wird im Modellexperiment durch eine kationenselektive Membran verhindert, wodurch die Störanfälligkeit geringer ist.