HT 2 – Blausäure – Eigenschaften und ihr Einsatz in der organischen Chemie
1.
Gib eine Reaktionsgleichung für die industrielle Herstellung der Blausäure bei rund  aus Ammoniak und Methan an der Luft an. Erkläre anhand dieser Reaktionsgleichung und unter Angabe von Oxidationszahlen, dass es sich bei dieser Herstellung der Blausäure um eine Redoxreaktion handelt. Begründe mithilfe einer Reaktionsgleichung, dass es sich bei der in-situ-Herstellung von Blausäure um eine Säure-Base-Reaktion handelt.
aus Ammoniak und Methan an der Luft an. Erkläre anhand dieser Reaktionsgleichung und unter Angabe von Oxidationszahlen, dass es sich bei dieser Herstellung der Blausäure um eine Redoxreaktion handelt. Begründe mithilfe einer Reaktionsgleichung, dass es sich bei der in-situ-Herstellung von Blausäure um eine Säure-Base-Reaktion handelt.
(18 Punkte)
2.
Erläutere einen möglichen Ablauf der Reaktion von Ammoniak- und Isobutanal-Molekülen zu einem Zwischenprodukt bei Schritt 1 der Strecker-Synthese in Einzelschritten. Erkläre die abschließende Hydrolyse des 2. Reaktionsschritts unter Angabe einer Reaktionsgleichung.
(20 Punkte)
3.
Berechne unter Angabe der der Titration zugrunde liegenden Reaktion die Massenkonzentration von Blausäure in der untersuchten Probe. Bewerte auf Basis Ihres Ergebnisses das Gefährdungspotential bei der Einleitung des Abwassers in ein Gewässer.
(12 Punkte)
4.
Plane einen Versuchsaufbau zur pH-metrischen Titration von Blausäure mit Natronlauge. Berechne die pH-Werte dieser Titration zu Beginn, am Halbäquivalenzpunkt, am Äquivalenzpunkt und am Endpunkt der Titration unter Vernachlässigung eventueller Verdünnungseffekte. Skizziere anhand der berechneten pH-Werte den ungefähren Verlauf der Titrationskurve.
Fachspezifische Vorgaben:
Trotz ihres Gefährdungspotentials ist Blausäure (Cyanwasserstoff,
(16 Punkte)
Hierbei kommt neben anderen Verfahren das Andrussow-Verfahren zum Einsatz, bei dem ein Gemisch aus Ammoniak, Methan und Sauerstoff aus der Luft bei rund
Eine weitere Möglichkeit ist, die Blausäure in situ (also direkt im Reaktor) herzustellen. Hierzu lässt man Ammoniumchlorid
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Reaktionsgleichung für die industrielle Herstellung von Blausäure


 Erklärung der Redoxreaktion
Erklärung der Redoxreaktion
- Die jeweilige Oxidationszahl des Kohlenstoff-Atoms der beteiligten Methanmoleküle steigt: -IV
+II;
Es findet eine Oxidation statt. - Die jeweilige Oxidationszahl des Sauerstoff-Atoms der beteiligten Sauerstoffmoleküle sinkt: 0
-II;
Es findet eine Reduktion statt. - Bei der industriellen Herstellung der Blausäure liegt folglich insgesamt eine Redoxreaktion vor.
- Reaktionsgleichung:
⇋
- Das Ammonium-Ion
stellt die Säure dar und korrespondiert mit der durch Ammoniak
dargestellten Base.
- Folglich stellt das Cyanid-Ion
eine Base dar, die mit der Säure
korrespondiert.
2.
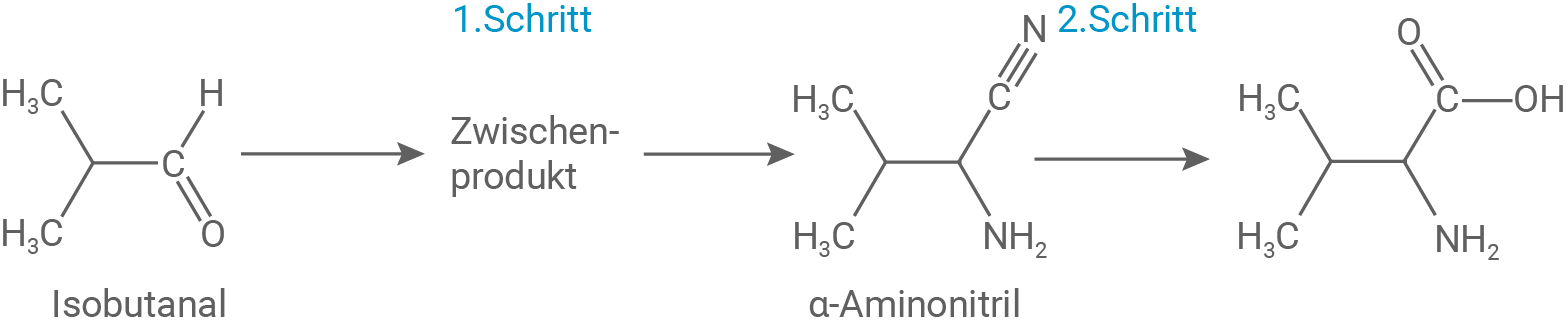
Möglicher Ablauf bei Schritt 1 der Strecker-Synthese
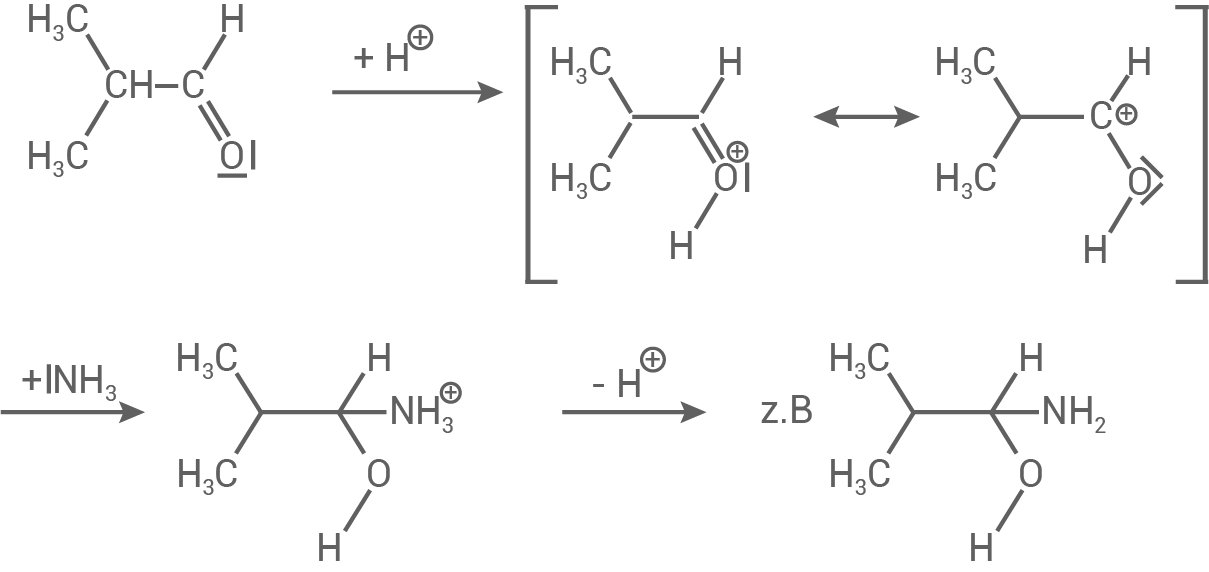

- Bei der Reaktion von Ammoniak mit Isobutanal wird unter Verwendung eines Katalysators zuerst das Sauerstoff-Atom des Isobutanals angegriffen, wodurch dieses positiv geladen ist.
- Als Intermediat (eckige Klammern) entsteht hierbei ein Carbokation (mesomere Grenzformeln).
- Anschließend wird das positive Kohlenstoff-Atom des Carbokations nucleophil vom Ammoniak-Molekül angegriffen.
- Unter Abspaltung und Rückgewinnung des Katalysators wird ein Imin als Zwischenprodukt gebildet.

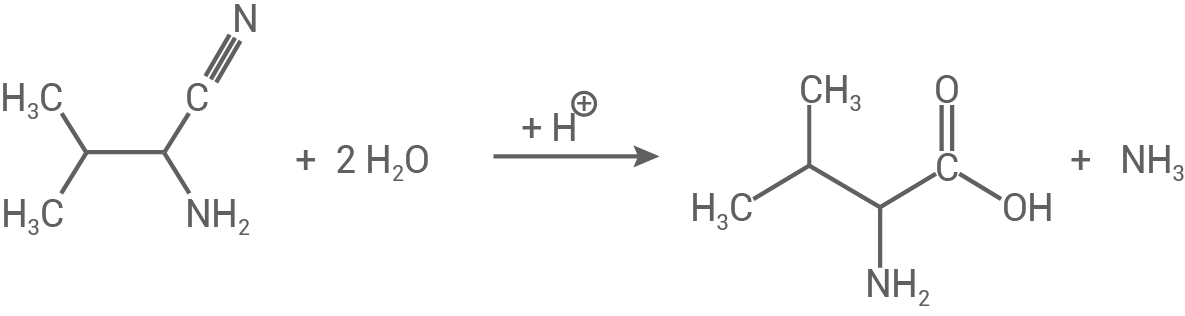
- Am Kohlenstoff kommt es zu einer zweifachen Hydrolyse, welches über eine Dreifachbindung mit dem Stickstoff-Atom verbunden ist.
- Das Kohlenstoff-Atom wird hierbei zweimal nucleophil vom Wasser-Molekül angegriffen.
3.
Berechnung der Massenkonzentration an Blausäure
Reaktionsgleichung:


 Bei einer Titration gilt am Äquivalenzpunkt:
Bei einer Titration gilt am Äquivalenzpunkt:
 Es folgt:
Es folgt:
![\(\begin{array}[t]{rll}
n(HCN)&=& c (NaOH) \cdot V (NaOH) & \\[5pt]
&=& 0,01 \,\dfrac{\text{mol}}{\text{L}} \cdot 9,8 \,\text{mL} & \\[5pt]
&=& 0,098 \,\text{mmol} & \\[5pt]
\end{array}\)](https://mathjax.schullv.de/26fb73a5f75c5544ddc39890bc1dce612b993a24e026c296c81a8ef151f17e2e?color=5a5a5a) Damit lässt sich folglich die Masse an Blausäure in
Damit lässt sich folglich die Masse an Blausäure in  berechnen:
berechnen:
![\(\begin{array}[t]{rll}
m(HCN)&=& n (HCN) \cdot M(HCN) & \\[5pt]
m(HCN)&=& 0,000098 \,\text{mol} \cdot 27,03 \,\dfrac{\text{g}}{\text{mol}} & \\[5pt]
&=& 0,00265 \,\text{g} & \\[5pt]
\end{array}\)](https://mathjax.schullv.de/6acfdf63564bd8a14a8716de091b93c1d178a000ebb41ec96bec3152443a962c?color=5a5a5a) In der Probe ist ungefähr eine Massenkonzentration von
In der Probe ist ungefähr eine Massenkonzentration von
 enthalten.
Bewertung des Gefährdungspotentials bei der Einleitung des Abwassers in ein Gewässer
enthalten.
Bewertung des Gefährdungspotentials bei der Einleitung des Abwassers in ein Gewässer
- Für Fische gelten schon Cyanid-Ionen-Konzentrationen ab
als kritisch. Die berechnete Massenkonzentration ist mit
deutlich höher.
- Folglich ist mit einer Tiergefährdung in dem Gewässer zu rechnen.
4.
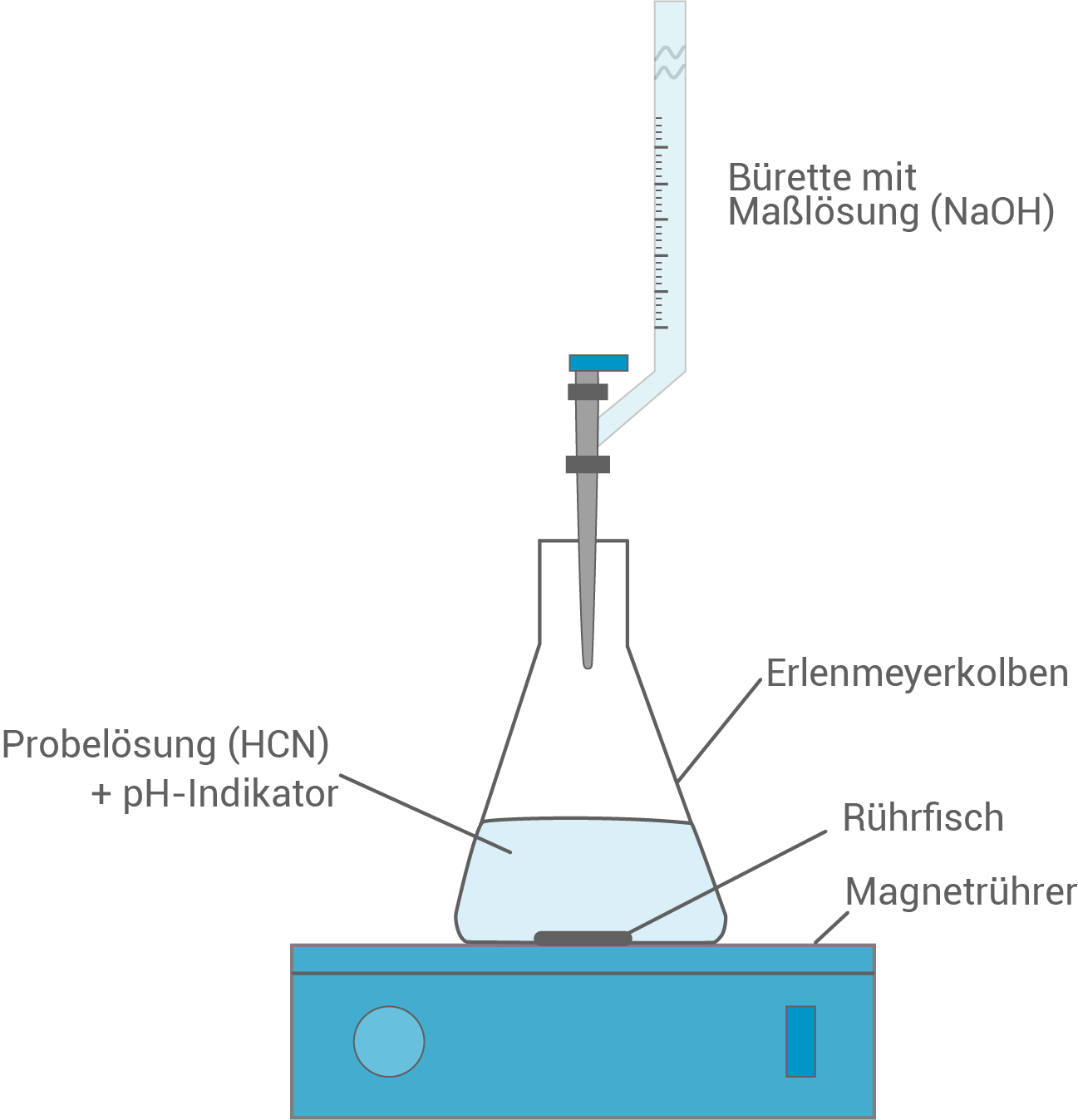
Planung eines Versuchsaufbaus zur pH-metrischen Titration
Skizze:
 Berechnung der pH-Werte
Berechnung der pH-Werte
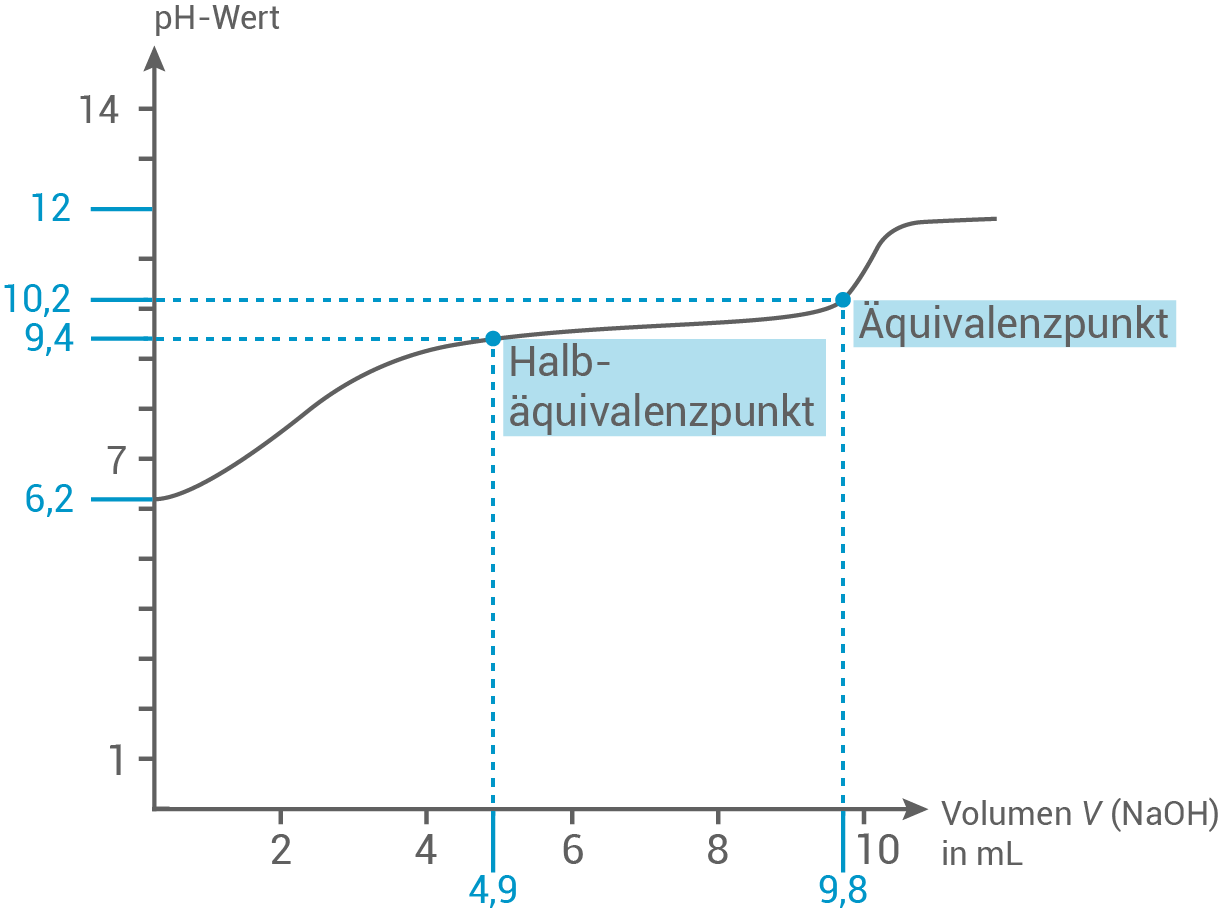

- Zu Beginn der Titration:
- Am Halbäquivalenzpunkt:
- Am Äquivalenzpunkt:
- Am Ende der Titration:
