HT 2 – Korrosionsprobleme im Bootssport
- Erkläre am Beispiel des Rostens von Eisen den Begriff Korrosion. Gib die Reaktionsgleichungen für die beim Rosten von Eisen ablaufenden Reaktionen an. Erläutere die Vorgänge der Sauerstoffkorrosion von Eisen bis zur Entstehung von Eisen
-hydroxid, auch indem du die Abbildung 2 (Anhang) durch Formeln und Teilgleichungen ergänzt.
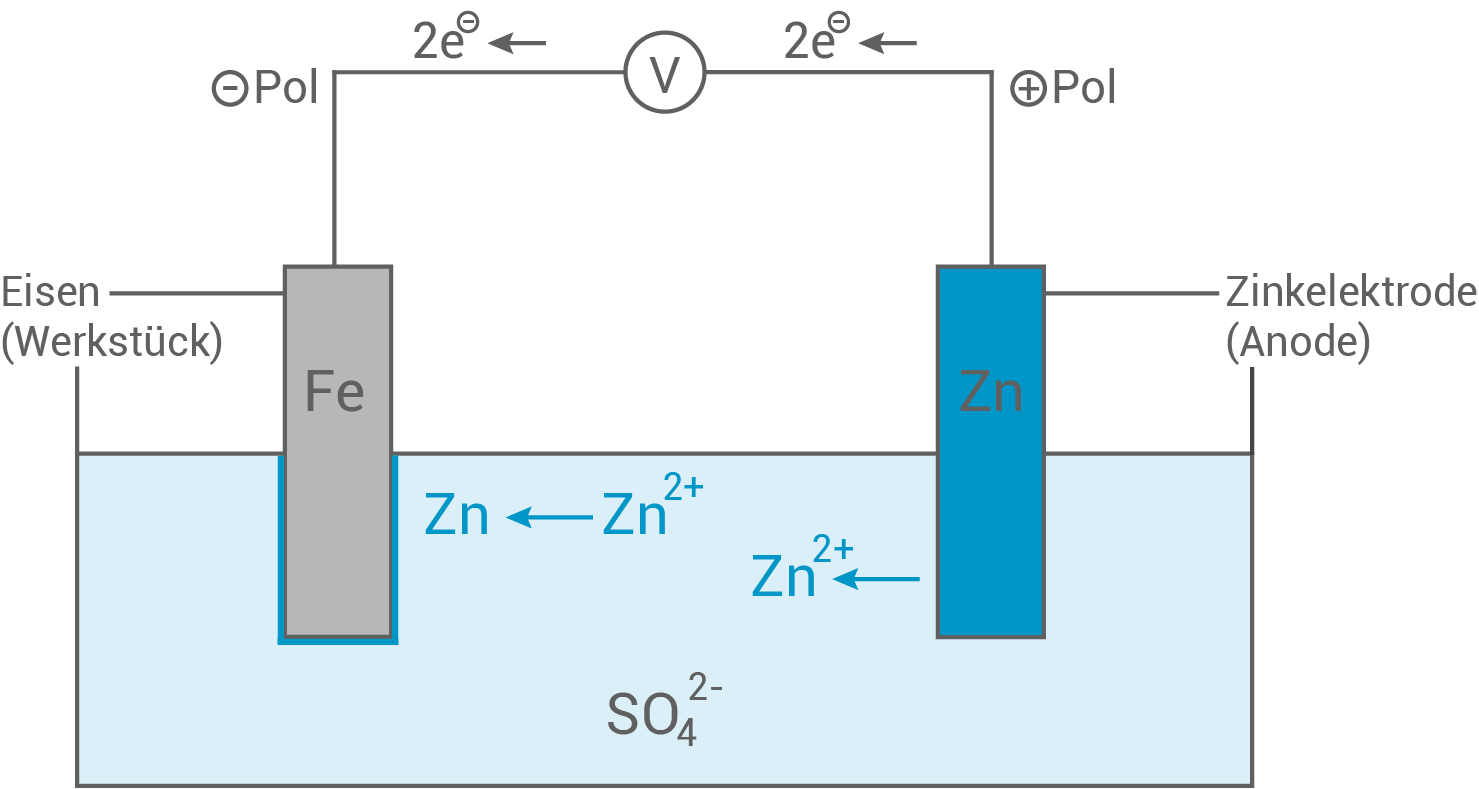
(16 Punkte) - Skizziere einen möglichen experimentellen Aufbau zur Galvanisierung eines Eisenwerkstückes. Erläutere anhand von Teilgleichungen für die beim Verzinken von Eisen ablaufenden Reaktionen den Prozess des Galvanisierens. Berechne die Stromstärke, bei der die Verzinkung der Ankerkette in Experiment 1 durchgeführt wurde.
(18 Punkte)
- Berechne die Spannung einer Konzentrationszelle aus der Vergleichshalbzelle und einer Halbzelle mit einer Probelösung, deren Konzentration dem Richtwert von
entspricht (Experiment 2). Erläutere das Auftreten einer Spannung und begründe anhand der Rechnung, wie sich die Spannung beim Überschreiten des Richtwertes ändert.
(16 Punkte) - Erläutere die Beobachtungen bei Experiment 3 auch mithilfe von Teilgleichungen. Erläutere vor dem Hintergrund der Beobachtungen den Begriff „Opferanode“ und diskutiere die Rahmenbedingungen, die zum Schutz des Eisens mit dieser Methode gewährleistet sein müssen.
(16 Punkte)
Eine Eisenkette mit einer Masse von
Beim galvanischen Verzinken fallen Lösungen an, die Zink
Einsatz von Opferanoden
An vielen Schiffsrümpfen kann man große Blöcke aus Magnesium oder Zink wahrnehmen (Foto). Diese Blöcke werden auch als „Opferanoden“ bezeichnet. Die Anzahl der Opferanoden variiert mit der Größe der zu schützenden Teile. Die Funktionsweise einer solchen Anordnung wird in einem Laborexperiment untersucht.

Abbildung 1: Schiffsrumpf und Ruderblatt mit Opferanoden aus Zink (oben links am Ruderblatt und vor dem Propeller)
Quelle: https://www.oxly.de/foto/displayimage.php?pid=4976 (Zugriff 14.01.2022)
Quelle: https://www.oxly.de/foto/displayimage.php?pid=4976 (Zugriff 14.01.2022)
a)
In einer Petrischale wird ein gereinigter Eisennagel in eine wässrige Natriumchloridlösung gelegt, die mit wenig Phenolphthalein und Kaliumhexacyanoferrat versetzt wurde.
Beobachtungen: Um den Nagel sind nach einiger Zeit sowohl blaue als auch purpurfarbene Verfärbungen zu sehen.
versetzt wurde.
Beobachtungen: Um den Nagel sind nach einiger Zeit sowohl blaue als auch purpurfarbene Verfärbungen zu sehen.
b)
In eine zweite Petrischale werden ein an der Oberfläche gereinigtes Zinkstück und darauf ein ebenfalls gereinigter Eisennagel gelegt, sodass sich beide Metalle berühren. Danach wird eine wässrige Natriumchloridlösung, die mit wenig Phenolphthalein und Kaliumhexacyanoferrat versetzt wurde, vorsichtig in die Petrischale gegossen.
Beobachtungen: Am Eisennagel verfärbt sich die Lösung purpur. Am Zinkstück bildet sich ein gelblich-weißer Niederschlag.
versetzt wurde, vorsichtig in die Petrischale gegossen.
Beobachtungen: Am Eisennagel verfärbt sich die Lösung purpur. Am Zinkstück bildet sich ein gelblich-weißer Niederschlag.
Zusatzinformationen:
Kaliumhexacyanoferrat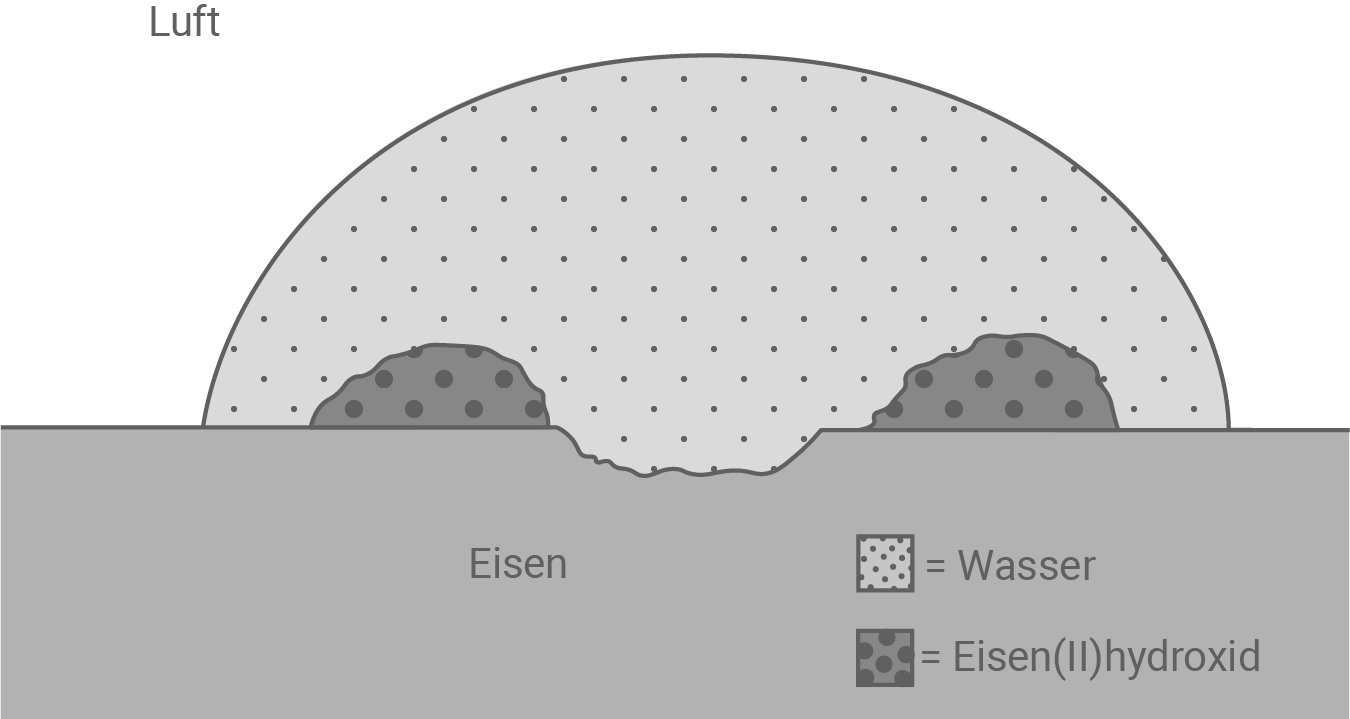
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Erklärung Korrosion am Beispiel des Rostens
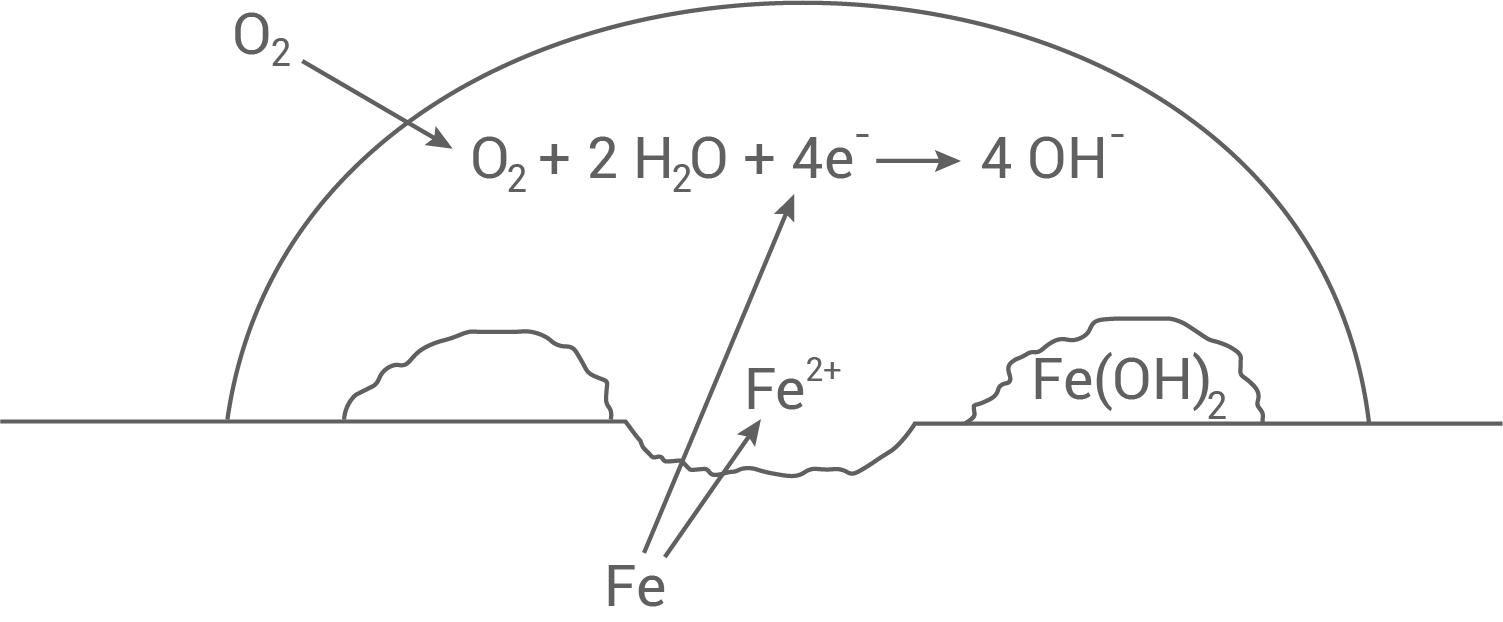
- Das Rosten beschreibt die Reaktion von Eisen mit Sauerstoff aus der Luft in Gegenwart von Feuchtigkeit (Wasser).
- Hierbei werden Eisen-Atome
zu Eisen-Kationen
oxidiert;
die Sauerstoff-Molekülewerden mit Wasser-Molekülen
zu Hydroxid-Ionen
reduziert.
- Korrosion beschreibt im allgemeinen Vorgängen, bei denen Gegenstände mit Stoffen der Umgebung reagieren, wobei sie sich teilweise oder vollständig auflösen.

Ergänzungen in Abbildung 2
- Bei der Korrosion gibt das Eisen Elektronen ab, welche die Ssauerstoff-Moleküle reduzieren.
- Diese reagieren mit Wasser zu Hydroxid-Ionen.
- Die Hydroxid-Ionen reagieren letztlich mit den Eisen
-Ionen zu Eisen
-hydroxid.
2.
Skizze: Aufbau zur Galvanisierung eines Eisenwerkstückes
 Reaktionen beim Verzinken von Eisen
Reaktionen beim Verzinken von Eisen
![\(\begin{array}[t]{rll}
m (Fe, \text {davor})&=& 80,000\,\text {kg}& \\[5pt]
m (Fe, \text {danach})&=& 80,654\,\text {kg}
\end{array}\)](https://mathjax.schullv.de/dd90197e00533cc6ea0ac389b8c82cda2e93d3ed6db6e71bf78cca2323e14850?color=5a5a5a) Damit ergibt sich:
Damit ergibt sich:
![\(\begin{array}[t]{rll}
m (Zn)&=& 80,654\,\text {kg} - 80,000\,\text {kg} & \\[5pt]
&=& 0,654\,\text {kg} & \\[5pt]
&=& 654 \,\text {g}
\end{array}\)](https://mathjax.schullv.de/73f7919a7eff32c1214fc6c06ec8cb4cabff84746588ea21fc377990da729473?color=5a5a5a) Es gilt:
Es gilt:
![\(\begin{array}[t]{rll}
n &=& \dfrac{m}{M} & \\[5pt]
&=& \dfrac{654 \,\text {g}}{65,4 654 \,\text {g}\cdot\text{mol}}& \\[5pt]
&=& 10 \,\text {mol}
\end{array}\)](https://mathjax.schullv.de/582e8d047fe6c1d2d3fb5ca8e3e202fae3161f8584bc63a0b250f27881b2b04c?color=5a5a5a) Für eine Dauer von vier Tage folgt:
Für eine Dauer von vier Tage folgt:
 Und folglich lässt sich die Stromstärke berechnen mit:
Und folglich lässt sich die Stromstärke berechnen mit:

- Beim Galvanisieren findet eine Elektrolyse statt
eine erzwungene Redox-Reaktion
- Als Elektrolyt dient eine Zink
-Lösung.
- Als Kathode wird der zu galvanisierende Stoff geschaltet und das elementare Zink fungiert als Anode.
3.
Berechnung der Spannung einer Konzentrationszelle
Die Konzentration der Probelösung aus der Halbzelle beträgt  ;
mit
;
mit  und
und  kann die Stoffmenge berechnet werden:
kann die Stoffmenge berechnet werden:
 Für die Spannung folgt:
Erläuterung zum Auftreten einer Spannung
Für die Spannung folgt:
Erläuterung zum Auftreten einer Spannung
- Jedes Metall, welches von einer Lösung umgeben ist, strebt es an Ionen zu bilden.
Je niedriger die Ionen-Konzentration in der umliegenden Lösung, desto stärker ist die Lösungstendenz. - Die Probelösung weist eine sehr geringe Zink
-Ionen-Konzentration auf, wodurch sich verhältnismäßig viele Zink
-Ionen bilden.
Durch zurückgebliebene Elektronen wird die Zinkelektrode negativ aufgeladen. Dieser Prozess findet in der Vergleichszelle aufgrund des chemischen Gleichgewichtes viel weniger statt. - In den beiden Halbzellen werden unterschiedliche Potenziale ausgebildet. Dabei wird die Halbzelle der Probelösung zum Minuspol, die Halbzelle der Vergleichslösung zum Pluspol.
- Werden die beiden Halbzellen verbunden, fließen die Elektronen von der Halbzelle mit der Probelösung zu Halbzelle mit der Vergleichslösung. Die Triebkraft des Elektronenflusses wird als Potenzialdifferenz bzw. als Spannung gemessen.
- Erhöht sich die Konzentration der Zink
-Ionen, dann nähern sich die beiden Konzentrationen der Konzentrationszelle an. Die Spannung wird dadurch kleiner.
- Der Richtwert ist überschritten, sobald die Spannung den Wert von
unterschreitet.
4.
Erläuterung der Beobachtungen von Experiment 3
- Die blauen Verfärbungen in a) zeigen, dass im Gegensatz zu b) Eisen
-Ionen in Lösung gegangen sind:
- Der gebildete weiß-gelbliche Niederschlag am Eisennagel zeigt an, dass sich
-Ionen gebildet haben:
- In a) und in b) sind purpurne Verfärbungen zu sehen, welche auf die Entstehung von Hydroxid-Ionen hinweisen:
- Im gebildeten Lokalelement „opfert“ sich das Zink für das edlere Eisen und gibt seine Elektronen über das Eisen ab.
- Dadurch zersetzt sich nur das Zinkstück und der Eisennagel verändert sich nicht.
- Es muss eine leitende Verbindung zwischen Eisen und Zink bestehen.
- Die beiden Metalle müssen sich in einem gemeinsamen Elektrolyten befinden.
- Sobald das Zink vollständig oxidiert ist, endet die Schutzwirkung.