HT 3 – Carmoisin – Synthese und Einsatz als Lebensmittelfarbstoff
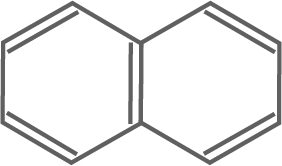
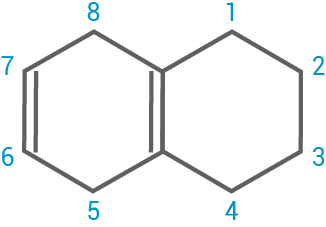
- Gib die Kennzeichen aromatischer Systeme an. Erläutere anhand der Molekülstrukturen das unterschiedliche Verhalten von Stoff A (Naphthalin) und Stoff B (1,2,3,4,5,8-Hexahydronaphthalin) gegenüber Brom. Erläutere den Ablauf der Reaktion von Stoff B und Brom in Einzelschritten.
(16 Punkte)
- Gib den Reaktionstyp für die der Sulfonierung von 1-Naphthol zugrundeliegenden Reaktion an. Erläutere den Ablauf dieser Reaktion in Einzelschritten. Begründe die Position, an der die Sulfonierung von 1-Naphthol erfolgt.
(12 Punkte)
- Entwickle unter Angabe des Reaktionstyps und der beteiligten Stoffe eine Reaktionsgleichung für die in Schritt
der Carmoisin-Synthese ablaufende Reaktion. Gib begründend die bei diesem Schritt einzuhaltenden Reaktionsbedingungen an. Entwickle unter Angabe des Reaktionstyps eine Reaktionsgleichung für die in Schritt
der Carmoisin-Synthese ablaufende Reaktion.
(18 Punkte) - Erkläre am Beispiel von Carmoisin unter Bezug auf Tabelle 1 und das angegebene Extinktionsmaximum den Zusammenhang zwischen Lichtabsorption und Farbigkeit. Begründe anhand der Molekülstruktur die Farbigkeit von Carmoisin. Erläutere am Beispiel der Konzentrationsbestimmung von Carmoisin in Limonade die Grundlagen und Durchführung des fotometrischen Messverfahrens.
(20 Punkte)
Fachspezifische Vorgaben:
Carmoisin (E 122) ist ein synthetischer, in Europa zugelassener Lebensmittelfarbstoff. Das feste Natriumsalz ist gut wasserlöslich und beständig gegen Licht und Hitze. Das Extinktionsmaximum von Carmoisin liegt bei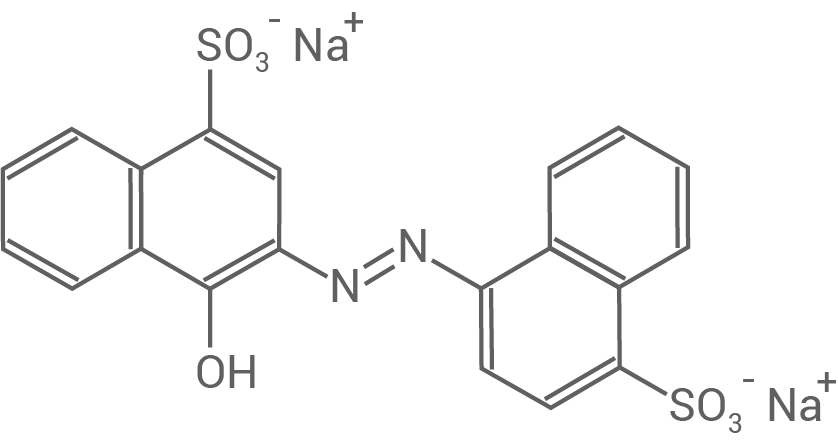
Carmoisin (Natriumsalz)
Konzentrationsbestimmung
Seit 2010 müssen Lebensmittel, die Lebensmittelfarbstoffe der Farbstoffklasse enthalten, zu der auch Carmoisin gehört, mit dem Warnhinweis „Kann Aktivität und Aufmerksamkeit bei Kindern beeinträchtigen“ versehen sein. Zur Überprüfung der Einhaltung der für die einzelnen Lebensmittel festgelegten Höchstmengen an Farbstoffen werden Konzentrationsbestimmungen durchgeführt. In Limonade, die als einzigen zugesetzten Farbstoff Carmoisin enthält, lässt sich die Konzentration des Farbstoffs gut fotometrisch ermitteln.
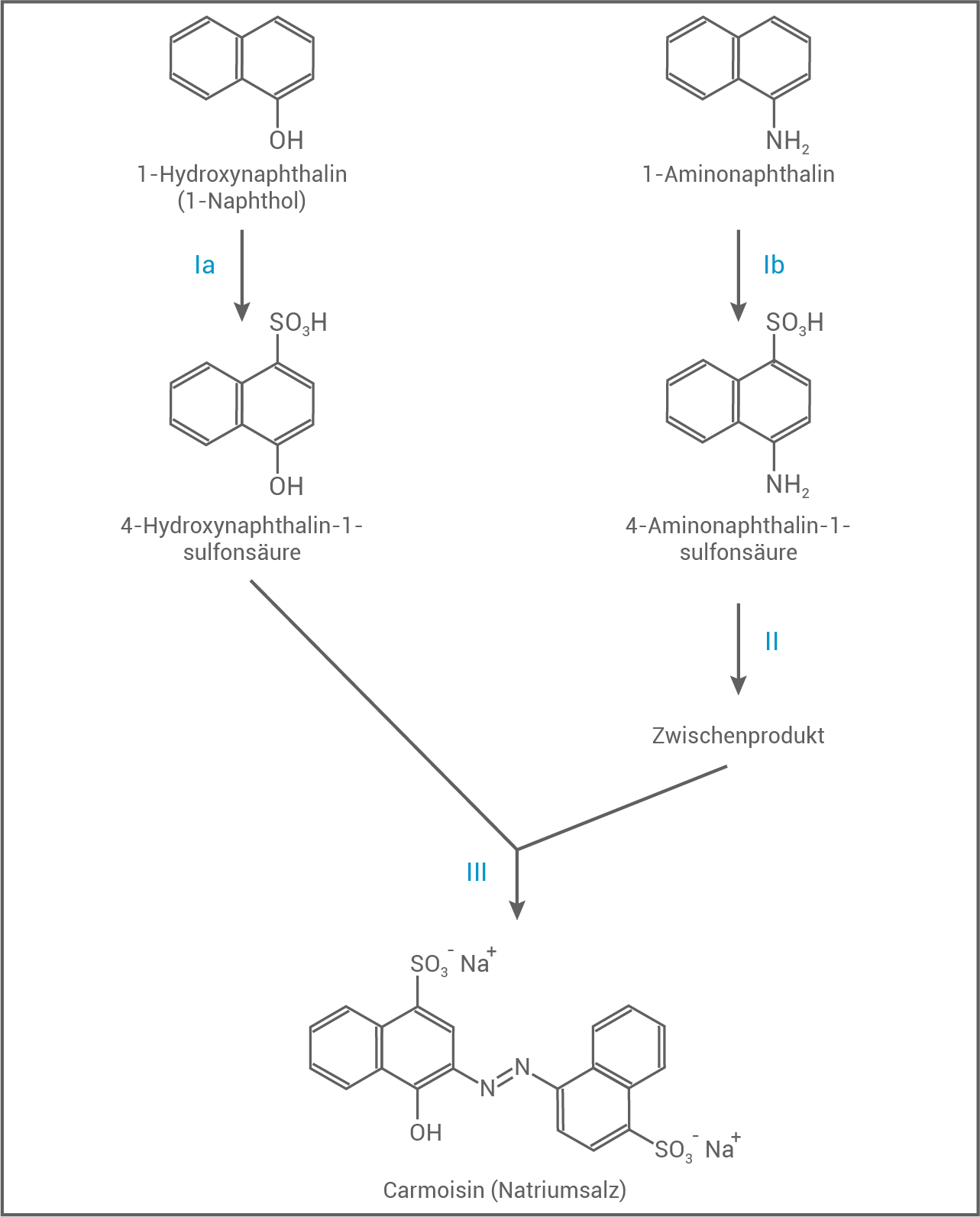

Abbildung 1: Synthese von Carmoisin aus Naphthalin-Derivaten
Zusatzinformationen:
Faraday-Konstante
 Als ein Derivat (von lateinisch derivare ‚ableiten‘) wird in der Chemie ein Stoff ähnlicher Struktur bezeichnet. Derivate sind z.B. Stoffe, die an Stelle eines Wasserstoff-Atoms ein anderes Atom oder eine ganze Atomgruppe besitzen bzw. bei denen ein oder mehrere Atome/Atomgruppen entfernt wurden.
Schwefeltrioxid-Moleküle sind planar gebaut und enthalten drei gleichlange Bindungen zwischen dem Schwefel-Atom und den Sauerstoff-Atomen.
Als ein Derivat (von lateinisch derivare ‚ableiten‘) wird in der Chemie ein Stoff ähnlicher Struktur bezeichnet. Derivate sind z.B. Stoffe, die an Stelle eines Wasserstoff-Atoms ein anderes Atom oder eine ganze Atomgruppe besitzen bzw. bei denen ein oder mehrere Atome/Atomgruppen entfernt wurden.
Schwefeltrioxid-Moleküle sind planar gebaut und enthalten drei gleichlange Bindungen zwischen dem Schwefel-Atom und den Sauerstoff-Atomen.
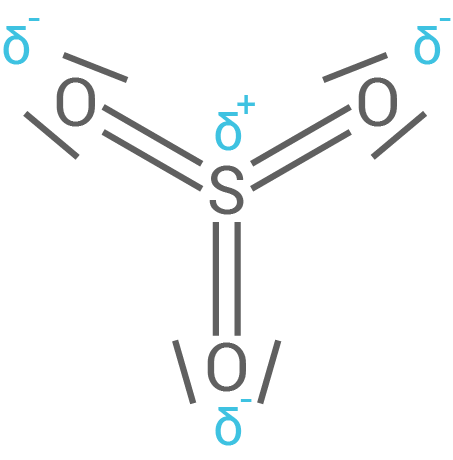 Tabelle 1: Zusammenhang von absorbierter Strahlung, zugehöriger Spektralfarbe und beobachteter Komplementärfarbe.
Tabelle 1: Zusammenhang von absorbierter Strahlung, zugehöriger Spektralfarbe und beobachteter Komplementärfarbe.

| Wellenlänge |
Spektralfarbe | Komplementär- farbe |
|---|---|---|
| ultraviolett | farblos | |
| violett | gelbgrün | |
| blau | gelb | |
| grünblau | orange | |
| blaugrün | rot | |
| grün | purpur | |
| gelbgrün | violett | |
| gelb | blau | |
| orange | grünblau | |
| rot | blaugrün |
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Kennzeichen aromatischer Systeme
- Planare, zyklische Struktur: Aromatische Moleküle bestehen aus planaren Ringen, wobei alle Atome in einer Ebene liegen.
- Konjugierte Doppelbindungen: Die Doppelbindungen im Ring sind konjugiert, das heißt, sie sind abwechselnd einfach und doppelt gebunden, was zu einer Delokalisierung von
-Elektronen führt.
- Hückel-Regel: Ein Molekül ist aromatisch, wenn die Hückel-Regel erfüllt ist, d.h. wenn der Ring eine planare, konjugierte Verbindung mit
-Elektronen (
ist eine ganze Zahl).
- Mesomerie: Diese wird mit sogenannten mesomeren Grenzstrukturen dargestellt.
Naphthalin:
 reagiert Naphthalin über eine elektrophile Substitution zu Brom-Naphthalin und Bromwasserstoff.
reagiert Naphthalin über eine elektrophile Substitution zu Brom-Naphthalin und Bromwasserstoff.
Dabei wird Aluminiumbromid/Eisen -bromid als Katalysator eingesetzt.
1,2,3,4,5,8-Hexahydronaphthalin:
-bromid als Katalysator eingesetzt.
1,2,3,4,5,8-Hexahydronaphthalin:
Erläuterung der Reaktion von Stoff B und Brom

- aromatisch
- mesomeriestabilisiert
- planares, konjugiertes System mit 10
-Elektronen
wobei
- höhere Stabilität und weniger reaktiv
Dabei wird Aluminiumbromid/Eisen

- nicht aromatisch
- nicht planare cyclohexane Ringstruktur; erfüllt nicht die Hückel-Regel; keine konjugierten Doppelbindungen
- weniger stabil
- Polarisierung: Die Doppelbindung wird durch Annäherung eines Brom-Moleküls polarisiert, wobei die
-Elektronen mit der Elektronenhülle des Broms wechselwirken.
- Ein Bromatom wird mit einer positiven Partialladung zum Elektrophil und bildet eine schwache Bindung mit dem Alken – es wird ein sogenanntes Tradukt gebildet.
- Geschwindigkeitsbestimmender Schritt: Die
-Bindung und das Brom-Molekül werden anschließend heterolytisch gespalten.
- Es entsteht ein Kation mit einem Bromatom, welches mehrere Formen annehmen kann:
Befindet sich die positive Ladung am Kohlenstoffatom ist von einem Carbokation die Rede.
Befindet sich die positive Ladung am Bromatom ist es ein Brommmonium-Ion.
Das Kation kann durch mesomere Grenzstrukturen ausgedrückt werden. - Dieses Interdukt (Zwischenstufe) ist kurzlebig wird von der Rückseite durch Bromidionen nucleophil angegriffen (sehr schnell).
- Es wird eine Dibromverbindung, also eine zweite
-Bindung gebildet.
- Es handelt sich um eine elektrophile Addition, da im ersten Schritt das polarisierte Brom-Molekül als Elektrophil angreift.
- Bei der Annäherung eines Brom-Moleküls an eine
-Doppelbindung kommt es zur Polarisierung des Brom-Moleküls. Dies geschieht, weil die
-Elektronen der Doppelbindung mit der Elektronenhülle des Broms interagieren.
- Das Brom-Atom, das näher an der Doppelbindung ist, erhält eine positive Partialladung und wirkt als Elektrophil. Durch die Polarisierung bildet sich eine schwache Bindung zwischen dem Alken und dem Brom-Molekül.
- Anschließend werden die
-Bindung und die polarisierte
-Bindung heterolytisch gespalten. Dieser Vorgang verläuft langsam und ist daher der geschwindigkeitsbestimmende Schritt der Reaktion.
- Bei der Spaltung entsteht ein Kation, das ein Brom-Atom enthält, sowie ein Bromid-Ion. Das entstandene Brom-Kation kann aufgrund seines freien Elektronenpaars die positive Ladung entweder am Kohlenstoff-Atom oder am Brom-Atom tragen. Befindet sich die positive Ladung am Brom-Atom, spricht man von einem Bromonium-Ion. Liegt die Ladung jedoch an einem der beiden Kohlenstoff-Atome, entsteht ein Carbokation.
- Das Kation kann mehrere mesomere Grenzstrukturen einnehmen, was die Stabilität des Zwischenprodukts erhöht.
- Im letzten Schritt wird das Kation von einem Bromid-Ion nucleophil angegriffen, was zur Bildung einer Dibromverbindung führt.
- Dieser Mechanismus wird als elektrophile Addition bezeichnet, da das polarisierte Brom-Molekül im geschwindigkeitsbestimmenden Schritt als Elektrophil agiert.
2.
Sulfonierung von 1-Naphthol
Die Sulfonierung von 1-Naphthol folgt einer elektrophilen aromatischen Substitution.
Schwefeltrioxid bzw. das in Schwefelsäure gebildete Kation
bzw. das in Schwefelsäure gebildete Kation  ist dabei das Elektrophil.
ist dabei das Elektrophil.
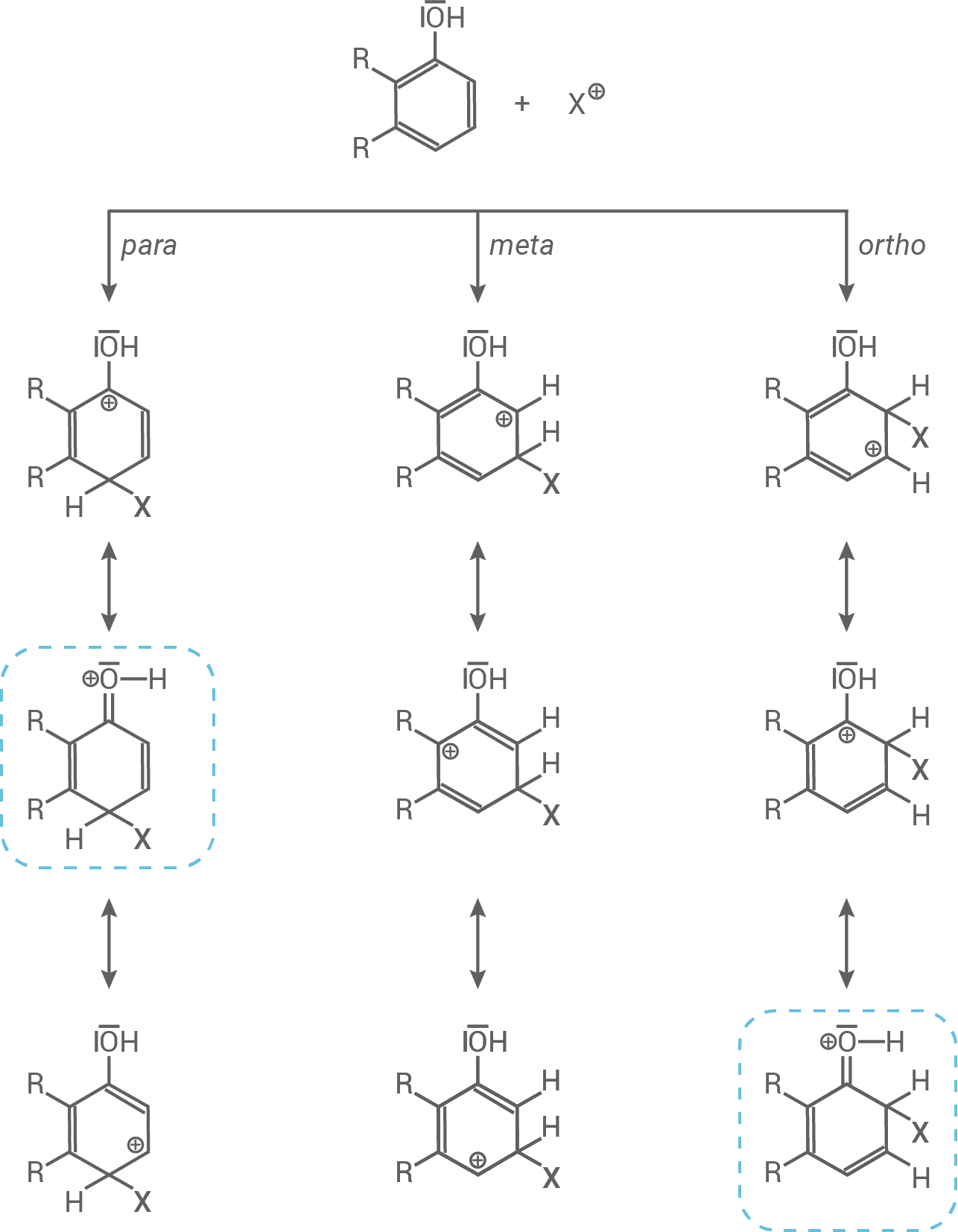
Der erste Schritt der elektrophilen Substitution bestimmt die Position, an der das Elektrophil angreift – dies kann in ortho,- meta oder para-Position erfolgen:
Schwefeltrioxid
- Das Schwefeltrioxid wechselwirkt als Elektrophil mit den delokalisierten Elektronen des Naphthalinrings
-Komplex
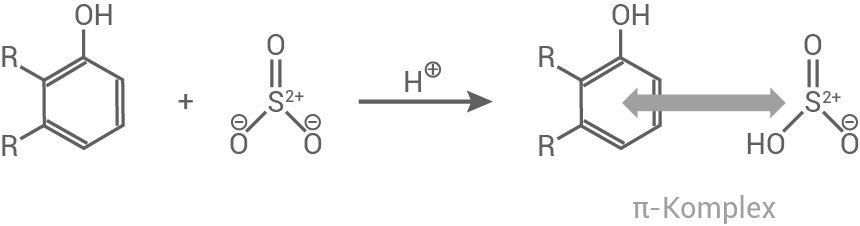
- Es entsteht eine Bindung zwischen dem Ring-
-Atom und dem Schwefelatom und es wird ein Carbokation gebildet
-Komplex
Die Delokalisierung der Elektronen wird dabei teilweise aufgehoben. Das Carbokation stellt einen nicht-aromatischen Übergangszustand dar. Die Sulfongruppe und ein
-Atom werden an den Ring gebunden, wobei die positive Ladung gleichmäßig verteilt wird und das Carbokation stabilisiert.
- Rearomatisierung:
Zuletzt wird ein Proton abgegeben und das aromatische System wiederhergestellt.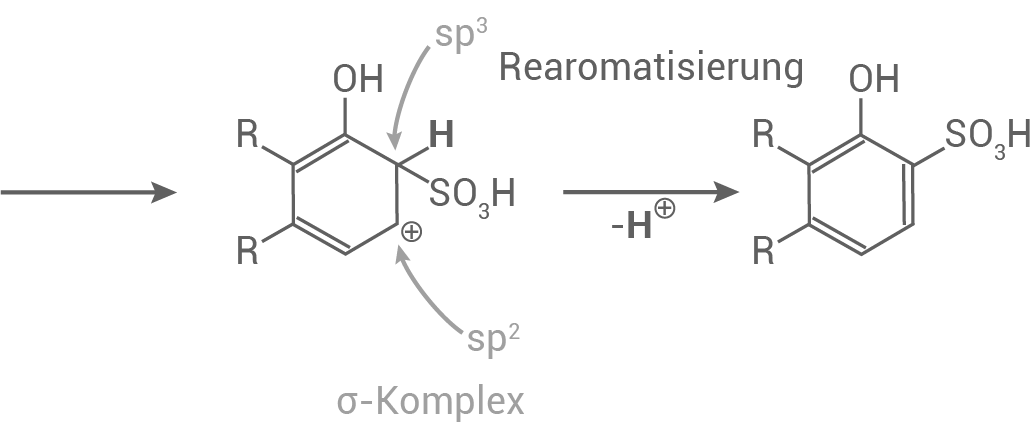
Der erste Schritt der elektrophilen Substitution bestimmt die Position, an der das Elektrophil angreift – dies kann in ortho,- meta oder para-Position erfolgen:

- In ortho- und para-Position existieren zwei Grenzformeln mit positiver Ladung am Sauerstoffatom (der Hydroxygruppe). Diese Positionen sind besonders günstig, da die positive Ladung mesomeriestabilisiert ist.
Der +M-Effekt bewirkt, dass die Hydroxygruppe nach ortho und para dirigiert.
- In der ortho-Position ist die sterische Hinderung jedoch zu beachten, da ein
-Komplex entsteht und Hydroxygruppe und Elektrophil sich durch die räumlich Nähe gegenseitig abstoßen.
Die para-Position ist folglich noch günstiger als ortho.
- Die elektrophile Substitution erfolgt in para-Position.
3.
Reaktion in Schritt  der Carmoisin-Synthese
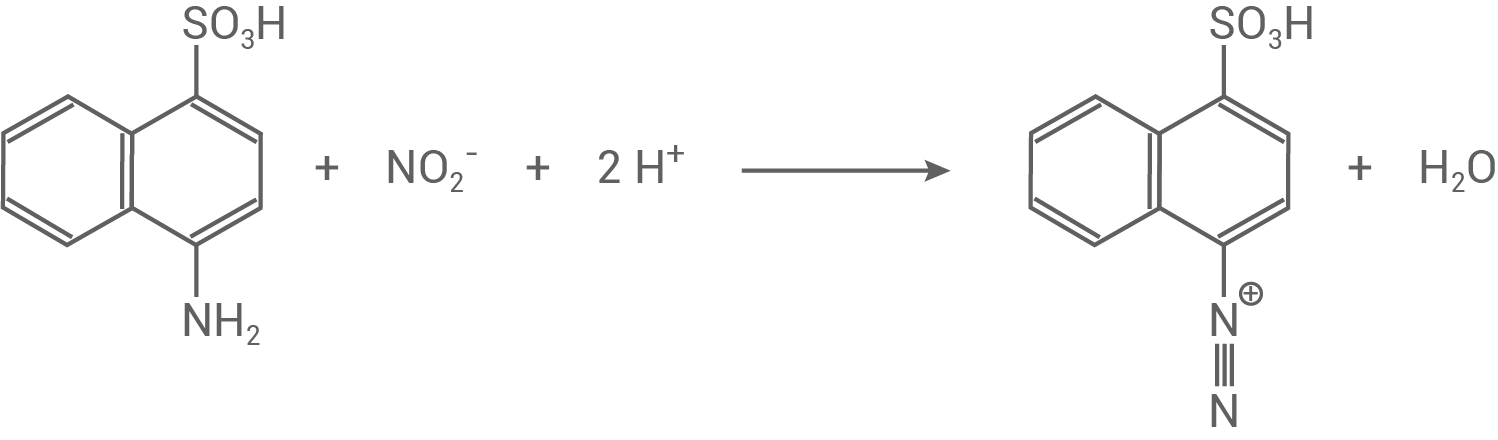
Die Carmoisin-Synthese erfolgt über eine Azokupplung bzw. durch die Diazotierung von 4-Aminonaphthalin-1-sulfonsäure:
der Carmoisin-Synthese
Die Carmoisin-Synthese erfolgt über eine Azokupplung bzw. durch die Diazotierung von 4-Aminonaphthalin-1-sulfonsäure:

 der Carmoisin-Synthese
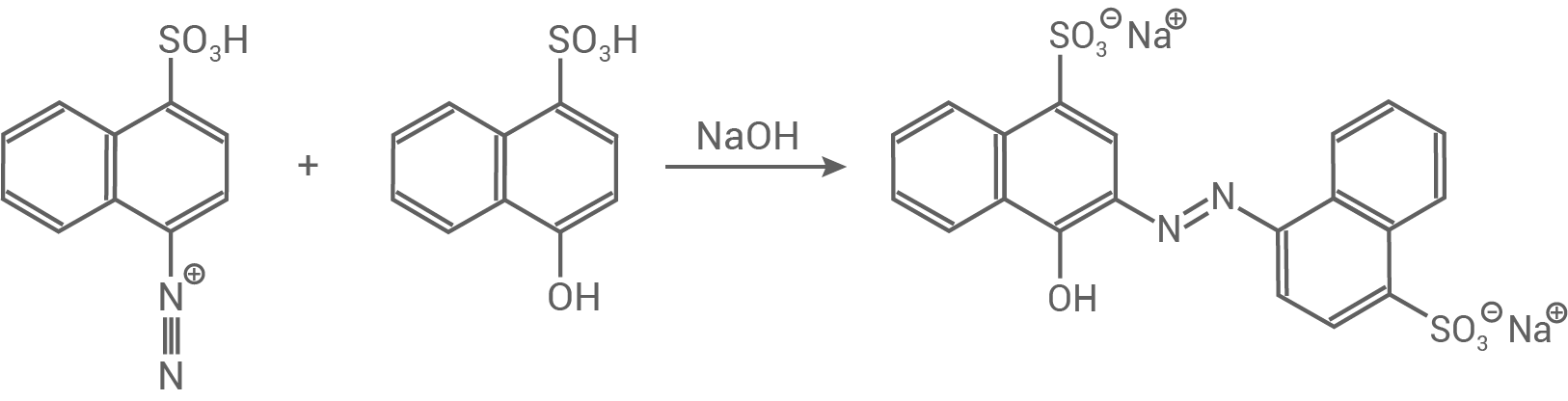
Hier erfolgt eine Azokupplung von der diazotierten 4-Aminonaphthalin-1-sulfonsäure mit 4-Hydroxynaphthalin-1-sulfonsäure.
Es ist eine elektrophile aromatische Substitution.
der Carmoisin-Synthese
Hier erfolgt eine Azokupplung von der diazotierten 4-Aminonaphthalin-1-sulfonsäure mit 4-Hydroxynaphthalin-1-sulfonsäure.
Es ist eine elektrophile aromatische Substitution.

- Zuerst wird 4-Aminonaphthalin-1-sulfonsäure in das Diazonium-Ion umgewandelt.
- Dabei reagieren Natriumnitrit
und Salzsäure
zum Nitrosyl-Ion
welches darauffolgend mit der Aminogruppe zu einer Nitrosamingruppe
reagiert.
- Unter Abspaltung von Wasser entsteht die Diazoniumgruppe, die eine positive Ladung trägt.
- Saures Milieu für die Bildung des Nitrosyl-Ions (üblicherweise Schwefelsäure)
- Kälte: Die Reaktion erfolgt bei niedrigen Temperaturen, damit unerwünschte Nebenreaktionen minimiert werden und die Selektivität der Diazotierung erhöht wird.
- Natriumnitrit
Natriumnitrit ist das Diazotierungsmittel, das mit der Aminogruppe der 4-Aminonaphthalin-1-sulfonsäure reagiert.

4.
Zusammenhang zwischen Lichtabsorption und Farbigkeit
Der Zusammenhang zwischen Lichtabsorption und Farbigkeit basiert auf den Wechselwirkungen zwischen Licht und den Farbmolekülen eines Stoffes. Farbigkeit tritt auf, wenn eine Substanz selektiv bestimmte Wellenlängen des sichtbaren Lichts absorbiert und andere reflektiert oder durchlässt.
Hier ist die Rede von der Elektronenanregungsenergie, die der Energiedifferenz  des angeregten Zustands und des Grundzustands entspricht (EINSTEIN-BOHR'sche Frequenzbedingung):
des angeregten Zustands und des Grundzustands entspricht (EINSTEIN-BOHR'sche Frequenzbedingung):
 Tabelle 1 zeigt, welche Spektralfarbe einer bestimmten absorbierten Wellenlänge (bzw. einem Bereich) zuzuordnen ist und welche Komplementärfarbe sichtbar erscheint.
Tabelle 1 zeigt, welche Spektralfarbe einer bestimmten absorbierten Wellenlänge (bzw. einem Bereich) zuzuordnen ist und welche Komplementärfarbe sichtbar erscheint.
Das als Azorubin bekannte Carmoisin besitzt ein Absorptionsmaximum von Nach der Tabelle zeigt diese Wellenlänge eine grüne Spektralfarbe und ist als Purpur sichtbar.
Begründung der Farbigkeit
Vor allem Moleküle mit konjugierten Doppelbindungen absorbieren Licht im sichtbaren Bereich, da die
Nach der Tabelle zeigt diese Wellenlänge eine grüne Spektralfarbe und ist als Purpur sichtbar.
Begründung der Farbigkeit
Vor allem Moleküle mit konjugierten Doppelbindungen absorbieren Licht im sichtbaren Bereich, da die  -Elektronen leicht in angeregte Zustände überführt werden können.
-Elektronen leicht in angeregte Zustände überführt werden können.
Dazu lässt sich die Mesomerie betrachten, da größere Systeme konjugierter Doppelbindungen stärkere Delokalisierung der Elektronen bedeutet, wodurch die Anregungsenergie sinkt. In Carmoisin besitzt der Chromophor konjugierte Doppelbindungen und damit ein System von -Elektronen. Zudem übt die Hydroxygruppe als Donatorgruppe einen +M-Effekt aus, wodurch die Delokalisierung steigt. Folglich verschiebt sich das Absorptionsmaximum in den Wellenbereich von sichtbarem Licht.
Grundlagen des fotometrischen Messverfahrens
Die Konzentrationsbestimmung von Carmoisin in Limonade mittels fotometrischem Messverfahren basiert auf der Absorption von Licht durch den Farbstoff. Fotometrie ist eine Technik zur quantitativen Analyse von Substanzen durch Messung der Lichtabsorption.
Grundlage ist zum einen das Lambert-Beer'sches Gesetz:
-Elektronen. Zudem übt die Hydroxygruppe als Donatorgruppe einen +M-Effekt aus, wodurch die Delokalisierung steigt. Folglich verschiebt sich das Absorptionsmaximum in den Wellenbereich von sichtbarem Licht.
Grundlagen des fotometrischen Messverfahrens
Die Konzentrationsbestimmung von Carmoisin in Limonade mittels fotometrischem Messverfahren basiert auf der Absorption von Licht durch den Farbstoff. Fotometrie ist eine Technik zur quantitativen Analyse von Substanzen durch Messung der Lichtabsorption.
Grundlage ist zum einen das Lambert-Beer'sches Gesetz:
 bekannt ist. Folglich lässt sich die Stoffmengenkonzentration des Farbstoffs berechnen.
Durchführung
bekannt ist. Folglich lässt sich die Stoffmengenkonzentration des Farbstoffs berechnen.
Durchführung
 berechnet werden, indem eine Probe unter gleichen Bedingungen gemessen wird. Die Konzentration lässt sich dann auch hier an der Kalibrierkurve ablesen oder über den molaren Extinktionskoeffizienten ermitteln.
berechnet werden, indem eine Probe unter gleichen Bedingungen gemessen wird. Die Konzentration lässt sich dann auch hier an der Kalibrierkurve ablesen oder über den molaren Extinktionskoeffizienten ermitteln.
Das als Azorubin bekannte Carmoisin besitzt ein Absorptionsmaximum von
Dazu lässt sich die Mesomerie betrachten, da größere Systeme konjugierter Doppelbindungen stärkere Delokalisierung der Elektronen bedeutet, wodurch die Anregungsenergie sinkt. In Carmoisin besitzt der Chromophor konjugierte Doppelbindungen und damit ein System von
| Extinktion | |
| Lichtintensität nach durchstrahlter Probe | |
| eingestrahlte Lichintensität | |
| Extinktionskoeffizient | |
| Konzentration der absorbierenden Substanz | |
| durchstrahlte Schichtdicke |
- Farbige Lösungen absorbieren Teile des elektromagnetischen Spektrums im sichtbaren Bereich, der zwischen
und
liegt.
- Die Extinktion
verhält sich dabei proportional zur Konzentration
des gelösten Farbstoffs, solange die Schichtdicke
konstant bleibt.
- Das bedeutet, wenn Licht durch die Probe geht, nimmt die Intensität linear ab.
- Kalibrierung: Fotometrische Messung von Lösungen mit bekannter Konzentration; Erstellung einer Kalibrierkurve als Referenz.
- Messung: Die konzentrierte Lösung des extrahierten Farbstoffs wird in das Fotometer eingebracht, und die Absorption des Lichts bei der Wellenlänge des Extinktionsmaximums von Carmoisin wird gemessen.
- Berechnung der Konzentration: Mit der Kalibrierkurve wird die Absorption der Limonadenprobe in die entsprechende Konzentration von Carmoisin umgerechnet.