HT 2 – Redox-Flow-Batterien mit dem Element Eisen
- Skizziere den beschrifteten Aufbau des galvanischen Elements aus dem Versuch zur Ermittlung des Standardpotentials des Redoxpaares
(M 1). Ordne begründet der Kupfer- und der Platin-Elektrode die Begriffe Anode und Kathode zu. Vergleiche das aus dem Messergebnis zu berechnende Standardpotential
mit dem angegebenen Wert (Tabelle 1).
(20 Punkte) - Beschreibe den Aufbau der
(M 2). Nenne je einen Vor- und Nachteil des Aufbaus der
gegenüber dem klassischen Aufbau eines galvanischen Elements. Erläutere die elektrochemischen Prozesse an den Eisen-Elektroden beim Ladevorgang der
unter Angabe einer Gesamtgleichung sowie den Prozess des Ladungsausgleichs zwischen den Halbzellen.
(22 Punkte) - Berechne die theoretisch zu erwartende Masse an abgeschiedenem Eisen beim beschriebenen Ladevorgang (M 2). Begründe den deutlichen Unterschied zwischen der beim Ladevorgang eingesetzten Ladung und der beim ersten Entladevorgang entnommenen Ladung unter Verwendung von Teilgleichungen. Interpretiere die Messwerte der Ladungen beim zweiten und dritten Entladevorgang auch vor dem Hintergrund, dass die Bildung von Wasserstoffgas bei den Ladevorgängen vermieden werden soll.
(18 Punkte)
Fachspezifische Vorgaben:
Redox-Flow-Zellen mit dem Element Eisen Redox-Flow-Batterien gelten als innovative Energiespeicherlösungen für überschüssigen Strom aus regenerativen Quellen wie Photovoltaik und Windkraft. Derzeitig gängige Speichersysteme wie Blei- oder Lithiumionenakkumulatoren sind wenig umweltfreundlich oder sehr teuer. Daher versucht man, umweltfreundlichere und günstigere Speicher- systeme zu entwickeln, wie die Eisen-Eisen-Redox-Flow-Batterie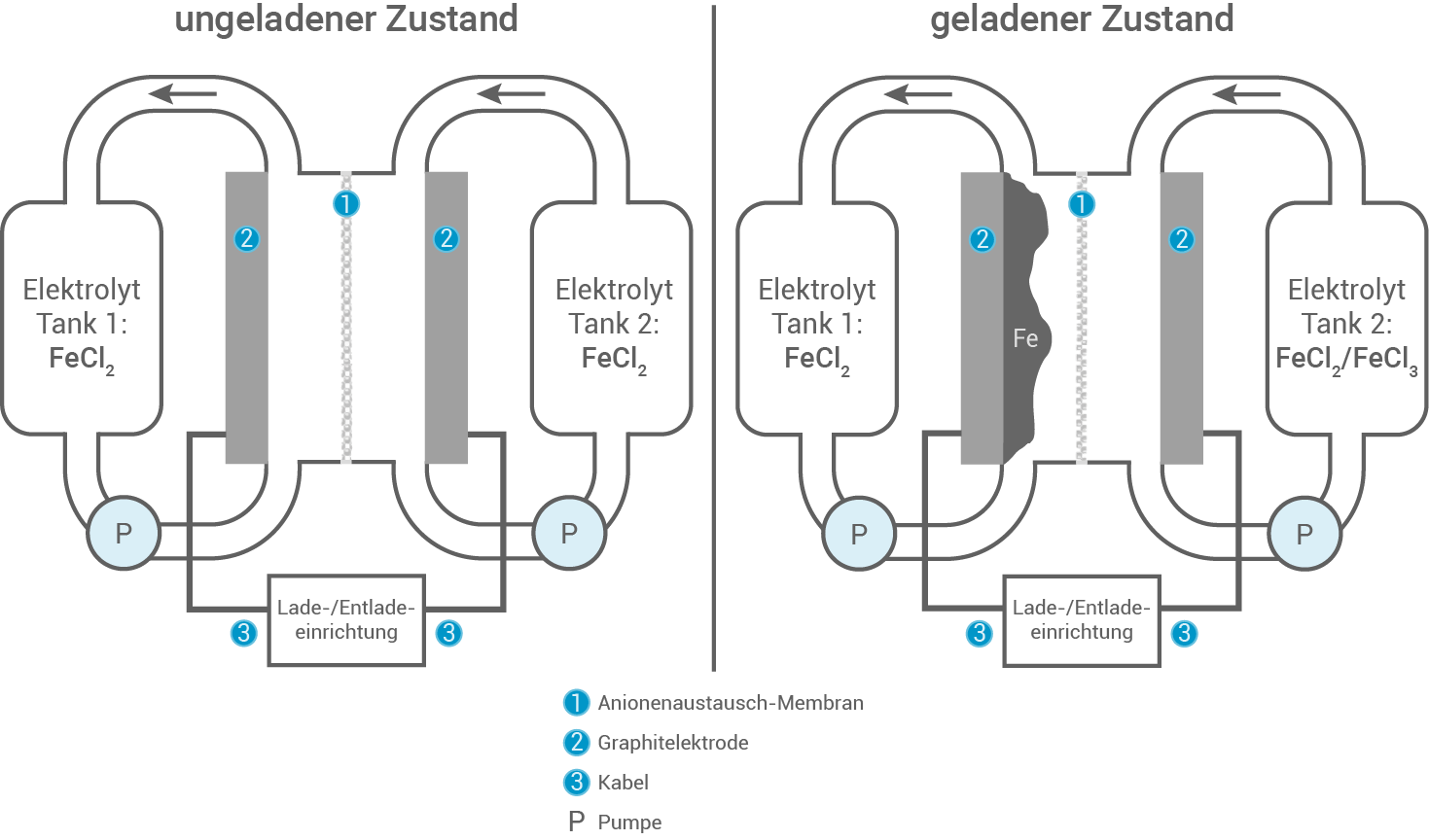
Abbildung 1: schematischer Aufbau einer ungeladenen (links) und geladenen 


 (rechts)
(rechts)
Zusatzinformationen:
Faraday-GesetzWeiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Aufbau des galvanischen Elements
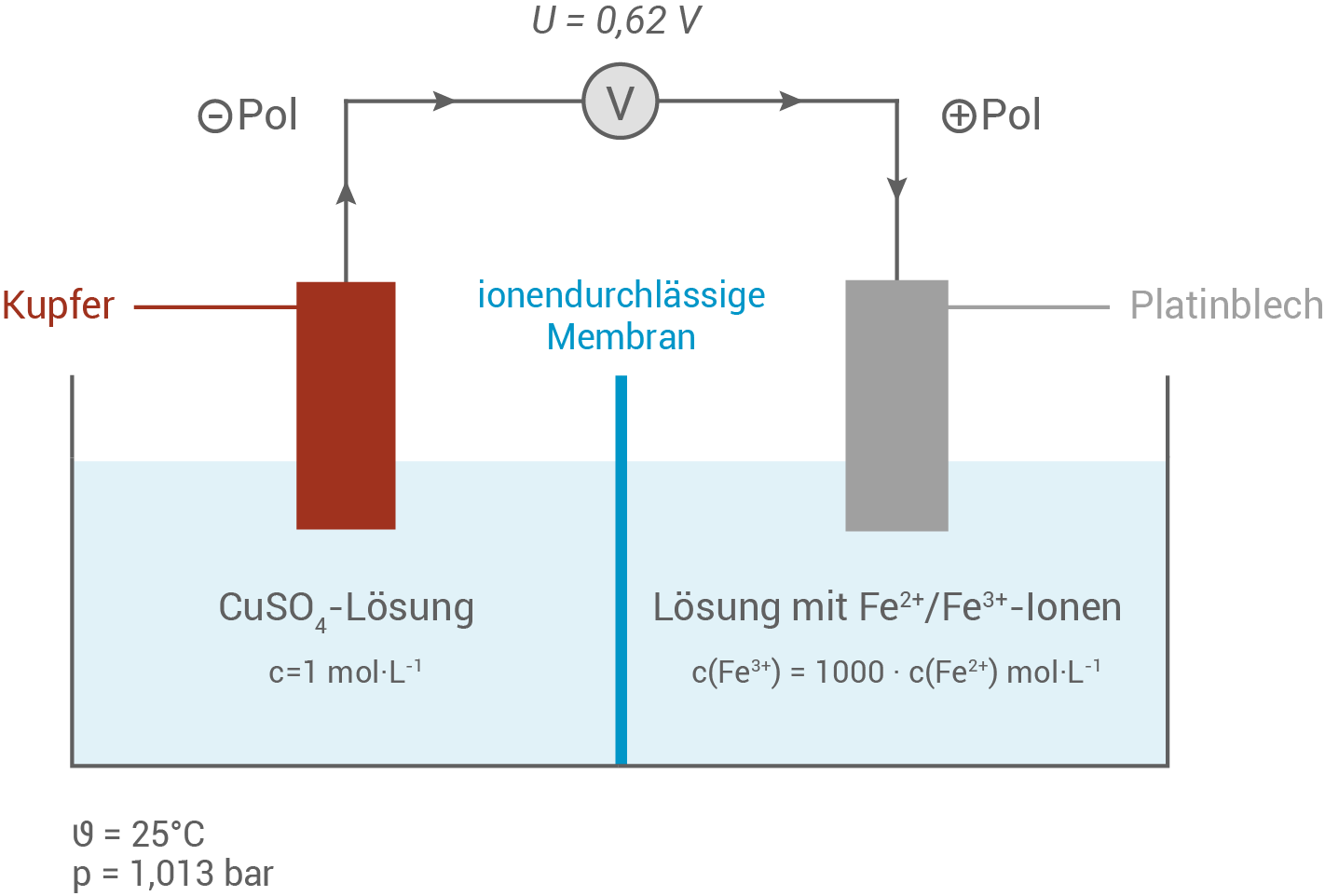 Der Aufbau des galvanischen Elements umfasst zwei Halbzellen, die durch eine ionendurchlässige Membran voneinander getrennt sind. Die erste Halbzelle enthält eine Kupfer-Elektrode, die in eine Kupfer
Der Aufbau des galvanischen Elements umfasst zwei Halbzellen, die durch eine ionendurchlässige Membran voneinander getrennt sind. Die erste Halbzelle enthält eine Kupfer-Elektrode, die in eine Kupfer -sulfat-Lösung mit einer Konzentration von
-sulfat-Lösung mit einer Konzentration von  getaucht ist. Die Kupfer-Halbzelle ist die Referenzelektrode.
Die zweite Halbzelle enthält eine Platinelektrode, die in eine Lösung aus Eisen
getaucht ist. Die Kupfer-Halbzelle ist die Referenzelektrode.
Die zweite Halbzelle enthält eine Platinelektrode, die in eine Lösung aus Eisen - und Eisen
- und Eisen -Ionen getaucht ist. Das Konzentrationsverhältnis ist so eingestellt, dass
-Ionen getaucht ist. Das Konzentrationsverhältnis ist so eingestellt, dass  gilt.
Zuweisung von Anode und Kathode
Die Kupfer-Elektrode (Minuspol) fungiert als Anode, da dort die Oxidation von Kupfer zu Kupfer
gilt.
Zuweisung von Anode und Kathode
Die Kupfer-Elektrode (Minuspol) fungiert als Anode, da dort die Oxidation von Kupfer zu Kupfer -Ionen stattfindet.
Die Platin-Elektrode dient als Kathode, da hier die Reduktion der Eisen
-Ionen stattfindet.
Die Platin-Elektrode dient als Kathode, da hier die Reduktion der Eisen -Ionen zu Eisen
-Ionen zu Eisen -Ionen stattfindet.
Vergleich des Standardpotentials
Die gemessene Zellspannung
-Ionen stattfindet.
Vergleich des Standardpotentials
Die gemessene Zellspannung  stellt die Potentialdifferenz zwischen der Kathode (Eisen-Halbzelle) und der Anode (Kupfer-Halbzelle) dar. Da das Standardpotential der Kupfer-Halbzelle bekannt ist, kann mithilfe der Zellspannung das Standardpotential der Eisen-Halbzelle berechnet werden:
stellt die Potentialdifferenz zwischen der Kathode (Eisen-Halbzelle) und der Anode (Kupfer-Halbzelle) dar. Da das Standardpotential der Kupfer-Halbzelle bekannt ist, kann mithilfe der Zellspannung das Standardpotential der Eisen-Halbzelle berechnet werden:
![\(\begin{array}[t]{rll}
U &=& E^0(\text{Kathode}) - E^0(\text{Anode}) & \\[5pt]
&=& E^0(Fe^{2+}/Fe^{3+}) - E^0(Cu/Cu^{2+}) &
\end{array}\)](https://mathjax.schullv.de/4e0db7e9591cf52cf83d6f1a8aae916363d48a2f7db39c148a030ef01091f827?color=5a5a5a) Durch Umstellen ergibt sich:
Durch Umstellen ergibt sich:
![\(\begin{array}[t]{rll}
E^0(Fe^{2+}/Fe^{3+}) &=& U + E^0(Cu/Cu^{2+}) & \\[5pt]
&=& 0,62\,\text{V} + 0,35\,\text{V} & \\[5pt]
&=& 0,97\,\text{V}
\end{array}\)](https://mathjax.schullv.de/bdf7898aab46f50935b560e1510aff69fb845c218d445bda7b1e4a97e57b77ee?color=5a5a5a) Der aus dem Messergebnis berechnete Wert beträgt
Der aus dem Messergebnis berechnete Wert beträgt  Der theoretische Wert für das Standardpotential des Redoxpaares
Der theoretische Wert für das Standardpotential des Redoxpaares  liegt laut der Tabelle bei
liegt laut der Tabelle bei  Die Abweichung zwischen dem experimentellen und dem theoretischen Standardpotential lässt sich durch mehrere Faktoren erklären. Ein wesentlicher Grund sind die Konzentrationsunterschiede in der Eisen-Halbzelle: Im Experiment ist die Konzentration der Eisen
Die Abweichung zwischen dem experimentellen und dem theoretischen Standardpotential lässt sich durch mehrere Faktoren erklären. Ein wesentlicher Grund sind die Konzentrationsunterschiede in der Eisen-Halbzelle: Im Experiment ist die Konzentration der Eisen -Ionen 1000-mal höher als die der Eisen
-Ionen 1000-mal höher als die der Eisen -Ionen. Dieses Ungleichgewicht führt gemäß der Nernst-Gleichung zu einer Verschiebung des Potentials zu höheren Werten. Zusätzlich ist zu beachten, dass der theoretische Standardpotential-Wert unter Standardbedingungen gilt, also bei Konzentrationen von
-Ionen. Dieses Ungleichgewicht führt gemäß der Nernst-Gleichung zu einer Verschiebung des Potentials zu höheren Werten. Zusätzlich ist zu beachten, dass der theoretische Standardpotential-Wert unter Standardbedingungen gilt, also bei Konzentrationen von  für beide Ionen. Da in unserem Experiment abweichende Konzentrationen vorliegen, ergibt sich zwangsläufig ein anderes Messergebnis. Darüber hinaus könnten auch Messungenauigkeiten oder leichte Schwankungen in der Lösungskonzentration zu der beobachteten Abweichung beitragen, da kleine Variationen im Messaufbau das Zellpotential beeinflussen können.
für beide Ionen. Da in unserem Experiment abweichende Konzentrationen vorliegen, ergibt sich zwangsläufig ein anderes Messergebnis. Darüber hinaus könnten auch Messungenauigkeiten oder leichte Schwankungen in der Lösungskonzentration zu der beobachteten Abweichung beitragen, da kleine Variationen im Messaufbau das Zellpotential beeinflussen können.

2.
Aufbau der Eisen-Eisen-Redox-Flow-Batterie
Die Eisen-Eisen-Redox-Flow-Batterie besteht aus zwei getrennten Elektrolyttanks, die jeweils eine Eisen - bzw. Eisen
- bzw. Eisen -chloridlösung enthalten. Diese Elektrolyte werden kontinuierlich durch zwei Halbzellen gepumpt, die durch eine ionendurchlässige Membran voneinander getrennt sind. Eine gasdichte Versiegelung der Tanks ist notwendig, um eine Oxidation durch Luftsauerstoff zu verhindern.
Vor- und Nachteil des Aufbaus
-chloridlösung enthalten. Diese Elektrolyte werden kontinuierlich durch zwei Halbzellen gepumpt, die durch eine ionendurchlässige Membran voneinander getrennt sind. Eine gasdichte Versiegelung der Tanks ist notwendig, um eine Oxidation durch Luftsauerstoff zu verhindern.
Vor- und Nachteil des Aufbaus
Prozesse an den Elektroden beim Ladevorgang
Beim Ladevorgang wird Eisen an der positiven Elektrode zu Eisen
an der positiven Elektrode zu Eisen oxidiert, während an der negativen Elektrode Eisen
oxidiert, während an der negativen Elektrode Eisen zu Eisen
zu Eisen reduziert wird.
Die Reaktionsgleichungen an den Elektroden lauten:
Prozess des Ladungsausgleichs
Zwischen den beiden Halbzellen erfolgt ein Ladungsausgleich über die Membran, die den Ionenfluss ermöglicht und somit die elektrische Neutralität in beiden Halbzellen aufrechterhält. Dadurch wird verhindert, dass sich eine Ladungsdifferenz aufbaut, die den Betrieb der Batterie stören könnte.
reduziert wird.
Die Reaktionsgleichungen an den Elektroden lauten:
Prozess des Ladungsausgleichs
Zwischen den beiden Halbzellen erfolgt ein Ladungsausgleich über die Membran, die den Ionenfluss ermöglicht und somit die elektrische Neutralität in beiden Halbzellen aufrechterhält. Dadurch wird verhindert, dass sich eine Ladungsdifferenz aufbaut, die den Betrieb der Batterie stören könnte.
| Vorteil | Nachteil |
|---|---|
| Der Aufbau ermöglicht eine flexible Anpassung der Speicherkapazität, indem das Volumen der Elektrolyt-Tanks variiert wird. | Der komplexe Aufbau und die Notwendigkeit einer gasdichten Versiegelung erschweren die Konstruktion und erfordern eine höhere technische Wartung im Vergleich zu klassischen galvanischen Zellen. |
3.
Berechnung der theoretisch zu erwartenden Masse an abgeschiedenem Eisen
Die theoretisch abgeschiedene Masse an Eisen lässt sich mit dem Faraday-Gesetz berechnen.
Es gilt:


 Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
\dfrac{m}{M} &=& \dfrac{Q}{z \cdot F} &\\[5pt]
m &=& \dfrac{Q \cdot M }{z \cdot F} &\\[5pt]
\end{array}\)](https://mathjax.schullv.de/db24acb1bc07bdc565c50ec0787543bbf4a667ea00d73dc98dd858728205d1fc?color=5a5a5a) Da es sich hier um das Redoxpaar
Da es sich hier um das Redoxpaar  handelt, beträgt
handelt, beträgt  Bei dieser Reaktion wird jeweils ein Elektron übertragen.
Bei dieser Reaktion wird jeweils ein Elektron übertragen.
![\(\begin{array}[t]{rll}
m &=& \dfrac{3600\,\text{C} \cdot 55,85\,\text{g} \cdot \text{mol}^{-1} }{1 \cdot 96\,485 \,\text{C}\cdot \text{mol}^{-1} } &\\[5pt]
&\approx & 2,085\,\text{g}
\end{array}\)](https://mathjax.schullv.de/5eae8aa3adcb5a2134bc57fa2078911850b90010c04b9f8cc2b57263fa7e243f?color=5a5a5a) Für
Für  lassen sich etwa
lassen sich etwa  abgeschiedenes Eisen erwarten.
Unterschied zwischen eingesetzter und entnommener Ladung
Der deutliche Unterschied zwischen der eingesetzten Ladung beim Ladevorgang und der entnommenen Ladung beim ersten Entladevorgang ist auf Nebenreaktionen zurückzuführen, die während des Ladevorgangs ablaufen. Eine bedeutende Nebenreaktion ist die Bildung von Wasserstoffgas an der Elektrode. Diese Nebenreaktion verbraucht Elektronen, die eigentlich für die Redoxreaktion des Eisen-Redoxpaares genutzt werden sollten.
Teilgleichung zur Wasserstoffbildung:
abgeschiedenes Eisen erwarten.
Unterschied zwischen eingesetzter und entnommener Ladung
Der deutliche Unterschied zwischen der eingesetzten Ladung beim Ladevorgang und der entnommenen Ladung beim ersten Entladevorgang ist auf Nebenreaktionen zurückzuführen, die während des Ladevorgangs ablaufen. Eine bedeutende Nebenreaktion ist die Bildung von Wasserstoffgas an der Elektrode. Diese Nebenreaktion verbraucht Elektronen, die eigentlich für die Redoxreaktion des Eisen-Redoxpaares genutzt werden sollten.
Teilgleichung zur Wasserstoffbildung:


 Wenn sich an der Elektrode Protonen
Wenn sich an der Elektrode Protonen  in Wasserstoffgas
in Wasserstoffgas  umwandeln, fließen Elektronen, die nicht für die Reduktion von
umwandeln, fließen Elektronen, die nicht für die Reduktion von  zu
zu  zur Verfügung stehen. Diese Wasserstoffbildung tritt typischerweise auf, wenn das Potential der Elektrode während des Ladevorgangs ausreichend negativ wird, sodass Protonen reduziert werden können.
Die Wasserstoffbildung führt somit dazu, dass die im Ladevorgang eingesetzte elektrische Ladung nicht vollständig in die Speicherung chemischer Energie in Form von Eisen-Ionen umgesetzt wird. Stattdessen wird ein Teil der Ladung in Form von Wasserstoffgas „verschwendet“. Beim Entladen kann diese Energie nicht zurückgewonnen werden, sodass weniger elektrische Ladung abgegeben wird als ursprünglich gespeichert. Dadurch entsteht der beobachtete Unterschied zwischen der eingesetzten und der entnommenen Ladung.
Interpretation der Messwerte beim zweiten und dritten Entladevorgang
Die abnehmenden Ladungen beim zweiten und dritten Entladevorgang deuten darauf hin, dass die Kapazität der Batterie durch die Nebenreaktion beeinträchtigt wird. Die Wasserstoffbildung verringert die Menge an verfügbarem Eisen, das zur Stromerzeugung beiträgt, und führt langfristig zu einer Abnahme der Batteriekapazität. Dies zeigt, dass unerwünschtes Wasserstoffgas tatsächlich während des Ladevorgangs gebildet wird, was die Effizienz der Batterie senkt und ihre Kapazität im Laufe der Zeit verringert.
zur Verfügung stehen. Diese Wasserstoffbildung tritt typischerweise auf, wenn das Potential der Elektrode während des Ladevorgangs ausreichend negativ wird, sodass Protonen reduziert werden können.
Die Wasserstoffbildung führt somit dazu, dass die im Ladevorgang eingesetzte elektrische Ladung nicht vollständig in die Speicherung chemischer Energie in Form von Eisen-Ionen umgesetzt wird. Stattdessen wird ein Teil der Ladung in Form von Wasserstoffgas „verschwendet“. Beim Entladen kann diese Energie nicht zurückgewonnen werden, sodass weniger elektrische Ladung abgegeben wird als ursprünglich gespeichert. Dadurch entsteht der beobachtete Unterschied zwischen der eingesetzten und der entnommenen Ladung.
Interpretation der Messwerte beim zweiten und dritten Entladevorgang
Die abnehmenden Ladungen beim zweiten und dritten Entladevorgang deuten darauf hin, dass die Kapazität der Batterie durch die Nebenreaktion beeinträchtigt wird. Die Wasserstoffbildung verringert die Menge an verfügbarem Eisen, das zur Stromerzeugung beiträgt, und führt langfristig zu einer Abnahme der Batteriekapazität. Dies zeigt, dass unerwünschtes Wasserstoffgas tatsächlich während des Ladevorgangs gebildet wird, was die Effizienz der Batterie senkt und ihre Kapazität im Laufe der Zeit verringert.