HT 1 – Das GROVE-Element
1.
Beschreibe den Aufbau des GROVE-Elements unter Zuordnung der Pole. Gib die im Betrieb ablaufenden Prozesse auf Teilchenebene an. Berechne die theoretische Spannung eines GROVE-Elements unter Annahme von Standardbedingungen sowie die im Versuch geflossene Ladungsmenge 
(22 Punkte)
2.
Erläutere das Donator-Akzeptor-Prinzip am Beispiel des GROVE-Elements. Gib hierzu die im GROVE-Element ablaufende Redoxreaktion bei Betrieb auch anhand der Teilreaktionen an. Begründe die Zersetzung eines Kupferbleches in Salpetersäure.
(16 Punkte)
3.
Prüfe das vorgeschlagene Modellexperiment hinsichtlich seiner Funktionalität als galvanisches Element. Stelle die elektrochemischen Prozesse sowie die Ionenbewegungen beim Stromfluss im Modellexperiment in einer einfachen Skizze dar (vgl. Abbildung 2). Beurteile die moderne Abwandlung des GROVE-Elements anhand der eingesetzten Stoffe und Materialien auch hinsichtlich Umwelteigenschaften und Störanfälligkeit.
Fachspezifische Vorgaben:
(22 Punkte)
1839 hatte WILLIAM GROVE ein galvanisches Element entwickelt, in dem ein Zinkblech in verdünnte Schwefelsäure  und ein Platinblech als Kathode in Salpetersäure
und ein Platinblech als Kathode in Salpetersäure  eintaucht. Kupferbleche als Kathode sind nicht einsetzbar, da diese zersetzt werden. Die Lösungen wurden durch einen porösen, ionendurchlässigen Tonzylinder getrennt (Abbildung 1). Das Element lieferte für die damalige Zeit hohe Stromstärken. In der Salpetersäure-Halbzelle entstand gasförmiges Stickstoffdioxid
eintaucht. Kupferbleche als Kathode sind nicht einsetzbar, da diese zersetzt werden. Die Lösungen wurden durch einen porösen, ionendurchlässigen Tonzylinder getrennt (Abbildung 1). Das Element lieferte für die damalige Zeit hohe Stromstärken. In der Salpetersäure-Halbzelle entstand gasförmiges Stickstoffdioxid  als Produkt. Die Reaktion in der Halbzelle verläuft gemäß:
als Produkt. Die Reaktion in der Halbzelle verläuft gemäß:

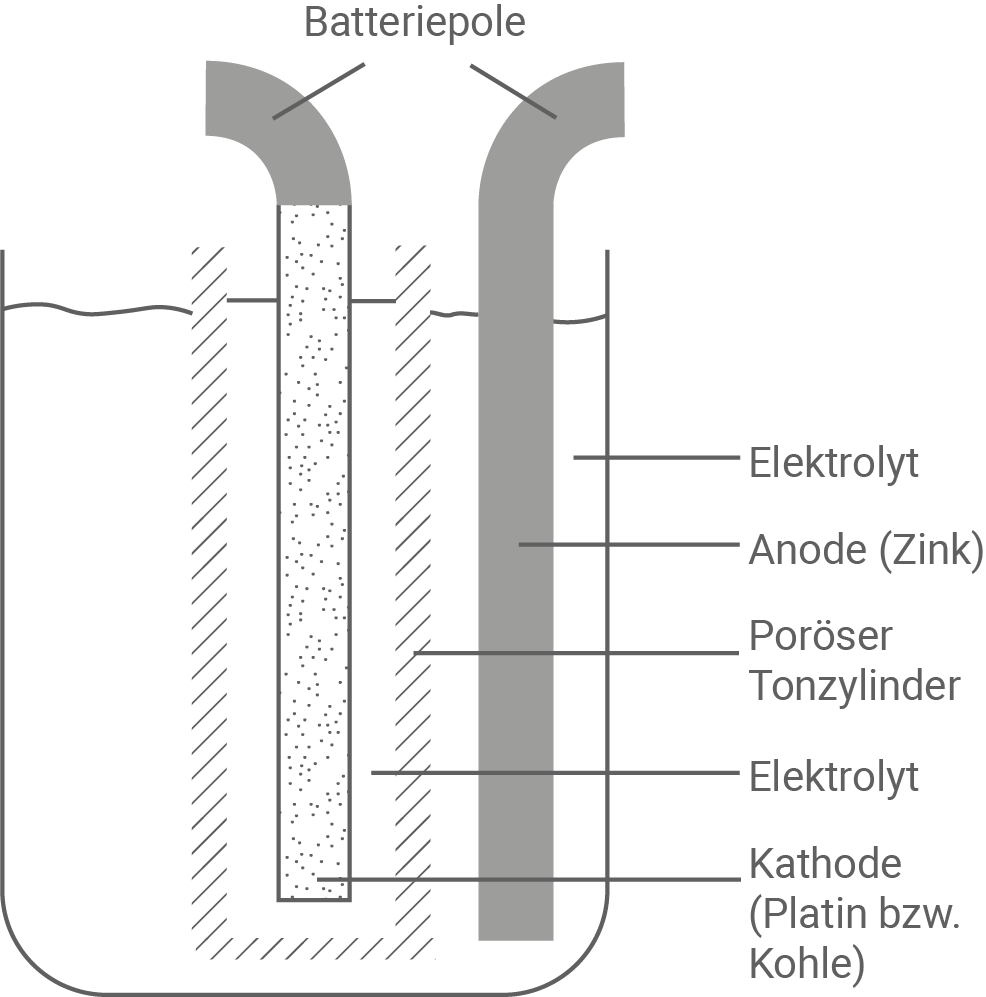
Abbildung 1: Historischer Aufbau der galvanischen Elemente von GROVE und BUNSEN
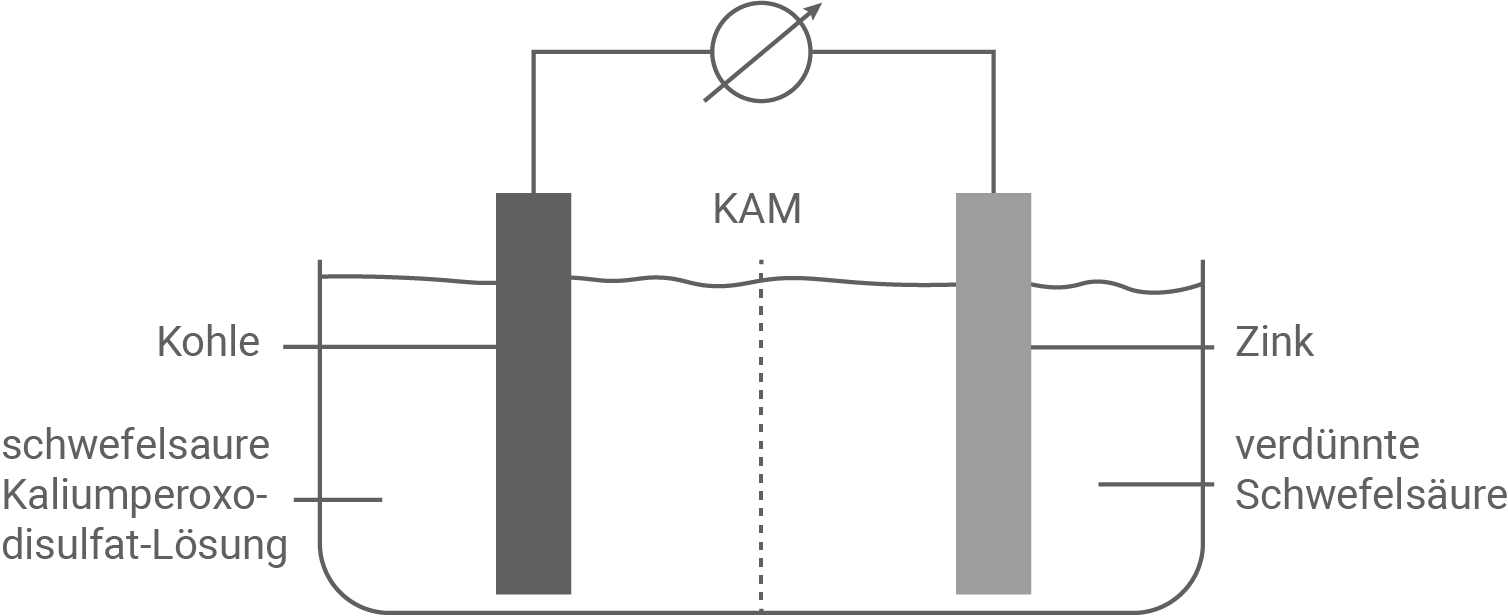
Abbildung 2: Skizze des Modellexperiments
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Beschreibung des Aufbaus vom GROVE-Element und Zuordnung der Pole
 Wie viel Zink umgesetzt wurde, ergibt sich aus der Differenz der Massen vor und nach dem Versuch:
Wie viel Zink umgesetzt wurde, ergibt sich aus der Differenz der Massen vor und nach dem Versuch:
![\(\begin{array}[t]{rll}
m(Zn) &=& 45,00 \,\text{g} - 26,04 \,\text{g} & \\[5pt]
&=& 18,96 \,\text{g} & \\[10pt]
n (Zn )&=& \dfrac{m(Zn)}{M(Zn)} & \\[5pt]
&=& \dfrac{18,96 \,\text{g}}{65,38 \,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx & 0,29 \,\text{mol} & \\[10pt]
Q &=& n(Zn) \cdot z \cdot F & \\[5pt]
&=& 0,29 \,\text{mol} \cdot 2 \cdot 96485\,\dfrac{\text{A} \cdot \text{s}}{\text{mol}} & \\[5pt]
&\approx& 55960 \,\text{A} \cdot \text{s}
\end{array}\)](https://mathjax.schullv.de/54ebc44db12810c4e46ba27c1e543c70b988e9a7763a79b0fed9fe5ad550d3e3?color=5a5a5a)
- Das GROVE-Element ist aufgebaut wie ein klassisches galvanisches Element: 2 Halbzellen, die durch einen porösen Tonzylinder getrennt sind.
- Eine Zinkelektrode bildet die Zink-Halbzelle, wobei diese in Schwefelsäure (Elektrolyt) eintaucht. Die Zinkelektrode stellt den Minuspol der Batterie dar.
- Eine Platinelektrode, getaucht in Salpetersäure (Elektrolyt), bildet die zweite Halbzelle. Diese stellt den Pluspol der Batterie dar.
- Die Zink-Atome werden zu Zink-Ionen oxidiert und lösen sich im Elektrolyten:
- Über den äußeren Draht wandern die Elektronen von der Zinkelektrode zur Platinelektrode.
- An der Platinelektrode werden die Nitrat- und Oxonium-Ionen aus dem Elektrolyten reduziert:
- Die Ionen wandern durch die Tonmembran, um den Ladungsunterschied auszugleichen.
2.
Erläuterung des Donator-Akzeptor-Prinzips am Beispiel vom GROVE-Element
- Wird in einer chemischen Reaktion, das Teilchen von einem Reaktionspartner (Donator) auf einen anderen Reaktionspartner (Akzeptor) übertragen, dann herrscht das Donator-Akzeptor-Prinzip.
- Beim GROVE-Element werden beispielsweise Elektronen bei der ablaufenden Redoxreaktion übertragen.
- Betrachtet man die Elektronen, stellt die Elektronenabgabe die Oxidation und die Elektronenaufnahme die Reduktion dar.
- Das Redoxpaar Stickstoffdioxid/Nitrat-Ionen
weist in saurer Lösung ein höheres Standardpotential als Kupfer auf.
- Die Salpetersäure greift daher das Kupferblech unter Oxidation des Kupfers an.
- Bei dieser Reaktion entstehen Kupfer-Ionen und Stickstoffdioxid.
3.
Prüfung der Funktionalität als galvanisches Element
 eingesetzte Stoffe und Materialien, Umwelteigenschaften, Störanfälligkeit
eingesetzte Stoffe und Materialien, Umwelteigenschaften, Störanfälligkeit
- Durch das Redoxpotential der Zinkhalbzelle fungiert diese als Donatorhalbzelle.
- Die Peroxidisulfat-Ionen liegen in der Akzeptorhalbzelle in saurer Lösung vor und wirken als ein sehr gutes Oxidationsmittel. Kommt es an der Kohleelektrode zur Reduktion, entstehen Sulfat-Ionen.
- Zwischen den beiden Halbzellen kommt es zu einem Ladungsaustausch, der durch eine kationendurchlässige Membran gewährleistet wird.
- Der Versuchsaufbau zeigt ein funktionsfähiges galvanisches Element.
- Es kommt zur Oxidation der Zink-Atome zu Zink-Ionen, die sich im Elektrolyten lösen.
- Über den äußeren Draht wandern die Elektronen von der Zinkelektrode zur Kohleelektrode.
- An der Kohleelektrode werden die Peroxodisulfat-Ionen aus dem Elektrolyten zu Sulfat-Ionen reduziert.
- Durch Diffusion der positiv geladenen Zink-Ionen durch die Membran, wird die Ladung ausgeglichen.
- Alle beschriebenen Elementen zeigen den gleichen Aufbau der Zink-Halbzelle.
- Die teure Platinelektrode im BUNSEN-Element wird im GROVE-Element durch eine günstige Kohleelektrode ersetzt. Die Salpetersäure, die als Oxidationsmittel fungiert, wird durch eine Kaliumdichromat-Lösung ersetzt. Hierbei handelt es sich zwar auch um einen Stoff mit hohem Gefahrenpotential, jedoch wird die Bildung von giftigem, gasförmigen Stickstoffdioxid vermieden.
- Das Modellexperiment zeigt als Oxidationsmittel den Einsatz einer Kaliumperoxodisulfat-Lösung. Der Vorteil hierbei ist ein weit geringeres Gefahrenpotential für die Umwelt im Vergleich zu den Elektrolyten im Kathodenraum der historischen Elemente.
- Bei den anderen Elementen ist es möglich, dass oxidierend wirkende Ionen in den Elektrolyten der Anodenräume wandern. Dies wird im Modellexperiment durch eine kationenselektive Membran verhindert, wodurch die Störanfälligkeit geringer ist.