HT 2 – Korrosionsprobleme im Bootssport
- Erkläre am Beispiel des Rostens von Eisen den Begriff Korrosion. Gib die Reaktionsgleichungen für die beim Rosten von Eisen ablaufenden Reaktionen an. Erläutere die Vorgänge der Sauerstoffkorrosion von Eisen bis zur Entstehung von Eisen
-hydroxid, auch indem du die Abbildung 2 (Anhang) durch Formeln und Teilgleichungen ergänzst.
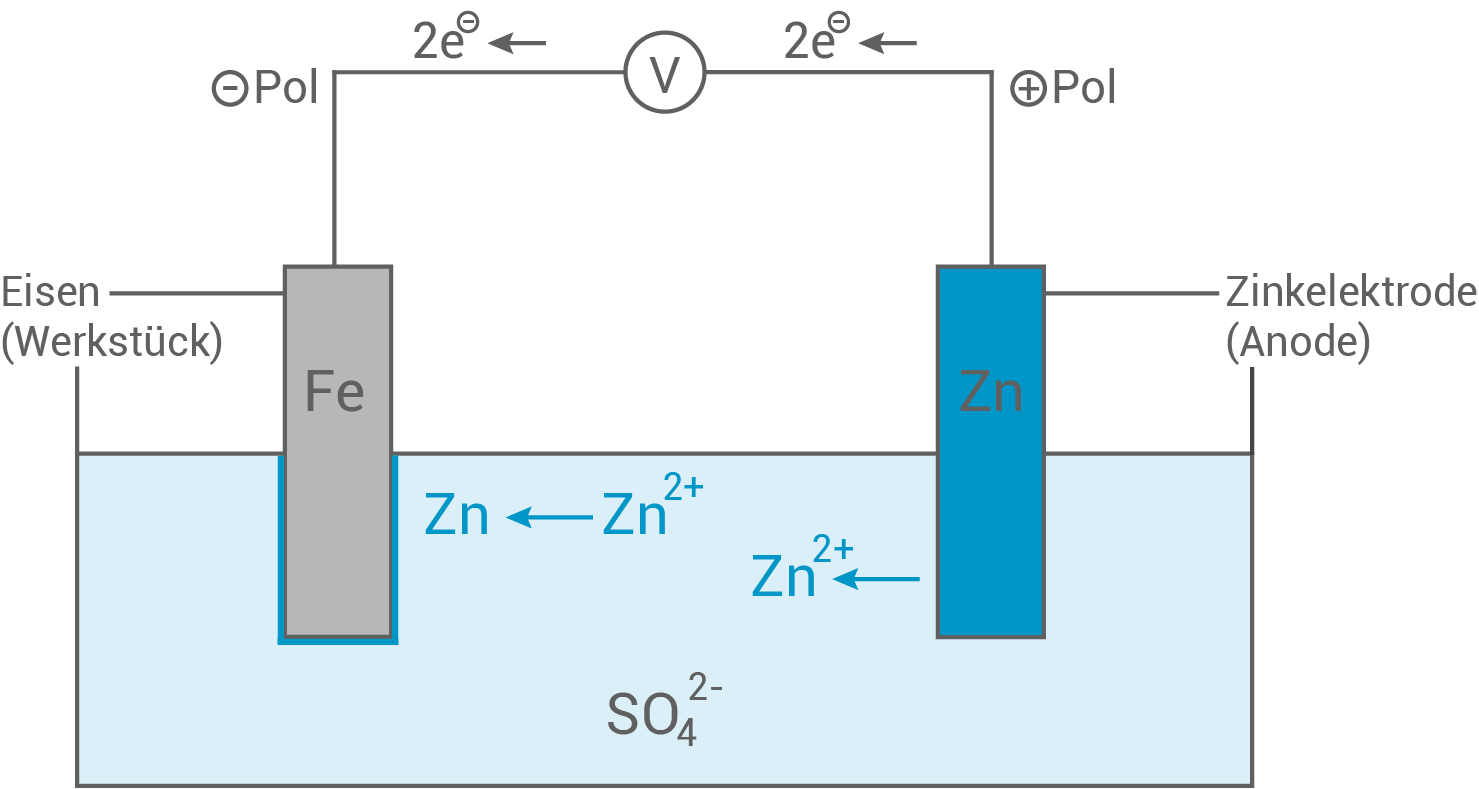
(20 Punkte) - Skizziere einen möglichen experimentellen Aufbau zur Galvanisierung eines Eisenwerkstückes. Erläutere anhand von Teilgleichungen für die beim Verzinken von Eisen ablaufenden Reaktionen den Prozess des Galvanisierens. Berechne die Stromstärke, bei der die Verzinkung der Ankerkette in Experiment 1 durchgeführt wurde.
(22 Punkte)
- Erläutere die Beobachtungen bei Experiment 3 auch mithilfe von Teilgleichungen. Erläutere vor dem Hintergrund der Beobachtungen den Begriff „Opferanode“ und diskutiere die Rahmenbedingungen, die zum Schutz des Eisens mit dieser Methode gewährleistet sein müssen.
(18 Punkte)
Einsatz von Opferanoden
An vielen Schiffsrümpfen kann man große Blöcke aus Magnesium oder Zink wahrnehmen (Foto). Diese Blöcke werden auch als „Opferanoden" bezeichnet. Die Anzahl der Opferanoden variiert mit der Größe der zu schützenden Teile. Die Funktionsweise einer solchen Anordnung wird in einem Laborexperiment untersucht.

Abbildung 1: Schiffsrumpf und Ruderblatt mit Opferanoden aus Zink (oben links am Ruderblatt und vor dem Propeller)
Quelle: https://www.oxly.de/foto/displayimage.php?pid=4976 (Zugriff 14.01.2022)
Quelle: https://www.oxly.de/foto/displayimage.php?pid=4976 (Zugriff 14.01.2022)
a)
In einer Petrischale wird ein gereinigter Eisennagel in eine wässrige Natriumchloridlösung gelegt, die mit wenig Phenolphthalein und Kaliumhexacyanoferrat versetzt wurde.
Beobachtungen: Um den Nagel sind nach einiger Zeit sowohl blaue als auch purpurfarbene Verfärbungen zu sehen.
versetzt wurde.
Beobachtungen: Um den Nagel sind nach einiger Zeit sowohl blaue als auch purpurfarbene Verfärbungen zu sehen.
b)
In eine zweite Petrischale werden ein an der Oberfläche gereinigtes Zinkstück und darauf ein ebenfalls gereinigter Eisennagel gelegt, sodass sich beide Metalle berühren. Danach wird eine wässrige Natriumchloridlösung, die mit wenig Phenolphthalein und Kaliumhexacyanoferrat versetzt wurde, vorsichtig in die Petrischale gegossen.
Beobachtungen: Am Eisennagel verfärbt sich die Lösung purpur. Am Zinkstück bildet sich ein gelblich-weißer Niederschlag.
versetzt wurde, vorsichtig in die Petrischale gegossen.
Beobachtungen: Am Eisennagel verfärbt sich die Lösung purpur. Am Zinkstück bildet sich ein gelblich-weißer Niederschlag.
Zusatzinformationen:
Kaliumhexacyanoferrat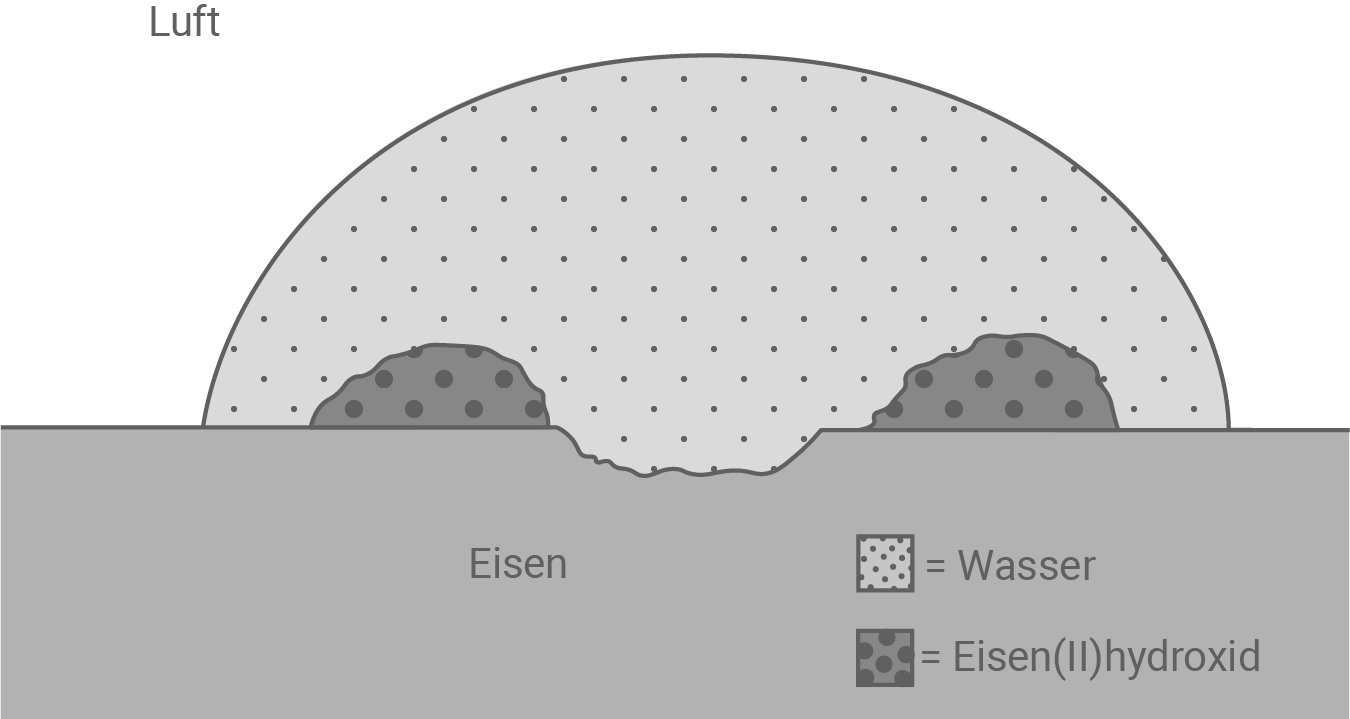
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Erklärung Korrosion am Beispiel des Rostens
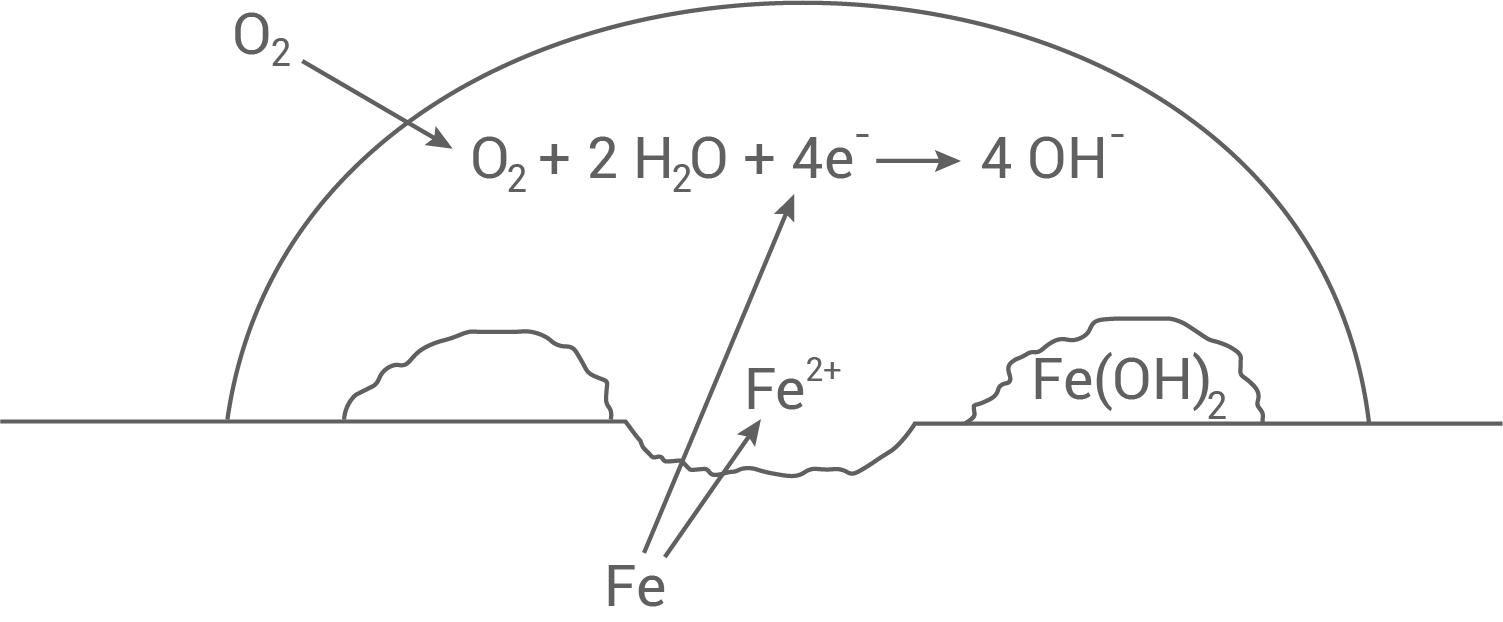
- Das Rosten beschreibt die Reaktion von Eisen mit Sauerstoff aus der Luft in Gegenwart von Feuchtigkeit (Wasser).
- Hierbei werden Eisen-Atome
zu Eisen-Kationen
oxidiert;
die Sauerstoff-Molekülewerden mit Wasser-Molekülen
zu Hydroxid-Ionen
reduziert.
- Korrosion beschreibt im allgemeinen Vorgängen, bei denen Gegenstände mit Stoffen der Umgebung reagieren, wobei sie sich teilweise oder vollständig auflösen.

Ergänzungen in Abbildung 2
- Bei der Korrosion gibt das Eisen Elektronen ab, welche die Ssauerstoff-Moleküle reduzieren.
- Diese reagieren mit Wasser zu Hydroxid-Ionen.
- Die Hydroxid-Ionen reagieren letztlich mit den Eisen
-Ionen zu Eisen
-hydroxid.
2.
Skizze: Aufbau zur Galvanisierung eines Eisenwerkstückes
 Reaktionen beim Verzinken von Eisen
Reaktionen beim Verzinken von Eisen
![\(\begin{array}[t]{rll}
m (Fe, \text {davor})&=& 80,000\,\text {kg}& \\[5pt]
m (Fe, \text {danach})&=& 80,654\,\text {kg}
\end{array}\)](https://mathjax.schullv.de/dd90197e00533cc6ea0ac389b8c82cda2e93d3ed6db6e71bf78cca2323e14850?color=5a5a5a) Damit ergibt sich:
Damit ergibt sich:
![\(\begin{array}[t]{rll}
m (Zn)&=& 80,654\,\text {kg} - 80,000\,\text {kg} & \\[5pt]
&=& 0,654\,\text {kg} & \\[5pt]
&=& 654 \,\text {g}
\end{array}\)](https://mathjax.schullv.de/73f7919a7eff32c1214fc6c06ec8cb4cabff84746588ea21fc377990da729473?color=5a5a5a) Es gilt:
Es gilt:
![\(\begin{array}[t]{rll}
n &=& \dfrac{m}{M} & \\[5pt]
&=& \dfrac{654 \,\text {g}}{65,4 654 \,\text {g}\cdot\text{mol}}& \\[5pt]
&=& 10 \,\text {mol}
\end{array}\)](https://mathjax.schullv.de/582e8d047fe6c1d2d3fb5ca8e3e202fae3161f8584bc63a0b250f27881b2b04c?color=5a5a5a) Für eine Dauer von vier Tage folgt:
Für eine Dauer von vier Tage folgt:
 Und folglich lässt sich die Stromstärke berechnen mit:
Und folglich lässt sich die Stromstärke berechnen mit:

- Beim Galvanisieren findet eine Elektrolyse statt
eine erzwungene Redox-Reaktion
- Als Elektrolyt dient eine Zink
-Lösung.
- Als Kathode wird der zu galvanisierende Stoff geschaltet und das elementare Zink fungiert als Anode.
3.
Erläuterung der Beobachtungen von Experiment 3
- Die blauen Verfärbungen in a) zeigen, dass im Gegensatz zu b) Eisen
-Ionen in Lösung gegangen sind:
- Der gebildete weiß-gelbliche Niederschlag am Eisennagel zeigt an, dass sich
-Ionen gebildet haben:
- In a) und in b) sind purpurne Verfärbungen zu sehen, welche auf die Entstehung von Hydroxid-Ionen hinweisen:
- Im gebildeten Lokalelement „opfert“ sich das Zink für das edlere Eisen und gibt seine Elektronen über das Eisen ab.
- Dadurch zersetzt sich nur das Zinkstück und der Eisennagel verändert sich nicht.
- Es muss eine leitende Verbindung zwischen Eisen und Zink bestehen.
- Die beiden Metalle müssen sich in einem gemeinsamen Elektrolyten befinden.
- Sobald das Zink vollständig oxidiert ist, endet die Schutzwirkung.