HT 1 – Anlaufen und Reinigen von Silber
- Erläutere die im Experiment a) gemachten Beobachtungen ohne Anlegen einer Spannung mithilfe zugehöriger Reaktionsgleichungen. Berechne die Masse an Silber, die sich in Experiment b) abscheidet. Erläutere den Vorteil der Verwendung von Silber (Experiment b) als Anodenmaterial gegenüber Graphit (Experiment c) unter Einbeziehung der Reaktionsgleichungen für beide Elektrodenvorgänge. Beurteile, ob es sinnvoller ist, Gegenstände galvanisch zu versilbern als sie lediglich in eine Silbersalz-Lösung zu legen.
(24 Punkte)
- Erkläre die Beobachtungen bei der Behandlung von angelaufenem Silber im Labor. Beurteile die Aussagen der Zitate zum Anlaufen von Silber unter der Annahme, dass die aufgelisteten Reaktionen für diesen Vorgang verantwortlich sind.
(14 Punkte)
- Zeichne einen beschrifteten Aufbau der Silberreinigung nach der Aluminium-Salz-Methode. Erläutere auch unter Angabe von Reaktionsgleichungen die elektrochemischen Vorgänge bei diesem Reinigungsverfahren. Beurteile die beiden Verfahren zur Silberreinigung, indem Sie Vor- und Nachteile beider Verfahren gegenüberstellen.
(22 Punkte)
Fachspezifische Vorgaben:
Silber besitzt viele Eigenschaften, die es für Gebrauchsgegenstände nützlich machen. Es hat unter allen Metallen den höchsten Glanz und wirkt bakterientötend. Somit sind Silbergegenstände nicht nur optisch schön, sondern auch hygienisch. Daher findet Silber auch Verwendung bei der Herstellung von Besteck. Silberbesteck besteht meistens nicht aus reinem Silber, da Silber nicht hart genug ist und das Besteck sich leicht verformen würde. Bei Silberbesteck aus „Hartsilber“ wird ein aus einem Stahlkern bestehendes Besteck galvanisch mit einer dünnen Silberschicht überzogen.
Experimente zum Versilbern einer Gabel
Eine elektrochemische Silberabscheidung ist häufig schwierig, da sich Silber oftmals nicht als gleichmäßige Schicht, sondern in Form von unregelmäßigen Verästelungen abscheidet.
a)
In einem Laborexperiment konnte das Versilbern einer Gabel aus Eisen nachvollzogen werden. Hierzu legte man eine Eisengabel in eine Silbernitrat-Lösung. Innerhalb weniger Minuten bildeten sich kleine schwarze Verästelungen an der Eisengabel.
b)
In einem weiteren Experiment verwendete man ein Becherglas, welches mit einer alkalischen Silbernitrat-Lösung der Konzentration  und
und  gefüllt wurde.
gefüllt wurde.
Die Gabel und ein Silberblech wurden in die Lösung gebracht und mit den Polen einer Gleichspannungsquelle verbunden. Im Anschluss wurde mit einer Stromstärke von für
für  galvanisiert.
galvanisiert.
Die Gabel und ein Silberblech wurden in die Lösung gebracht und mit den Polen einer Gleichspannungsquelle verbunden. Im Anschluss wurde mit einer Stromstärke von
c)
In Experiment b) wurde das Silberblech durch eine Graphitelektrode ausgetauscht. Die Gabel überzog sich mit einer Silberschicht. Im Gegensatz zur Verwendung einer Anode aus Silber beobachtete man hier eine Gasentwicklung an der Graphitelektrode.
Anlaufen von Silber
Obwohl es sich bei Silber um ein Edelmetall handelt, läuft es mit der Zeit an. In einem Buch zu Korrosion und Korrosionsschutz kann man folgende Zitate finden:
„In trockenen und feuchten Atmosphären ist Silber immun gegen korrosiven Angriff. Eine Oxidation zu  unterhalb
unterhalb  ist zwar nachzuweisen, eine sichtbare Oxidschicht tritt nicht auf.“
ist zwar nachzuweisen, eine sichtbare Oxidschicht tritt nicht auf.“
„Die Ursache für dieses Anlaufen sind dünne Schichten aus dem schwarzen die sich an der Oberfläche bilden, selbst wenn nur Spuren von
die sich an der Oberfläche bilden, selbst wenn nur Spuren von  in der Atmosphäre zugegen sind. Über den Reaktionsmechanismus ist man sich nicht im Klaren, und auch die stöchiometrischen Verhältnisse sind nicht geklärt. Im Einzelnen ist die Frage offen, ob der Anlaufvorgang [...] unter der Beteiligung von Luftsauerstoff abläuft.“
Die hier zu vermutenden Teilreaktionen mit den entsprechenden Standardpotentialen
in der Atmosphäre zugegen sind. Über den Reaktionsmechanismus ist man sich nicht im Klaren, und auch die stöchiometrischen Verhältnisse sind nicht geklärt. Im Einzelnen ist die Frage offen, ob der Anlaufvorgang [...] unter der Beteiligung von Luftsauerstoff abläuft.“
Die hier zu vermutenden Teilreaktionen mit den entsprechenden Standardpotentialen  lauten:
lauten:
„Die Ursache für dieses Anlaufen sind dünne Schichten aus dem schwarzen
Behandlung von angelaufenem Silber im Labor
Auch Silberbleche im Labor laufen mit der Zeit an. Hält man ein angelaufenes Reinsilberblech in die nichtleuchtende Brennerflamme, so wird dieses wieder blank.
Reinigen von angelaufenem Silberbesteck im Haushalt
In Haushaltsratgebern werden unterschiedliche Maßnahmen zum Reinigen des angelaufenen Silberbestecks vorgeschlagen:
- Zahnpasta-Methode:
Mit einer weichen Bürste wird das Besteck vorsichtig mit Zahnpasta eingerieben. Die Silbersulfid-Schicht wird hierbei mechanisch abgetragen. Anschließend wird die Paste mit Wasser abgewaschen. - Aluminium-Salz-Methode:
In einer Schüssel werden mehrere Teelöffel Kochsalz mit warmem Wasser vermischt, bis sich das Salz gelöst hat. Dann gibt man ein wenig Essig hinzu. Das Silberbesteck wird locker in Aluminiumfolie eingewickelt, sodass es Kontakt mit der Folie hat und fürin dieser Lösung belassen. Bei diesem Verfahren werden die Silber-Ionen wieder in Silber-Atome umgewandelt. Die freiwerdenden Sulfid-Ionen reagieren in der essigsauren Lösung zunächst zu Hydrogensulfid-Ionen
und weiter zu Schwefelwasserstoff-Molekülen
Nach dem Auspacken des Silberbestecks aus der Aluminiumfolie ist das Besteck wieder blank. Die Aluminiumfolie weist eine raue Oberfläche und kleine Löcher auf. Der Geruch von Schwefelwasserstoff ist wahrzunehmen.
Schwefelwasserstoff ist ein sehr giftiges Gas. Der Mensch kann es bereits in äußerst geringen Konzentrationen riechen, die bei kurzzeitiger Wahrnehmung unproblematisch sind.
Zusatzinformationen:
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Beobachtungen in Experiment a)
Im Experiment a) wurde die Eisengabel in eine Silbernitrat-Lösung getaucht. Die schwarzen Verästelungen, die sich innerhalb weniger Minuten gebildet haben, sind ein Anzeichen dafür, dass eine Redoxreaktion zwischen dem Silbernitrat und dem Eisen stattgefunden hat.
Reaktionsgleichung (ohne Anlegen einer Spannung):


 Bei dieser Reaktion wird das Silberion
Bei dieser Reaktion wird das Silberion  aus der Silbernitrat-Lösung reduziert und lagert sich als metallisches Silber
aus der Silbernitrat-Lösung reduziert und lagert sich als metallisches Silber  auf der Oberfläche der Eisengabel ab. Das Eisen
auf der Oberfläche der Eisengabel ab. Das Eisen  geht dabei in die Lösung über und bildet Eisennitrat
geht dabei in die Lösung über und bildet Eisennitrat  Berechnung der Masse an Silber
Die Reaktionsgleichung für die Galvanisierung in Experiment b) lautet:
Berechnung der Masse an Silber
Die Reaktionsgleichung für die Galvanisierung in Experiment b) lautet:


 Die Silberionen aus der Lösung werden an der Kathode zu elementarem Silber reduziert.
Mit dem Faraday-Gesetz kann nun zunächst die Stoffmenge des Silbers und darauffolgend die Masse bestimmt werden.
Aus
Die Silberionen aus der Lösung werden an der Kathode zu elementarem Silber reduziert.
Mit dem Faraday-Gesetz kann nun zunächst die Stoffmenge des Silbers und darauffolgend die Masse bestimmt werden.
Aus  und
und  folgt:
In Experiment b) scheidet sich ca.
folgt:
In Experiment b) scheidet sich ca.  Silber ab.
Vorteil der Verwendung von Silber gegenüber Graphit
Im Experiment c) wurde das Silberblech durch eine Graphitelektrode ersetzt.
Silber ab.
Vorteil der Verwendung von Silber gegenüber Graphit
Im Experiment c) wurde das Silberblech durch eine Graphitelektrode ersetzt.
Die Elektrodenvorgänge mit der Graphitelektrode lauten: Kathode:

 Anode:
Anode: 

 Mit der Silberelektrode lauten die Vorgänge:
Kathode:
Mit der Silberelektrode lauten die Vorgänge:
Kathode: 

 Anode:
Anode: 

 Der Einsatz von Silber gegenüber Graphit als Anodenmaterial ist von Vorteil, da die Silber-Ionen-Konzentration konstant bleibt und nicht wie die Graphitanode kontinuierlich abnimmt.
Der Einsatz von Silber gegenüber Graphit als Anodenmaterial ist von Vorteil, da die Silber-Ionen-Konzentration konstant bleibt und nicht wie die Graphitanode kontinuierlich abnimmt.
Die Graphitelektrode hingegen nämlich mit der alkalischen Lösung – Wasser wird oxidiert und Sauerstoffgas wird freigesetzt. Diese Gasentwicklung kann die Silberabscheidung an der Kathode beeinträchtigen, indem sie die Bildung einer gleichmäßigen Schicht stört. Beurteilung der Methoden
 Die Wahl der Versilberungsmethode davon ab, welche Eigenschaften und Anforderungen für den spezifischen Anwendungsfall am wichtigsten sind. Wenn eine hochwertige und langlebige Versilberung gewünscht ist, ist das galvanische Verfahren in der Regel vorzuziehen. Wenn es jedoch um einfache und kostengünstige Versilberung für weniger anspruchsvolle Anwendungen geht, könnte das Eintauchen in eine Silbersalz-Lösung eine praktikable Option sein.
Die Wahl der Versilberungsmethode davon ab, welche Eigenschaften und Anforderungen für den spezifischen Anwendungsfall am wichtigsten sind. Wenn eine hochwertige und langlebige Versilberung gewünscht ist, ist das galvanische Verfahren in der Regel vorzuziehen. Wenn es jedoch um einfache und kostengünstige Versilberung für weniger anspruchsvolle Anwendungen geht, könnte das Eintauchen in eine Silbersalz-Lösung eine praktikable Option sein.
 Die Wahl der Versilberungsmethode davon ab, welche Eigenschaften und Anforderungen für den spezifischen Anwendungsfall am wichtigsten sind. Wenn eine hochwertige und langlebige Versilberung gewünscht ist, ist das galvanische Verfahren in der Regel vorzuziehen. Wenn es jedoch um einfache und kostengünstige Versilberung für weniger anspruchsvolle Anwendungen geht, könnte das Eintauchen in eine Silbersalz-Lösung eine praktikable Option sein.
Die Wahl der Versilberungsmethode davon ab, welche Eigenschaften und Anforderungen für den spezifischen Anwendungsfall am wichtigsten sind. Wenn eine hochwertige und langlebige Versilberung gewünscht ist, ist das galvanische Verfahren in der Regel vorzuziehen. Wenn es jedoch um einfache und kostengünstige Versilberung für weniger anspruchsvolle Anwendungen geht, könnte das Eintauchen in eine Silbersalz-Lösung eine praktikable Option sein.
Die Elektrodenvorgänge mit der Graphitelektrode lauten: Kathode:
Die Graphitelektrode hingegen nämlich mit der alkalischen Lösung – Wasser wird oxidiert und Sauerstoffgas wird freigesetzt. Diese Gasentwicklung kann die Silberabscheidung an der Kathode beeinträchtigen, indem sie die Bildung einer gleichmäßigen Schicht stört. Beurteilung der Methoden
2.
Beobachtungen bei der Behandlung von angelaufenem Silber im Labor
Die dunkle, matte Schicht des angelaufenen Silberblechs besteht aus Silbersulfid  welches durch die Reaktion von Silber mit Wasserstoffdisulfid entstanden ist. Wenn das Silberblech in die Flamme gehalten wird, wird es wieder blank, da es reduziert wird.
Beurteilung der Zitate
Werden die Standardpotenziale betrachtet, ist zu sehen, dass Silber
welches durch die Reaktion von Silber mit Wasserstoffdisulfid entstanden ist. Wenn das Silberblech in die Flamme gehalten wird, wird es wieder blank, da es reduziert wird.
Beurteilung der Zitate
Werden die Standardpotenziale betrachtet, ist zu sehen, dass Silber  nicht durch Sauerstoff
nicht durch Sauerstoff  oxidiert werden kann. Dies erklärt also nicht die Bildung von
oxidiert werden kann. Dies erklärt also nicht die Bildung von  unterhalb von
unterhalb von  Die Teilreaktionen, wenn Silber mit Schwefelwasserstoff zu Silbersulfid reagiert, lauten:
Die Teilreaktionen, wenn Silber mit Schwefelwasserstoff zu Silbersulfid reagiert, lauten:


 und
und


 Da das Potenzial von
Da das Potenzial von  größer ist als das von
größer ist als das von  können die Reaktionen gleichzeitig ablaufen. Sauerstoff wird als Elektronen-Akzeptor reduziert.
können die Reaktionen gleichzeitig ablaufen. Sauerstoff wird als Elektronen-Akzeptor reduziert.
Folglich kann Silber nur unter Anwesenheit von Schwefelwasserstoff und Luftsauerstoff anlaufen.
Folglich kann Silber nur unter Anwesenheit von Schwefelwasserstoff und Luftsauerstoff anlaufen.
3.
Aufbau der Silberreinigung nach der Aluminium-Salz-Methode
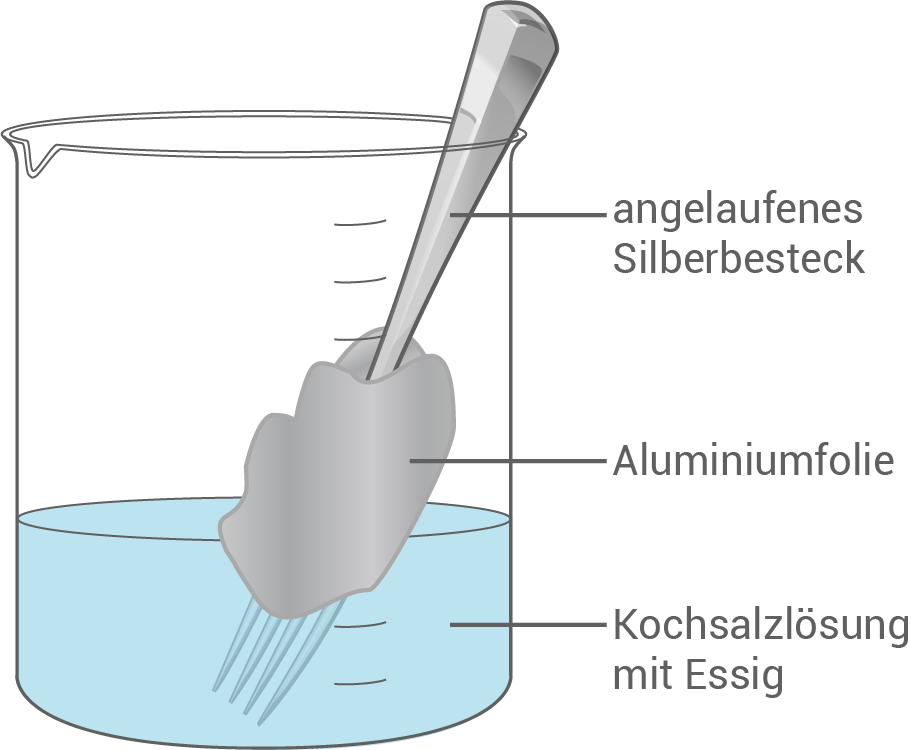 Vorgänge
Beim Einwickeln des angelaufenen Silberbestecks in Aluminiumfolie bildet sich eine Art galvanische Zelle / ein Lokalelement. Das Aluminium fungiert dabei als Anode, während das Silberbesteck als Kathode wirkt.
Das Kochsalz dient hierbei als Elektrolyt, um die Leitfähigkeit zu erhöhen.
Gesamtreaktion:
Vorgänge
Beim Einwickeln des angelaufenen Silberbestecks in Aluminiumfolie bildet sich eine Art galvanische Zelle / ein Lokalelement. Das Aluminium fungiert dabei als Anode, während das Silberbesteck als Kathode wirkt.
Das Kochsalz dient hierbei als Elektrolyt, um die Leitfähigkeit zu erhöhen.
Gesamtreaktion:


 Die Aluminiumfolie gibt dabei Elektronen ab (Oxidation) und geht in Aluminium-Ionen über:
Die Aluminiumfolie gibt dabei Elektronen ab (Oxidation) und geht in Aluminium-Ionen über:


 Die Silber-Ionen aus dem angelaufenen Besteck nehmen diese Elektronen auf und reduzieren sich zu elementarem Silber:
Die Silber-Ionen aus dem angelaufenen Besteck nehmen diese Elektronen auf und reduzieren sich zu elementarem Silber:


 Dadurch wird das Silber an der Oberfläche des Bestecks wieder blank und rein.
Weiterreaktion:
Dadurch wird das Silber an der Oberfläche des Bestecks wieder blank und rein.
Weiterreaktion:


 Dadurch entsteht der charakteristische faulige Geruch von Schwefelwasserstoff.
Beurteilung der Verfahren
Beide Verfahren stellen, je nach Schweregrad des Anlaufs und den verfügbaren Ressourcen, gute Möglichkeiten zur Silberreinigung dar. Die Zahnpasta-Methode ist einfach und sicher, aber möglicherweise weniger wirksam für stark angelaufenes Silber. Die Aluminium-Salz-Methode kann eine effektive Lösung für stark angelaufenes Silberbesteck sein, erfordert jedoch vorsichtigen Umgang mit dem giftigen Schwefelwasserstoff.
Dadurch entsteht der charakteristische faulige Geruch von Schwefelwasserstoff.
Beurteilung der Verfahren
Beide Verfahren stellen, je nach Schweregrad des Anlaufs und den verfügbaren Ressourcen, gute Möglichkeiten zur Silberreinigung dar. Die Zahnpasta-Methode ist einfach und sicher, aber möglicherweise weniger wirksam für stark angelaufenes Silber. Die Aluminium-Salz-Methode kann eine effektive Lösung für stark angelaufenes Silberbesteck sein, erfordert jedoch vorsichtigen Umgang mit dem giftigen Schwefelwasserstoff.
