Vorschlag C – Krustenechsen
Hinweis: Von den Vorschlägen A, B und C soll in der Prüfung nur einer bearbeitet werden.
GLP-1 und das Gift der Krustenechse
Die „Zuckerkrankheit“ Diabetes mellitus gehört zu den weltweit häufigsten Erkrankungen. Sie geht mit einem krankhaft erhöhten Blutglucosespiegel einher. Wichtigstes Medikament zur Behandlung des Diabetes ist gentechnisch hergestelltes Insulin, das jedoch vom Patienten sorgfältig dosiert werden muss, um lebensgefährliche Risiken zu vermeiden. Neben Insulin und seinem Gegenspieler Glucagon sind weitere Proteine wie GLP-1 an der Regulation des Blutglucosespiegels beteiligt. Erstaunlicherweise enthält auch der giftige Speichel der Gila-Krustenechse (Heloderma suspectum) ein Protein, welches dem menschlichen GLP-1-Protein ähnlich ist. Auf dieser Basis wurden neue Medikamente, die sogenannten GLP-1-Agonisten, entwickelt.Krustenechsen
1
Gib Definitionen für biotische und für abiotische Umweltfaktoren mit jeweils zwei Beispielen an. Zeichne die beschriftete Toleranzkurve der Krustenechse in Bezug auf den Umweltfaktor Temperatur und vergleiche diese mit der Toleranzkurve eines endothermen Lebewesens. (Material 1)
(13 BE)
Stoffwechsel- und neurophysiologische Aspekte
2
Beschreibe die Ergebnisse der Untersuchungen in Material 3. Entwickle eine Hypothese, welche Messergebnisse für Glucose und Insulin nach der Aufnahme von Kohlenhydraten bei unbehandelten Diabetikern des Typs 1 zu erwarten sind. (Material 2 und 3)
(9 BE)
3
Erläutere die Wirkung von Glucose auf die β-Zellen der Bauchspeicheldrüse. Vergleiche Ursache und Vorgänge bei der Insulinausschüttung mit der Transmitterfreisetzung in Synapsen. (Material 4)
(20 BE)
4
Analysiere die Untersuchungsergebnisse in Material 5 zur Funktionsveränderung der β-Zellen bei einem Patienten mit fortgeschrittenem Diabetes Typ 2 im Vergleich zu einem gesunden Menschen. (Material 2, 4 und 5)
(13 BE)
Genetische Aspekte
5
Gib eine Definition für einen Transkriptionsfaktor an und nenne zwei mögliche Wirkungen von Transkriptionsfaktoren. Beschreibe das Prinzip der DNA-Methylierung und ihre Wirkung auf die Transkription.
(8 BE)
6
Erkläre die verringerte Biosynthese von Insulin bei Personen mit fortgeschrittenem Diabetes Typ 2. (Material 2, 4 und 6)
(12 BE)
GLP-1-Agonisten
7
Fasse die Untersuchungsergebnisse zusammen und erläutere den sogenannten „Inkretin-Effekt“. (Material 2 und 7)
(10 BE)
8
Erläutere die Wirkung von Exenatid auf die Freisetzung von Insulin. (Material 4 und 8)
(7 BE)
9
Erkläre das geringere Risiko einer Hypoglykämie bei der therapeutischen Verwendung von GLP1-Agonisten im Vergleich zur Eigenanwendung von Insulin. (Material 2, 4 und 8)
(8 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1
Gila Monster

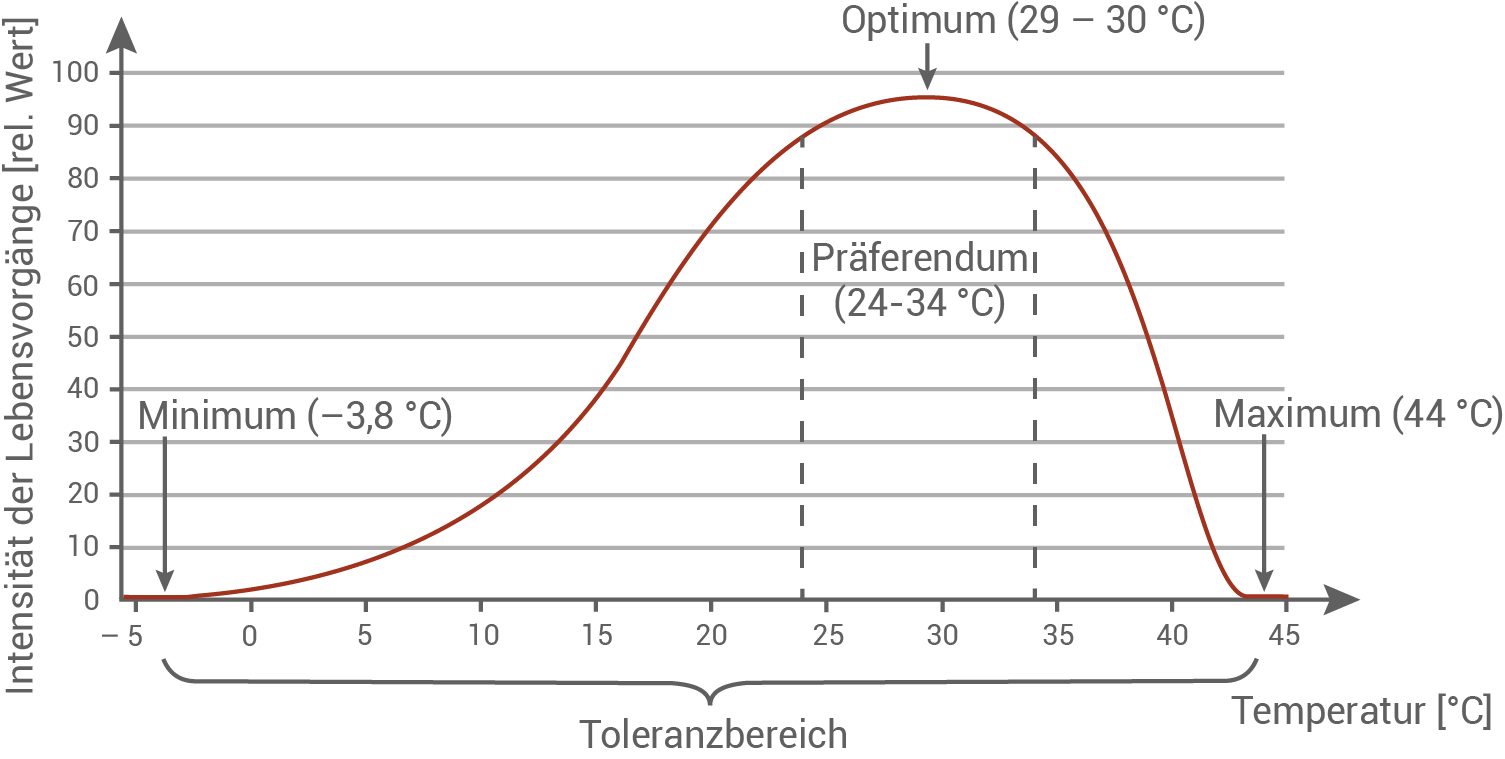
Die Krustenechse Heloderma suspectum, in der indianischen Mythologie als „Gila Monster“ bezeichnet, ist ein im Südwesten der USA heimisches Reptil, das in kargen Landschaften und Wüsten vorkommt. Dort verbringt die Krustenechse ca. 90 % ihres Lebens unter der Erdoberfläche in Sand- oder Steinhöhlen. Als ektothermes Lebewesen hängt ihre Körpertemperatur von der Außentemperatur ab. Krustenechsen gehen bei einer Temperatur von 24 bis 34 Grad Celsius auf Beutesuche, ihre bevorzugte Temperatur liegt bei 29 bis 30 Grad Celsius. Kurzzeitig überleben die Tiere auch Temperaturen von –3,8 Grad beziehungsweise 44 Grad Celsius. Im giftigen Speichel der Krustenechse wurde in den 1990er Jahren ein Protein entdeckt, das den Blutzuckerspiegel bei Säugetieren beeinflussen kann.
Material 2
Diabetes mellitus – gestörter Kohlenhydratstoffwechsel
Für die Energiegewinnung benötigen Zellen ständig Glucose, welche ihnen über den Blutstrom zugeführt wird. Vor allem die Hormone Insulin und Glucagon regeln nach dem Gegenspielerprinzip die Glucosekonzentration im Blut, den sogenannten „Blutzuckerspiegel“, auf einen Wert von ca. 1 mg/ml, da sowohl zu hohe als auch zu niedrige Werte zu gesundheitlichen Beeinträchtigungen führen können.Regulation der Glucosekonzentration im Blut durch Insulin und Glucagon
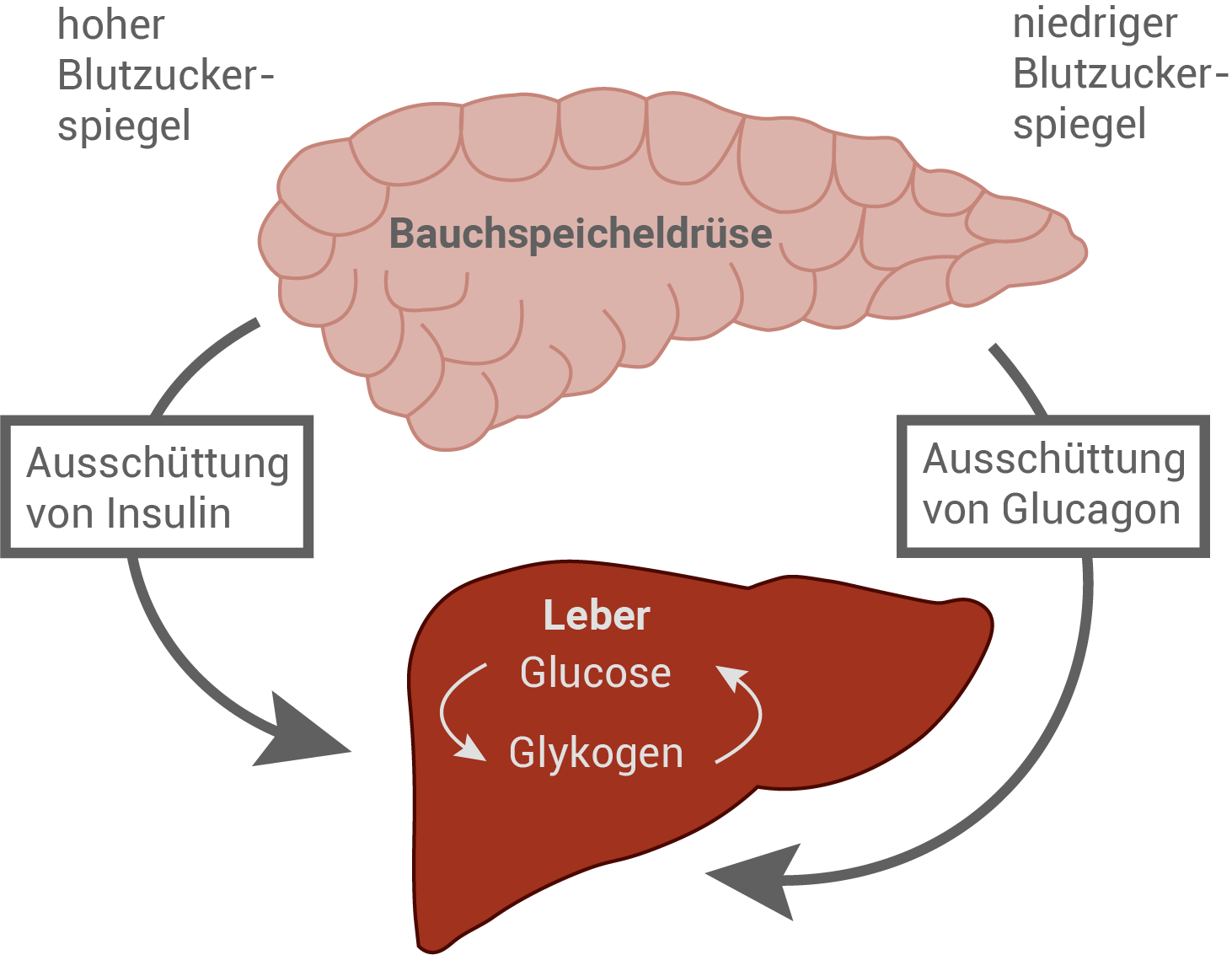
Insulin und Glucagon werden in verschiedenen Zelltypen der Bauchspeicheldrüse produziert und in Vesikeln gespeichert: Glucagon in den α-Zellen, Insulin hingegen in den β-Zellen. Die Bindung von Insulin an Insulinrezeptoren fördert die Aufnahme von Glucose über spezifische Transportproteine in die Zielzellen und senkt dadurch die Glucosekonzentration im Blut. Das Hormon Glucagon bewirkt hingegen die Gewinnung von Glucose in der Leber aus der Speicherform Glykogen (Glykogenolyse) und führt somit zu einem Ansteigen der Glucosekonzentration im Blut.
Die „Zuckerkrankheit“ Diabetes mellitus tritt vor allem in zwei Erscheinungsformen auf: Bei Diabetes Typ 1 gehen die β-Zellen zugrunde. Bei Diabetes Typ 2 hingegen nehmen zunächst die Anzahl sowie die Funktion der Insulinrezeptoren in den Zielorganen im Verlauf der Erkrankung allmählich ab. Im Spätstadium der Erkrankung verringert sich die Insulinproduktion der β-Zellen zunehmend.
Eine verminderte oder fehlende Insulinwirkung kann durch plötzlich auftretende sehr hohe Glucosekonzentrationen im Blut zur Bewusstlosigkeit bis hin zum Koma führen. Als Spätfolgen eines schlecht eingestellten oder unbehandelten Diabetes sind vor allem Schäden der Blutgefäße gefürchtet: Langfristige Durchblutungsstörungen können Folgen wie Erblindung, Schlaganfall oder Herzinfarkt sowie Nervenschädigungen nach sich ziehen. Eine frühzeitige Einstellung des Blutglucosespiegels mithilfe von Medikamenten ist daher lebenswichtig.
Material 3
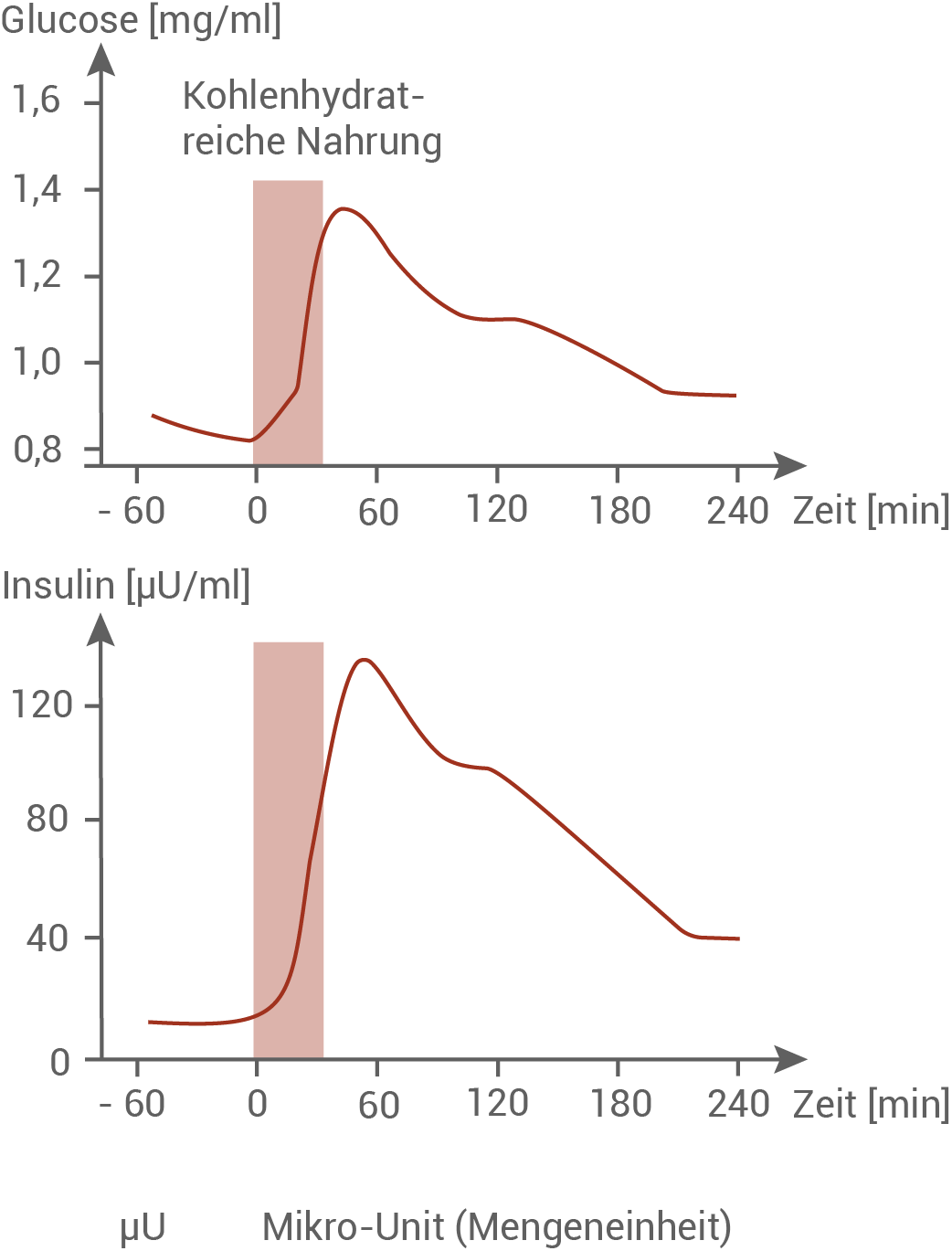
Einfluss von kohlenhydratreicher Nahrung auf verschiedene Blutwerte
Die Diagramme zeigen die Konzentrationen von Glucose und Insulin im Blut gesunder Personen vor beziehungsweise nach einer kohlenhydratreichen Mahlzeit (in der Abbildung dargestellt durch graue Balken).Untersuchung zur Aufnahme von Kohlenhydraten bei gesunden Personen
Material 4
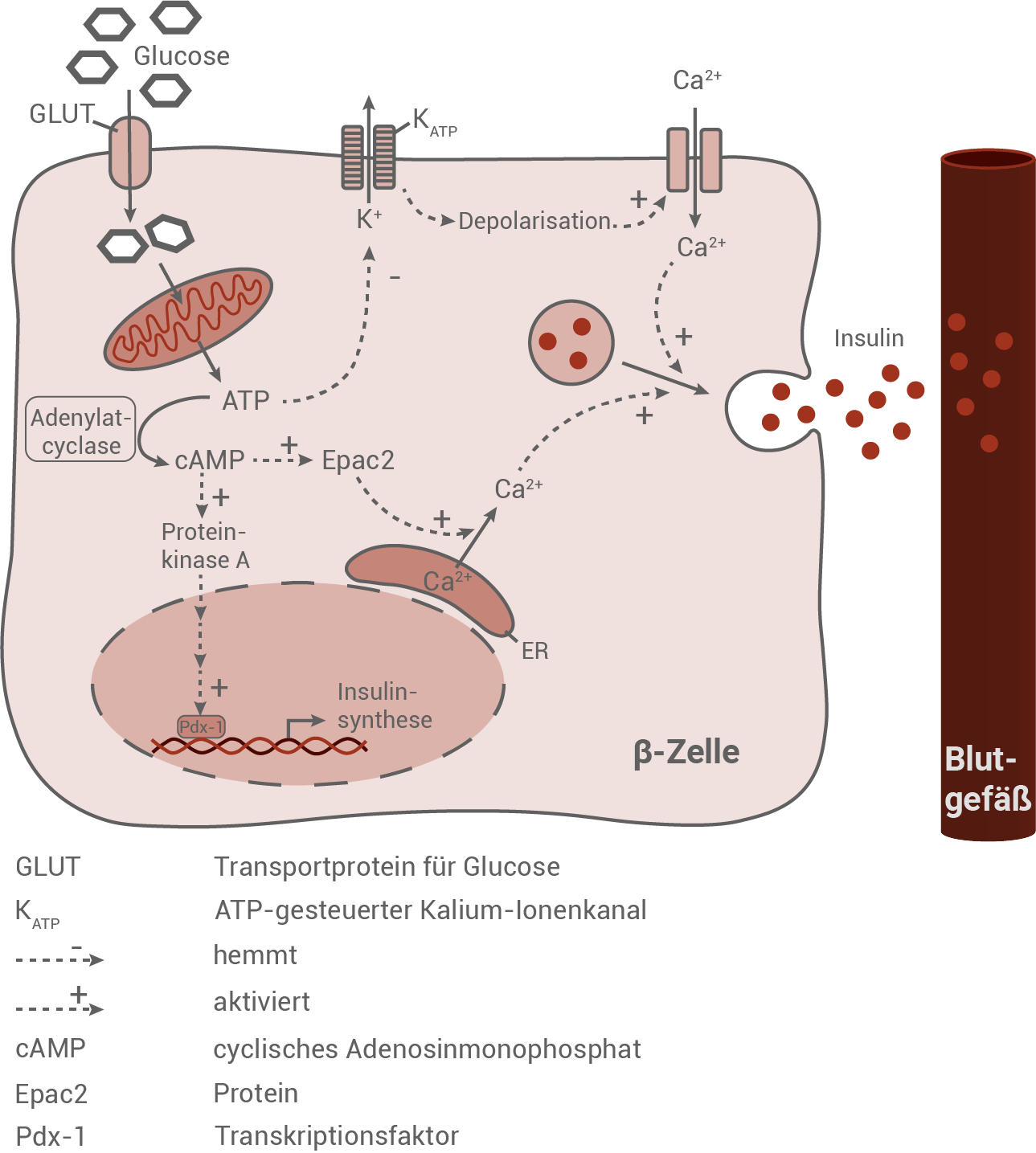
Sekretion von Insulin
Die Ausschüttung des Peptidhormons Insulin aus den β-Zellen der Bauchspeicheldrüse wird vor allem durch die Glucosekonzentration im Blut bestimmt.Wirkung von Glucose auf eine β-Zelle der Bauspeicheldrüse
Material 5
Funktionsveränderung der β-Zellen bei fortgeschrittenem Diabetes Typ 2
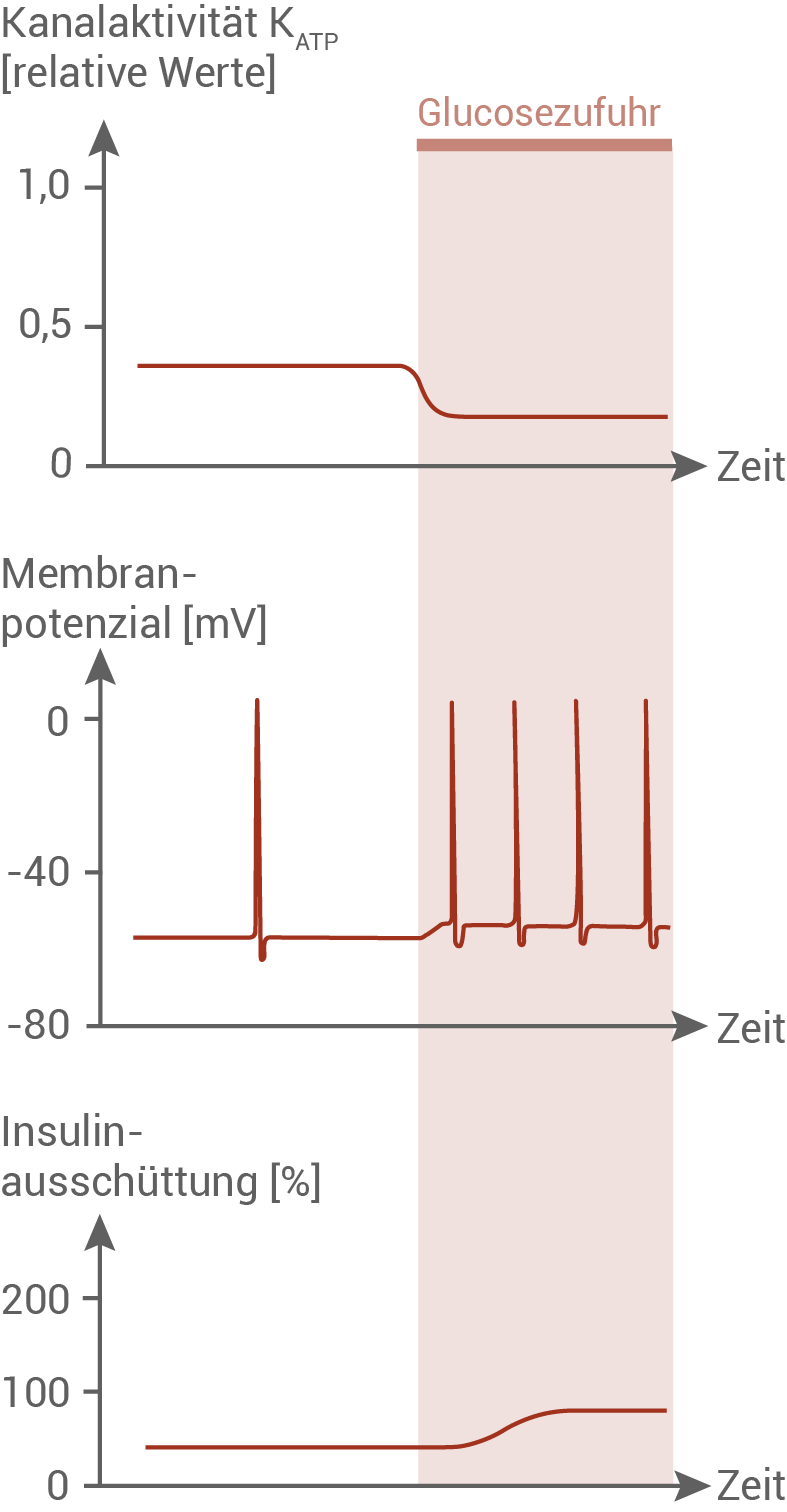
Im späteren Verlauf einer Diabetes Typ-2-Erkrankung verlieren die β-Zellen der Bauchspeicheldrüse weitgehend die Fähigkeit, bedarfsgerecht Insulin zu produzieren und auszuschütten. Um die Ursachen für diese verminderte Ausschüttung von Insulin aus β-Zellen bei fortgeschrittenem Diabetes Typ 2 zu ermitteln, wurden verschiedene Funktionsparameter von β-Zellen in der Bauchspeicheldrüse gesunder Menschen und an Diabetes Typ 2 erkrankter Personen untersucht, z. B. die Aktivität der ATP-gesteuerten Kalium-Ionenkanäle (Abbildung 5.1: β-Zellen gesunder Personen
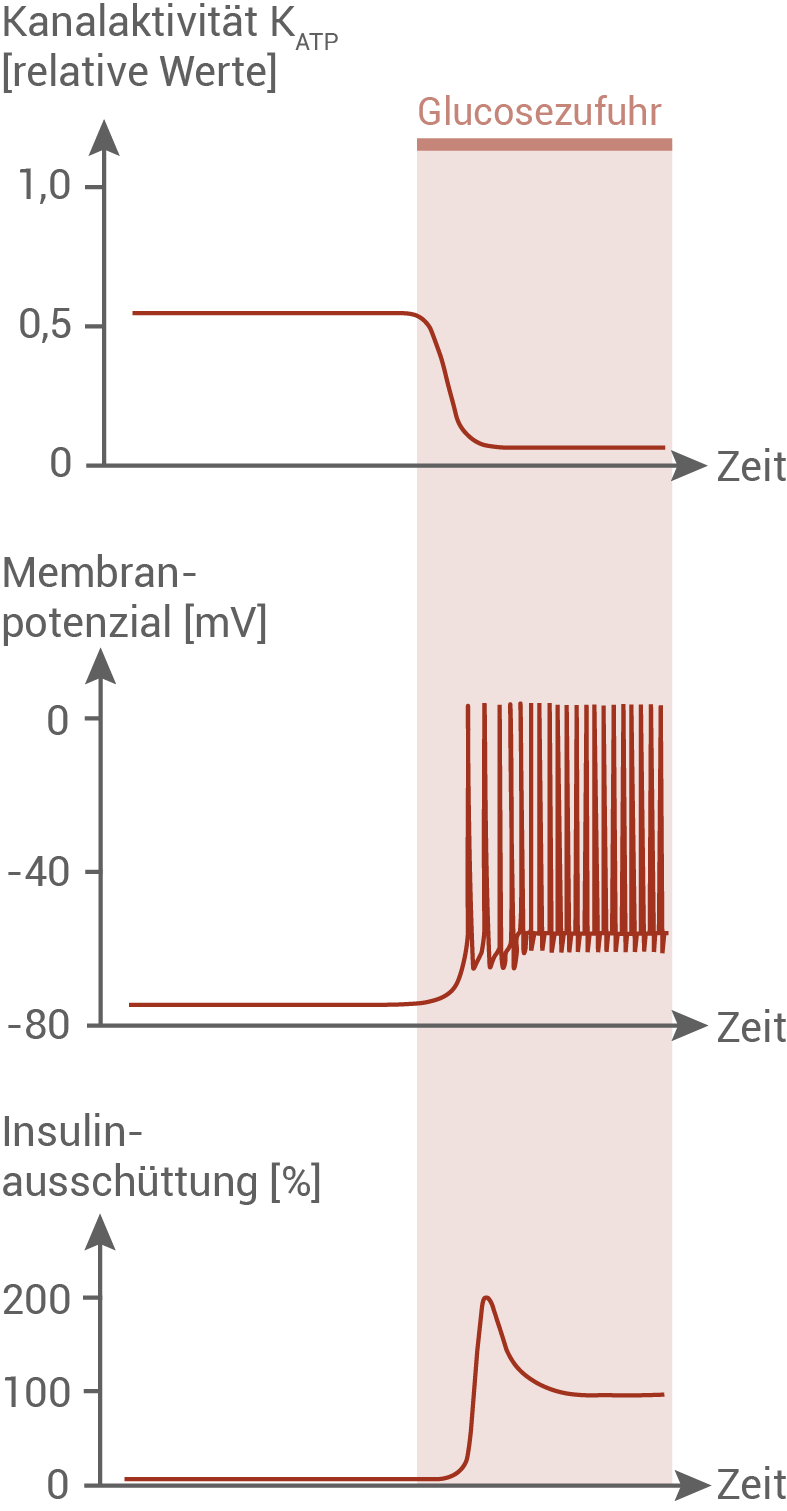
Abbildung 5.2: β-Zellen von Personen mit Diabetes Typ 2
Material 6
Expression des Pdx-1-Gens
Wissenschaftlerinnen aus Schweden und der Schweiz untersuchten bei gesunden Personen und Typ-2-Diabetikern den Zusammenhang zwischen der Expression des Transkriptionsfaktors Pdx-1 in β-Zellen und dem Methylierungsgrad des Pdx-1-Promotors in Abhängigkeit von der Glucosekonzentration im Blut. Hierfür wurde die mittlere Blutglucosekonzentration über einen Zeitraum von 8 bis 10 Wochen bestimmt. Dieser Wert liegt bei gesunden Menschen unter einem relativen Wert von 5,7. Bei Personen mit Diabetes Typ 2 ist dieser Wert erhöht.Abbildung 6.1: Mittlere Glucosekonzentration im Blut und Methylierung des Pdx-1-Promotors
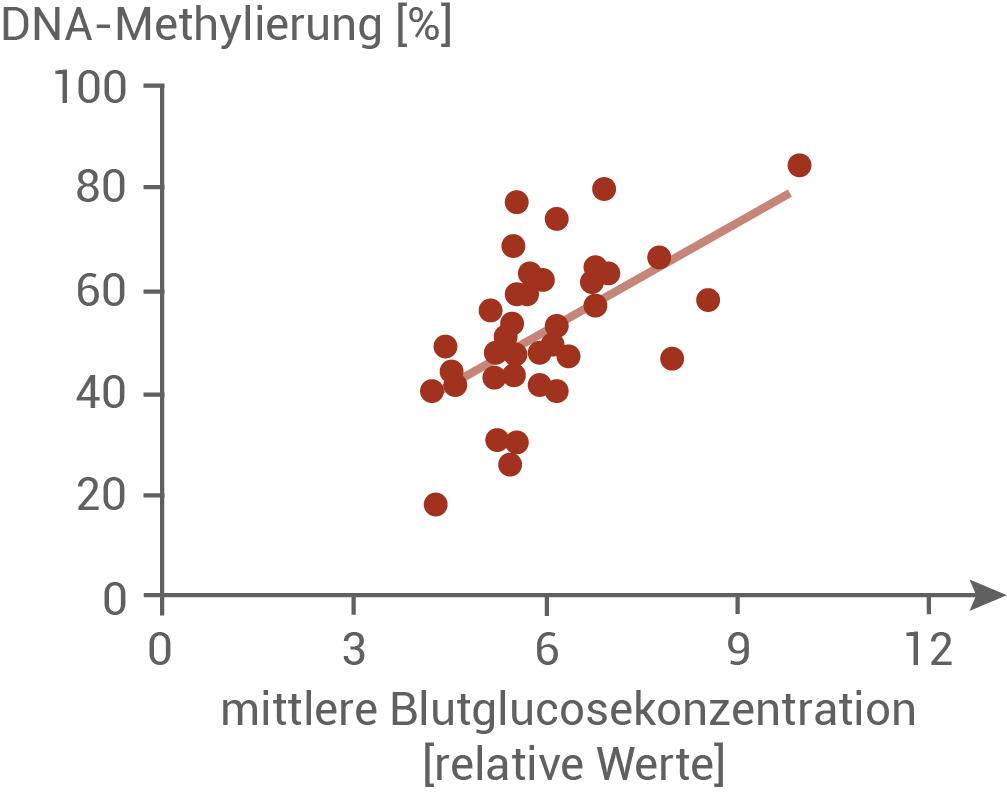
Abbildung 6.2: Methylierung des des Pdx-1-Promotors und Expression des Pdx-1-Gens
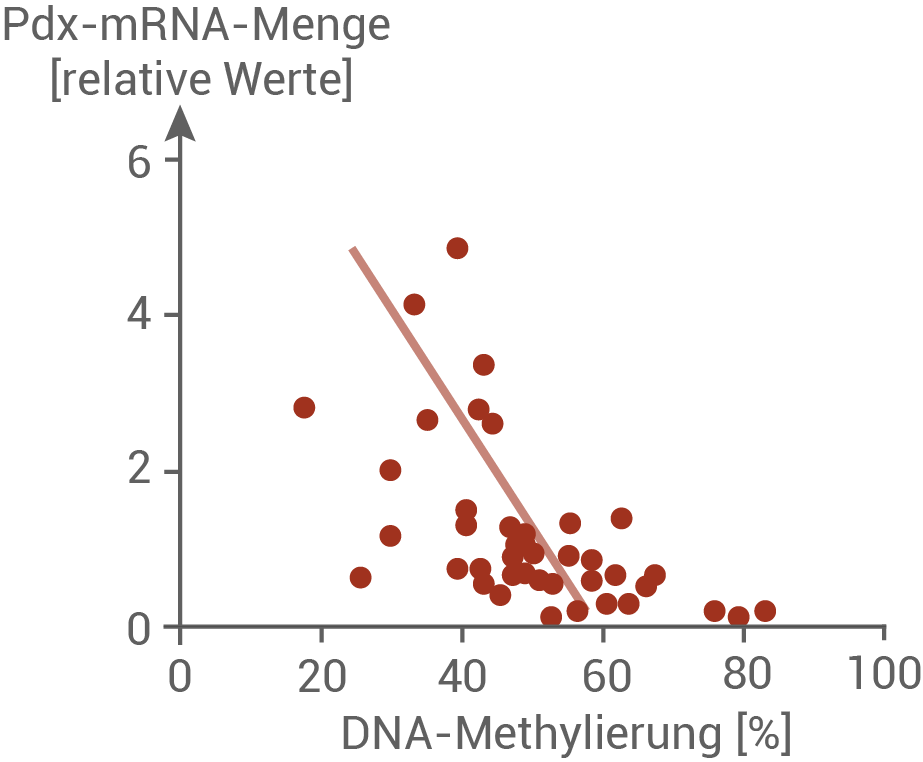
Die Messwerte in den Abbildungen 6.1 und 6.2 repräsentieren sowohl gesunde als auch an Diabetes Typ 2 erkrankte Personen.
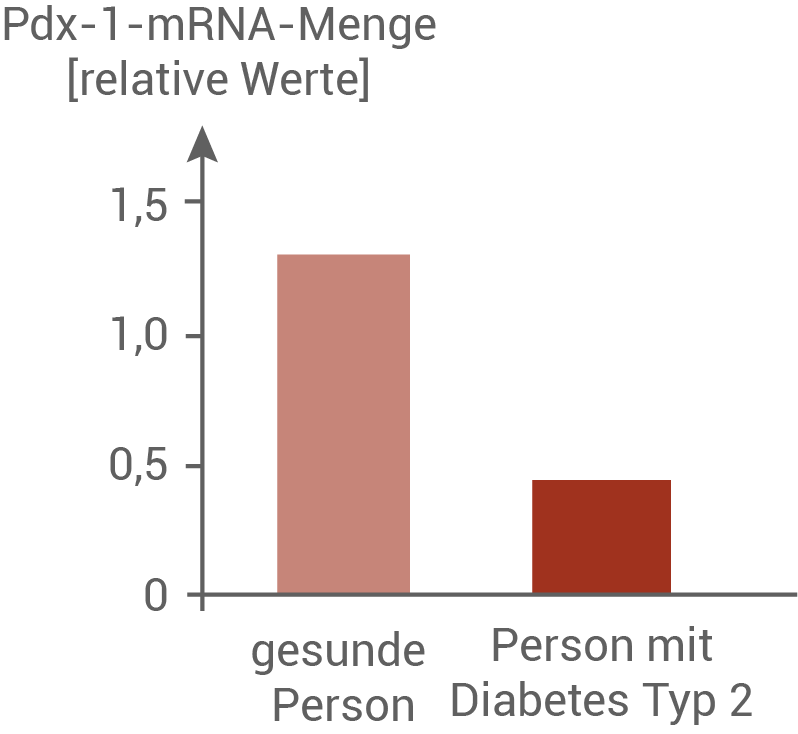
Abbildung 6.3: Expression des Pdx-1-Gens
Material 7
Der Inkretin-Effekt
Bei Untersuchungen zum Blutzuckerspiegel gesunder Personen ist eine Besonderheit hinsichtlich der Insulinausschüttung nach der Zufuhr von Glucose zu beobachten, die als sogenannter „Inkretin-Effekt“ bezeichnet wird. Die Abbildungen zeigen die Ergebnisse von Untersuchungen zum Inkretin-Effekt. Eine Untersuchungsgruppe nahm zum Zeitpunkt 0 Minuten eine Glucoselösung oral zu sich, sodass die Aufnahme über den Verdauungstrakt erfolgte. Der anderen Untersuchungsgruppe wurde eine entsprechende Menge Glucose in eine Vene gespritzt, sodass die Glucose direkt im Blut vorlag. Anschließend wurde bei beiden Gruppen die Konzentration von Glucose und von Insulin im Blut bestimmt.Untersuchung der Glucose und Insulinkonzentration im Blut
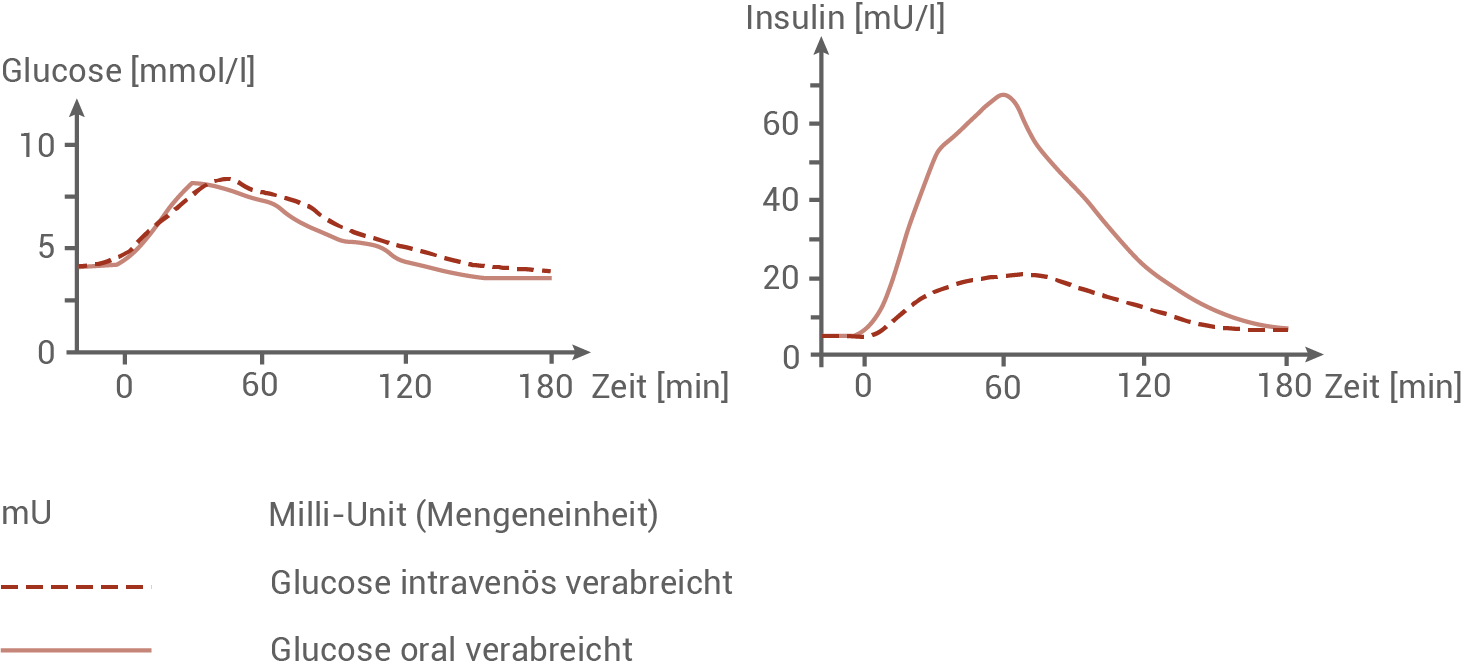
Bei gesunden Menschen liegt der Blutglucosewert vor einer Mahlzeit (nüchtern) unter 5,5 mmol/l. Die Glucosekonzentration im Blut vor dem Zeitpunkt 0 ist nicht Gegenstand der Aufgabe. Den in den Abbildungen dargestellten Effekt bezeichnet man als Inkretin-Effekt. Ursächlich hierfür sind verschiedene, von der Darmschleimhaut gebildete Hormone, vor allem das von den Zellen der Darmschleimhaut produzierte Glucagon-like-Peptid 1 (GLP-1). Die Aufnahme von Nahrung in den Darm bewirkt die Freisetzung von GLP-1 aus den Darmschleimhautzellen in den Blutstrom. Bei Personen mit Diabetes Typ 2 beobachtet man einen abgeschwächten Inkretin-Effekt, da bei ihnen die Ausschüttung von GLP-1 verringert ist.
Material 8
Diabetes-Therapien
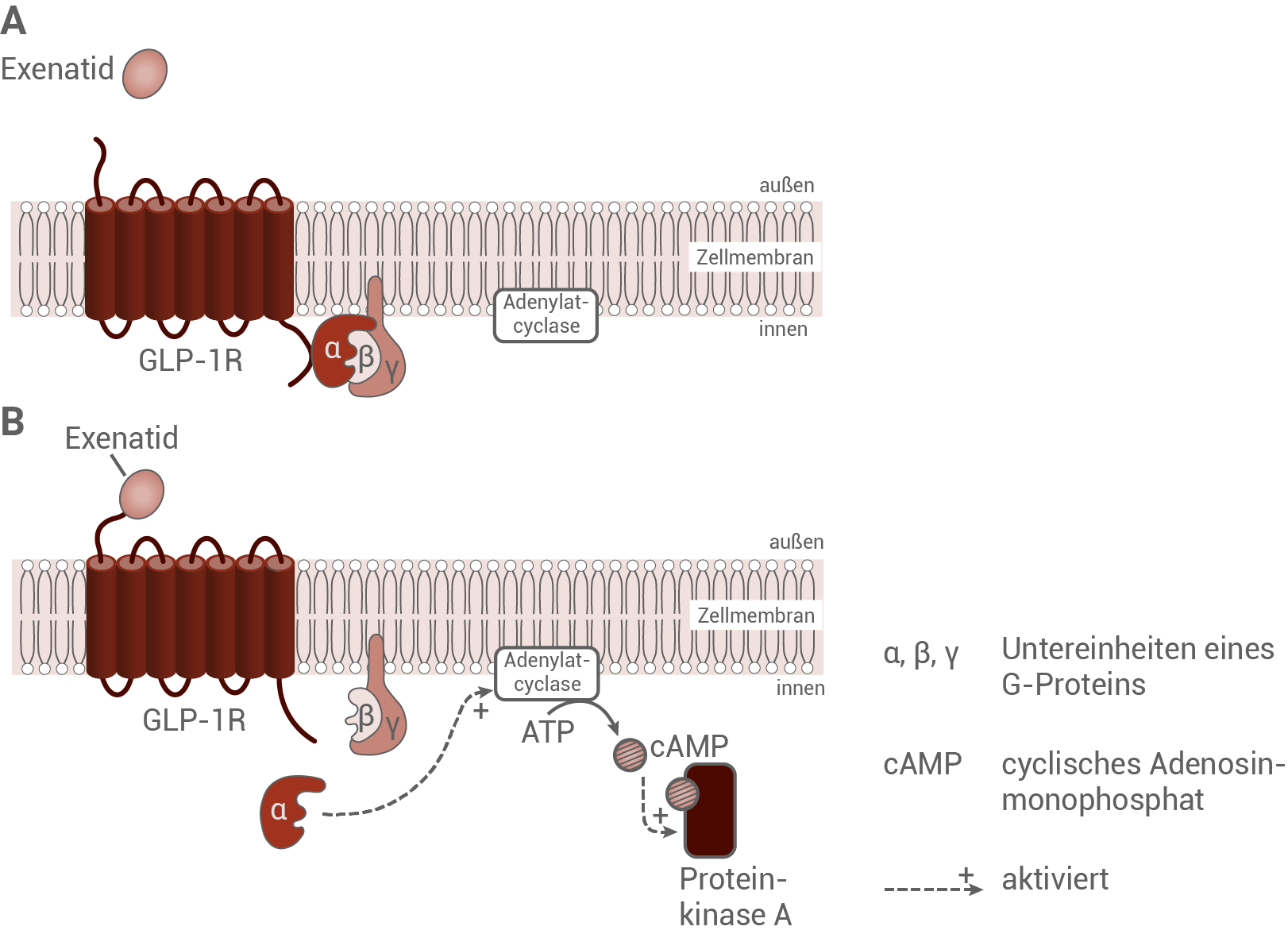
Eine mögliche Therapie des Diabetes besteht in der Einnahme von Insulin in verschiedenen Formen mit unterschiedlich lang anhaltender Wirkung. Das Insulin wird in der Regel vom Patienten selbst dosiert, was erfordert, die Glucosekonzentration im Blut zu bestimmen und die benötigte Insulindosis je nach Nahrungsaufnahme sehr genau einzustellen. Die Eigenanwendung von Insulin birgt jedoch für die Patienten die Gefahr einer unter Umständen lebensgefährlichen Unterzuckerung (Hypoglykämie) als Folge einer Überdosierung, ebenso wie das Risiko einer möglichen Überzuckerung. Die Entdeckung der Wirkung von GLP-1 auf die β-Zellen der Bauchspeicheldrüse führte zur Entwicklung eines alternativen Therapieansatzes zur Behandlung von Diabetes. Das im menschlichen Organismus vorkommende (humane) GLP-1 wird allerdings innerhalb kürzester Zeit enzymatisch abgebaut, was seine unmittelbare Nutzung als Medikament verhindert. Das Gift der Krustenechse Heloderma suspectum enthält ein Peptid, welches Strukturähnlichkeit zum humanen GLP-1 aufweist. Es bindet an den Rezeptor für GLP-1 (GLP-1R) und ruft die gleichen zellulären Wirkungen hervor. Zudem ist es deutlich stabiler gegen enzymatischen Abbau als das humane GLP-1-Protein, daher wird es unter dem Namen ExenatidWirkung von Exenatid auf β-Zellen der Bauchspeicheldrüße
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Definition Biotischer Umweltfaktoren:
Biotische Faktoren sind die Gesamtheit alle Einflüsse der belebten Umwelt. Es handelt sich dabei um die Beziehungen der Lebewesen eines Ökosystems untereinander. Beispiele für biotische Umweltfaktoren sind die Symbiose oder die Konkurrenz.
Definition Abiotischer Umweltfaktoren:
Abiotische Faktoren sind die Gesamtheit alle Einflüsse der unbelebten Umwelt. Es handelt sich dabei um die Einflüsse von außen, die nicht durch Beziehungen von Lebewesen untereinander hervorgerufen werden. Beispiele für biotische Umweltfaktoren sind die Temperatur oder die Lichtverfügbarkeit.
Toleranzkurve der Krustenechse:
 Vergleich mit der Toleranzkurve eines endothermen Lebewesens:
Sowohl ektothereme als auch endotherme Lebewesen weisen ein Minimum und ein Maximum in Bezug auf tolerierte Temperaturgrenzwerte auf. Jenseits dieser Grenzen können sie nicht existieren. Endotherme Lebewesen halten ihre Körpertemperatur durch Stoffwechselvorgänge konstant, sie sind nicht auf Wärme von außen angewiesen. In der Toleranzkurve weisen sie einen sehr breiten Bereich des Präferendums auf. Dabei ist kein deutliches Optimum in Form eines Scheitelpunktes der Kurve wie bei ektothermen Lebewesen zu erkennen. Ektothereme Lebewesen sind von einer Wärmezufuhr von außen angewiesen. Der Temperaturbereich des Präferendums ist eingeschränkt und es ist ein deutliches Optimum zu in der Toleranzkurve zu erkennen. In diesem Temperaturbereich laufen Stoffwechselvorgänge am effizientesten ab.
Vergleich mit der Toleranzkurve eines endothermen Lebewesens:
Sowohl ektothereme als auch endotherme Lebewesen weisen ein Minimum und ein Maximum in Bezug auf tolerierte Temperaturgrenzwerte auf. Jenseits dieser Grenzen können sie nicht existieren. Endotherme Lebewesen halten ihre Körpertemperatur durch Stoffwechselvorgänge konstant, sie sind nicht auf Wärme von außen angewiesen. In der Toleranzkurve weisen sie einen sehr breiten Bereich des Präferendums auf. Dabei ist kein deutliches Optimum in Form eines Scheitelpunktes der Kurve wie bei ektothermen Lebewesen zu erkennen. Ektothereme Lebewesen sind von einer Wärmezufuhr von außen angewiesen. Der Temperaturbereich des Präferendums ist eingeschränkt und es ist ein deutliches Optimum zu in der Toleranzkurve zu erkennen. In diesem Temperaturbereich laufen Stoffwechselvorgänge am effizientesten ab.

2
Ergebnisse der Untersuchungen in Material 3:
In den Diagrammen ist die Glucosekonzentration in mg/ml und die Insulinkonzentration in µU/ml im Blut nach einer kohlenhydratreichen Mahlzeit gegen die Zeit aufgetragen. Im nüchternen Zustand liegt der Blutzuckerwert bei 0,85 mg/ml. Nach einer kohlenhydratreichen Mahlzeit steigt der Blutzuckerwert innerhalb von etwa 40 Minuten auf einen Wert von 1,35 mg/ml an. In den darauffolgenden 50 Minuten sinkt der Wert bis auf eine Konzentration von 1,1 mg/ml und nach weiteren 90 Minuten auf 0,90 mg/ml ab. Auch vier Stunden nach der Mahlzeit ist der Nüchternwert von 0,85 mg/ml noch nicht wieder erreicht. Der Insulinwert korreliert mit dem Blutzuckerspiegel. Im nüchternen Zustand liegt er bei etwa 10 µU/ml. Nach einer kohlenhydrathaltigen Mahlzeit steigt er innerhalb von etwa 60 Minuten auf ein Maximum von 140 µU/ml an. Analog zur Glucosekonzentration erreicht der Wert vier Stunden nach der Mahlzeit eine Konzentration von 40 µU/ml. Auch hier ist der Wert immer noch etwa viermal so hoch wie die Nüchternkonzentration.
Hypothese, welche Messergebnisse für Glucose und Insulin nach Aufnahme von Kohlenhydraten bei unbehandelten Diabetikern zu erwarten sind:
Bei Patienten, die an Diabetes Typ 1 erkrankt sind, gehen die β-Zellen zugrunde. Im Normalfall produzieren und speichern diese Insulin. Bei betroffenen Personen ist demnach die Insulinausschüttung ins Blut geschwächt oder unterbleibt vollständig. Insulin sorgt für die Aufnahme von Glucose in die Zielzellen, und senkt dadurch den Blutzuckerspiegel. Bei erkrankten Personen kann dieser Vorgang durch mangelnde Insulinproduktion nicht mehr ablaufen. Der Insulinwert steigt nach einer Mahlzeit nicht an. Dadurch verbleibt die Glucose im Blut, und der Glucosewert sinkt nach einer kohlenhydratreichen Mahlzeit nicht, sondern bleibt auf einem konstanten Niveau.
3
Wirkung von Glucose auf die β-Zellen der Bauchspeicheldrüse:
Durch die GLUT-Rezeptoren wird Glucose aus dem Blut in die β-Zellen aufgenommen. Dort wird sie in den Mitochondrien für die ATP-Synthese genutzt. ATP dient wiederum zwei verschiedenen Zwischenschritten, die die Freisetzung von Insulin ermöglichen. Zum einen kann ATP durch die Adenylatcyclase in cAMP umgewandelt werden. Dieses aktiviert die Proteinkinase A und ein Protein namens Epac2. Die Proteinkinase A aktiviert im Zellkern den Transkriptionsfaktor Pdx-1 der wiederum die Insulinsynthese steuert. Infolgedessen wird Insulin produziert. Das Protein Epac2 aktiviert die Ausschüttung von positiv geladenen Calcium-Ionen aus dem ER. Zum anderen hemmt ATP den Ausstrom positiv geladener Kaliumionen durch ATP-gesteuerte Kalium-Ionenkanäle. Es kommt zu einer Depolarisation des Zellinneren, was wiederum den Einstrom positiv geladener Calciumionen durch Calcium-Ionenkanäle fördert. Die durch beide Wege freigesetzten Calciumionen bewirken, dass mit Insulin gefüllte Vesikel mit der Cytoplasmamembran verschmelzen (Exocytose). Das entlassene Insulin kann anschließend in ein Blutgefäß diffundieren.
Vergleich der Ursache und Vorgänge bei der Insulinausschüttung mit der Transmitterfreisetzung in Synapsen:
Bei beiden Vorgängen kommt es zu einer Depolarisation. In Synapsen wird die Depolarisation vom ankommenden Aktionspotenzial (Einstrom positiv geladener Natriumionen) ausgelöst, in den β-Zellen wird die Depolarisation durch eine Blockade des Kaliumionen-Ausstroms hervorgerufen. In Folge der Depolarisation kommt es sowohl bei Synapsen als auch bei β-Zellen zum Öffnen spannungsabhängiger Calcium-Ionenkanäle. In der β-Zelle wird Calcium zusätzlich noch vom ER synthetisiert, in der Synapse findet nur ein Einstrom von außen statt. In beiden Fällen gibt es Vesikel, die mit der Cytoplasmamembran verschmelzen. Vesikel in Synapsen sind mit Neurotransmittern gefüllt, Vesikel in β-Zellen enthalten dagegen Insulin. Sowohl in der Synapse als auch in der β-Zelle führt die erhöhte Calciumionen-Konzentration zum Verschmelzen der Vesikel mit der Cytoplasmamembran (Exocytose).
4
Funktionsveränderung der β-Zellen bei einem Patienten mit fortgeschrittenem Diabetes Typ 2:
Bei Patienten, die an Diabetes Typ 2 erkrankt sind, ist die Anzahl der Insulinrezeptoren in den Zielorganen verringert. Außerdem ist im späteren Verlauf der Krankheit auch die Fähigkeit der β-Zellen, Insulin zu produzieren und auszuschütten, beeinträchtigt. Diese Beeinträchtigung kommt durch eine verringerte Aktivität der ATP-abhängigen Kalium-Ionenkanäle zustande. Vergleicht man die in Abbildung 5.1 und 5.2 dargestellten Kanalaktivitäten gesunder und erkrankter Personen, so wird deutlich, dass die Kanalaktivität im Ruhezustand bei erkrankten Personen geringer ist als bei gesunden Personen. Die Glucosezufuhr führt bei gesunden Personen zu einem starken Abfall der Kanalaktivität, bis hin zum vollständigen Schließen der Kanäle. Bei erkrankten Personen ist die Kanalaktivität im Vergleich zum Ruhezustand nur geringfügig herabgesetzt. Die Kanäle werden also nicht vollständig geschlossen. Die unterschiedliche Aktivität der Kalium-Ionenkanäle wirkt sich direkt auf das Membranpotenzial aus. Bei gesunden Personen liegt das Ruhepotenzial bei etwa – 80 mV. Dieser Wert kommt dadurch zustande, dass durch die vollständig geöffneten Ionenkanäle positiv geladene Kalium-Ionen ausströmen und eine negative Ladung des Zellinneren bewirken. Wird nun Glucose zugegeben, schließen die Kanäle, es kommt zu einer Erhöhung des Membranpotenzials und dadurch zu einer hochfrequenten Abfolge von Depolarisationen. Bei erkrankten Personen liegt das Ruhepotenzial bei etwa – 60 mV. Bei Diabetes Typ 2 sind die Kanäle nie komplett offen. Daher liegt auch das Ruhepotenzial höher als bei gesunden Menschen, und es kommt auch ohne Glucosezufuhr zu vereinzelten Depolarisationen. Bei Glucosezufuhr bewirkt die unvollständige Schließung der Kanäle eine vergleichsweise geringere Depolarisationsfrequenz. Die Ausschüttung von Insulin wird durch das Schließen der Kalium-Ionenkanäle und die damit einhergehenden hochfrequenten Depolarisationen hervorgerufen. Bei gesunden Personen ist im Ruhezustand keine Insulinausschüttung zu beobachten. Erst, wenn Glucose zugegeben wird, wird nach einer kurzen Reaktionszeit Insulin ausgeschüttet. Noch während der Depolarisationszeit flacht die Insulinausschüttung nach einem Peak von 200 % auf 100 % ab. Bei Personen mit Diabetes Typ 2 wird während des schon etwas erhöhten Membranpotenzials konstant eine Menge von etwa 30 % Insulin ausgeschüttet. Die Zufuhr von Glucose bewirkt eine langsame Erhöhung der Insulinfreisetzung auf etwa 50 %.
Die Versuchsergebnisse zeigen, dass die verringerte Aktivität der Kalium-Ionenkanäle das Membranpotenzial der β-Zellen erhöht. Dies führt schließlich zu einer geringeren Ausschüttung von Insulin.
5
Transkriptionsfaktoren:
Transkriptionsfaktoren sind für die Regulation der Transkription verantwortlich. Sie sind in der Lage, an spezielle DNA-Abschnitte (sogenannte DNA-Bindedomänen) im Promotorbereich von Genen zu binden, und dadurch zu steuern, wie viel mRNA (und somit auch Protein) gebildet wird. Die Faktoren können dabei die Transkription aktivieren oder hemmen.
Prinzip der DNA-Methylierung:
Die DNA-Methylierung beruht auf der Anlagerung von Methylgruppen an die Basen der DNA-Nukleotide. Die Modifikation wird durch Methyltransferasen katalysiert, meist werden dabei Cytosinbausteine methyliert. Die Basenabfolge der DNA wird durch die Methylierung nicht verändert. Die Modifikation bewirkt eine Verringerung der Transkriptionsrate, da sie die Affinität bestimmter Transkriptionsfaktoren für ihren Zielort hemmen kann. Es kommt zu einem Gen-Silencing.
6
Verringerte Biosynthese von Insulin bei Personen mit fortgeschrittenem Diabetes Typ 2:
Personen, die an Diabetes Typ 2 erkrankt sind, weisen eine verringerte Anzahl an Insulinrezeptoren auf. Auch die Funktion dieser Rezeptoren ist eingeschränkt. Wird nach einer kohlenhydratreichen Mahlzeit nur wenig Glucose in die Zellen aufgenommen, ist der Blutzuckerspiegel über einen längeren Zeitraum erhöht. In Abbildung 6.1 ist zu erkennen, dass der Grad der DNA-Methylierung steigt, je höher die mittlere Blutglucosekonzentration ist. Abbildung 6.2 ist zu entnehmen, dass die Menge der Pdx-1 mRNA umso geringer ist, je mehr DNA-methyliert ist. Der Methylierungsgrad korreliert also mit der Transkriptionsrate des Pdx-1-Gens. Ist der Pdx-1-Promotor stark methyliert, so kann das Gen nur noch geringfügig exprimiert werden. Daher ist in diesen Zellen weniger mRNA des Pdx-1-Gens zu finden. Gesunde Menschen haben eine geringere mittlere Blutglucosekonzentration, und bei ihnen ist weniger DNA Methyliert. Das resultiert in einer höheren Expression des Pdx-1-Gens in den β-Zelle, und es entsteht mehr des Transkriptionsfaktors Pdx-1. Der Transkriptionsfaktor wirkt aktivierend auf das Insulingen. Bei Personen mit Diabetes Typ 2 ist die Genexpression verringert. Folglich wird weniger Insulin in den β-Zellen von Patienten mit Diabetes Typ 2 produziert.
7
Zusammenfassung der Untersuchungsergebnisse:
Wird gesunden Personen Glucose oral oder intravenös verabreicht, so ist in beiden Fällen eine Erhöhung des Glucosewertes auf etwa 8 mmol/l nach ca. 30 Minuten zu beobachten. Etwa 180 Minuten nach der Glucosezufuhr ist die Blutglucosekonzentration wieder auf ihrem Ursprungswert angekommen. Die Messkurven der beiden Untersuchungsgruppen zeigen dabei kaum Unterschiede. Nach der Aufnahme von Glucose steigt auch der Insulinwert, mit einem Peak nach etwa 60 Minuten. Wird Glucose oral verabreicht, ist der Insulinspitzenwert mit etwa 70 mU/l jedoch deutlich höher als bei intravenöser Verabreichung mit etwa 20 mU/l. Bei beiden Verabreichungsformen ist nach 180 Minuten wieder der Ausgangswert erreicht.
Der Inkretin-Effekt:
Beide Einnahmeformen haben eine ähnliche Blutglucosekonzentration zur Folge. Die ins Blut abgegebene Insulinmenge ist jedoch sehr unterschiedlich. Die ausgeschüttete Insulinmenge kann daher nicht ausschließlich von dem absoluten Blutzuckerspiegel abhängen. Der Inkretin-Effekt bezeichnet die erhöhte Ausschüttung von Insulin bei einer oralen Zufuhr von Glucose im Vergleich zu einer intravenösen Verabreichung. Wird Glucose oral eingenommen, gelangt sie nicht direkt ins Blut, sondern wird zunächst vom Magen-Darm-Trakt aufgenommen. Die Aufnahme von Glucose ins Blut erfolgt über die Darmschleimhautzellen. Dabei wird das Hormon GLP-1 freigesetzt und auch ins Blut aufgenommen. Insulin wird nur von den β-Zellen der Bauchspeicheldrüse produziert. Daher muss das Hormon GLP-1 hier die Insulinausschüttung fördern.
8
Wirkung von Exenatid auf die Freisetzung von Insulin:
Exenatid ist ein Peptid aus dem Gift der Krustenechse. Es weist strukturelle Ähnlichkeiten mit dem humanen GLP-1 Protein auf, und ruft die gleiche zelluläre Wirkung hervor. Das liegt daran, dass Exenatid extrazellulär an den GLP-1-Rezeptor binden kann, der in der Zellmembran der β-Zellen liegt. Im Zellinneren löst sich die α-Untereinheit eines membrangebundenen G-Proteins. Das in der Membran integrierte Enzym Adenylatcyclase wird aktiviert, und katalysiert die Umsetzung von ATP zu cAMP. cAMP ist in der Lage, die Proteinkinase A zu aktivieren, die wiederum den Transkriptionsfaktor Pdx-1 aktiviert. Die Transkriptionsrate des Insulingens wird erhöht, und es wird mehr Insulin produziert. cAMP wirkt außerdem aktivierend auf Epac2, was zu einer verstärkten Freisetzung von Calcium-Ionen aus dem ER führt. Mehr mit Insulin gefüllte Vesikel verschmelzen mit der Cytoplasmamembran und es wird mehr Insulin ans Blut abgegeben.
9
Geringeres Risiko einer Hypoglykämie bei der therapeutischen Verwendung von GLP-1-Agonisten im Vergleich zur Eigenanwendung von Insulin:
Als Hypoglykämie wird ein lebensgefährlicher Abfall des Blutzuckerspiegels bezeichnet, der durch die Überdosierung von Insulin entstehen kann. Wie viel Insulin gespritzt werden muss, wird durch die Messung des Blutzuckerspiegels unter Berücksichtigung der aktuellen und geplanten Aufnahme von Nahrung von den Patienten selbst ermittelt. Fehlerhafte Messwerte, oder eine falsche Berechunung kann leicht zu einer Unter- oder Überdosierung, und damit zu einer lebensgefährlichen Situation führen. GLP-1-Agonisten sind Strukturanaloga zu humanem GLP-1. Sie binden direkt an die entsprechenden Rezeptoren der β-Zellen der Bauchspeicheldrüse und bewirken dort abhängig von der oral aufgenommenen Glucosemenge eine entsprechende Insulinausschüttung. Bei der Verstoffwechselung von Glucose in den Mitochondrien der β-Zellen kommt es zur ATP Synthese, welches nach Umwandlung in cAMP mehrere Prozesse in Gang setzt, die zur Ausschüttung von Insulin führen. Folglich können GLP-1-Agonisten nur wirksam werden, wenn ausreichend ATP vorhanden ist. Ist wenig Glucose und damit wenig ATP vorhanden, können GLP-1-Agonisten zwar an den Rezeptor binden, es kommt aber nicht zu einer ausreichenden Umwandlung von ATP zu cAMP, wodurch die Ausschüttung von Insulin gehemmt wird. Daher erfolgt nur bei einer hohen Blutglucosekonzentration eine bedarfsgerechte Ausschüttung von Insulin. Bei einem niedrigen Blutzuckerspiegel, bei dem auch kein Insulin benötigt wird, wirken die GLP-1-Agonisten nicht. Das Risiko einer Hypoglykämie ist verringert.