Vorschlag B – Pflanzliche Neurotoxine
Wehrhafte Pflanzen
Verschiedene Pflanzen bilden Brennhaare aus, die abbrechen, wenn sie berührt werden. Dadurch gelangen Substanzen in die Haut, die zu Brennen, Schmerzen und Juckreiz führen. Die Wirkung einer dieser Substanzen auf spannungsgesteuerte Natrium-Ionenkanäle in sensorischen Neuronen wurde untersucht.Außerdem wurde erforscht, ob die Eigenschaften von Brennnesseln von der Anzahl der Pflanzenfresser in ihrem Verbreitungsgebiet abhängen.
Genetik pflanzlicher Neurotoxine
1
Fasse die wesentlichen Schritte des Wegs vom Gen zum Protein bei Eukaryoten in Stichworten zusammen. Gib für die Aminosäuren 8 bis 10 von ExTxA eine mögliche Basensequenz der mRNA und des codogenen Strangs der DNA an, jeweils mit Angabe der Richtung. (Material 1 und Code-Sonne der mRNA)
(11 BE)
Wirkungsweise pflanzlicher Neurotoxine
2
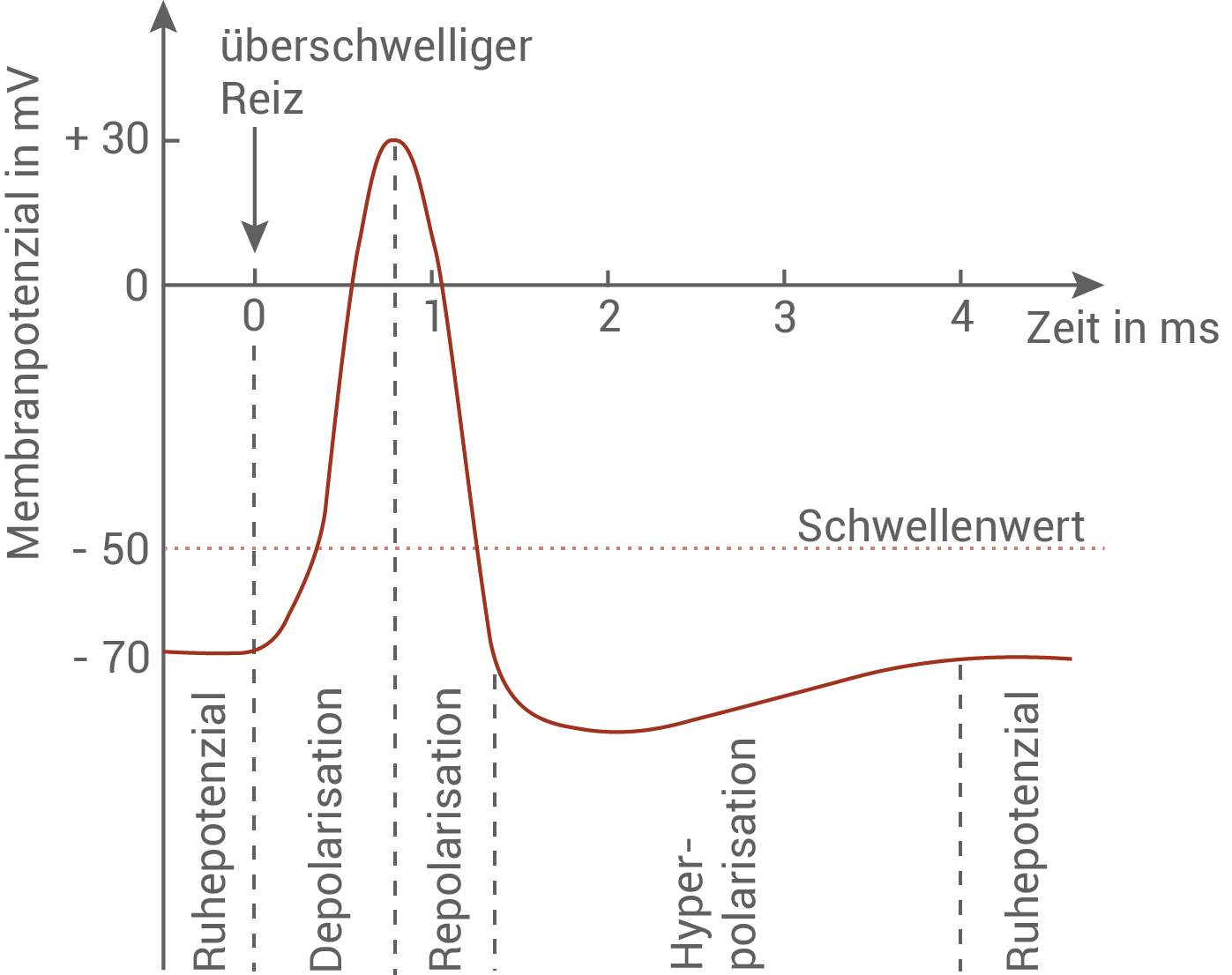
Zeichne ein beschriftetes Diagramm, das den Verlauf eines Aktionspotenzials zeigt, und beschreibe die zugrunde liegenden Vorgänge an der Axonmembran. Erläutere die in der Abbildung in Material 2 dargestellten Zustände eines spannungsabhängigen Natrium-Ionenkanals im Zusammenhang mit den Vorgängen während des Ruhe- bzw. Aktionspotenzials. (Material 2)
(21 BE)
3
Werte die in Material 3 dargestellten Versuchsergebnisse im Zusammenhang miteinander aus. (Material 1 und 3)
(7 BE)
4
Deute die Versuchsergebnisse zum Natrium-Ioneneinstrom in Material 4 und entwickle eine Hypothese zur molekularen Wirkung von ExTxA im Zusammenhang mit Material 2. (Material 2 und 4)
(14 BE)
5
Deute die in Abbildung 5.1 dargestellten Versuchsergebnisse im Zusammenhang mit Abbildung 5.2. (Material 4 und 5 )
(6 BE)
6
Diskutiere die Eignung von Tetrodotoxin (TTX) zur Therapie der Symptome nach Kontakt mit Blättern von Dendrocnide excelsa. (Material 1, 3, 4 und 5)
(8 BE)
Anpassungen von Pflanzen an biotische Ökofaktoren
7
Benenne die in der Abbildung in Material 6 mit Ziffern bezeichneten Strukturen des Laubblatts und gib für jede nummerierte Struktur eine Funktion an. (Material 6)
(9 BE)
8
Deute die in Material 7 dargestellten Versuchsergebnisse. (Material 7)
(12 BE)
9
Deute die in Material 8 dargestellten Versuchsergebnisse im Hinblick auf die Fitness der Pflanzen anhand einer Kosten-Nutzen-Analyse. (Material 8)
(12 BE)
(100 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1
"Stinging trees": Stechende Bäume
In den Wäldern im Osten Australiens kommen „stinging trees“ vor, die mit den in Europa wachsenden Brennnesseln verwandt sind. Blätter und Stängel des Baums Dendrocnide excelsa sind mit bis zu 7 mm langen, sehr dünnen, mit Flüssigkeit gefüllten Brennhaaren bedeckt, die sich bei Berührung ablösen und die Haut durchdringen. Dadurch wird der Inhalt der Brennhaare in die Haut injiziert. Sogar ein sehr kurzer Kontakt mit einem Blatt löst einen unerträglichen Schmerz aus, dessen Höhepunkt nach 20 bis 30 Minuten erreicht ist und der bis zu vier Stunden andauern kann. Die Brennhaare können mehrere Monate in der Haut verbleiben. Deshalb kehrt der Schmerz zurück, sobald man auf die Haut drückt. Die Brennhaare von Dendrocnide excelsa enthalten zahlreiche Substanzen, die in europäischen und asiatischen Brennnesseln ebenfalls vorkommen. Die extremen Schmerzen lassen sich aber dadurch nicht erklären. Forscher haben nun in den Brennhaaren ein kurzes Protein, genannt ExTxA, mit einer Länge von 36 Aminosäuren entdeckt, das bisher nicht bekannt war.Ausschnitt aus der Aminosäuresequenz von ExTxA

Material 2
Struktur und Funktion spannungsabhängiger Natrium-Ionenkanäle
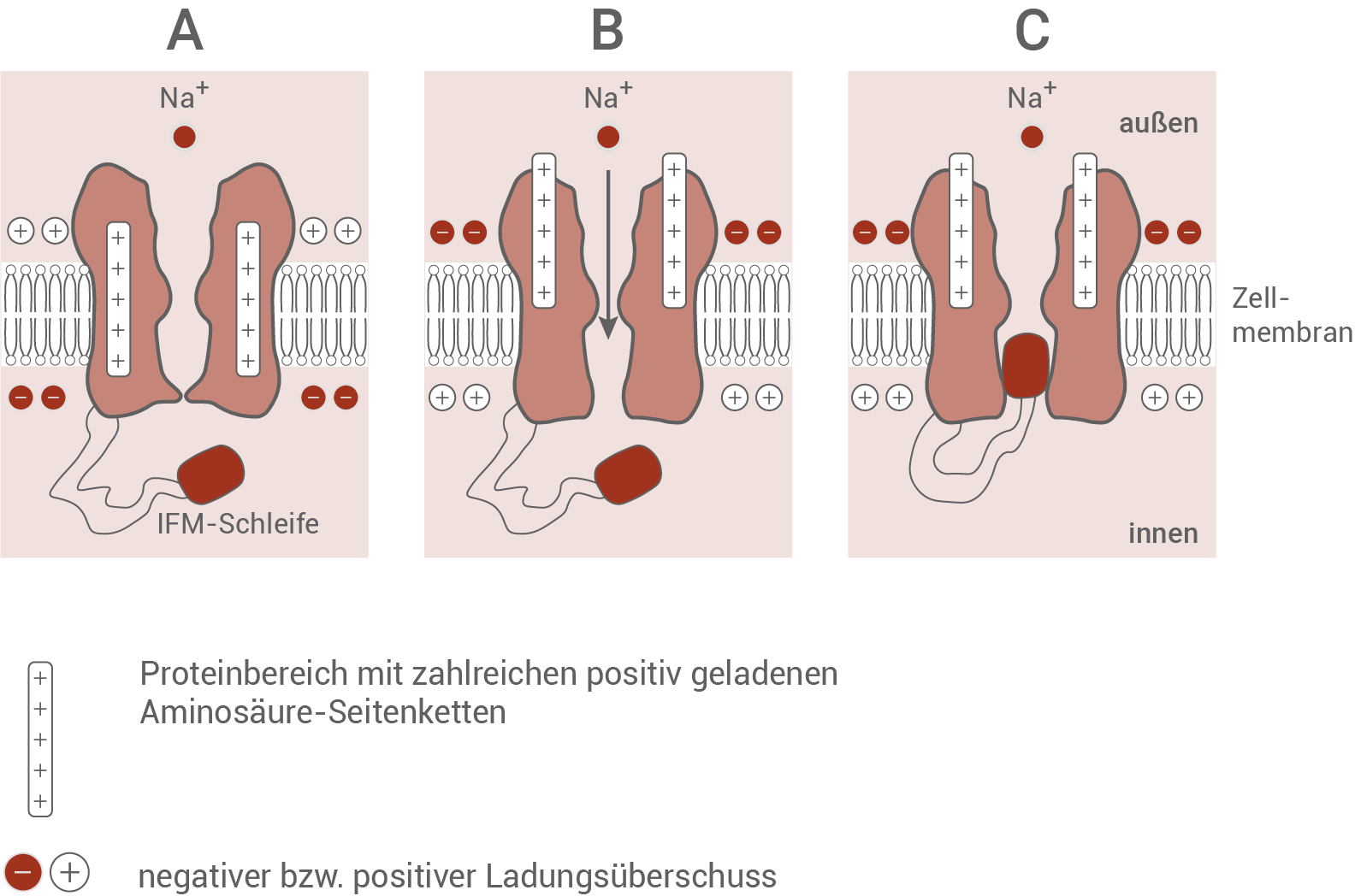
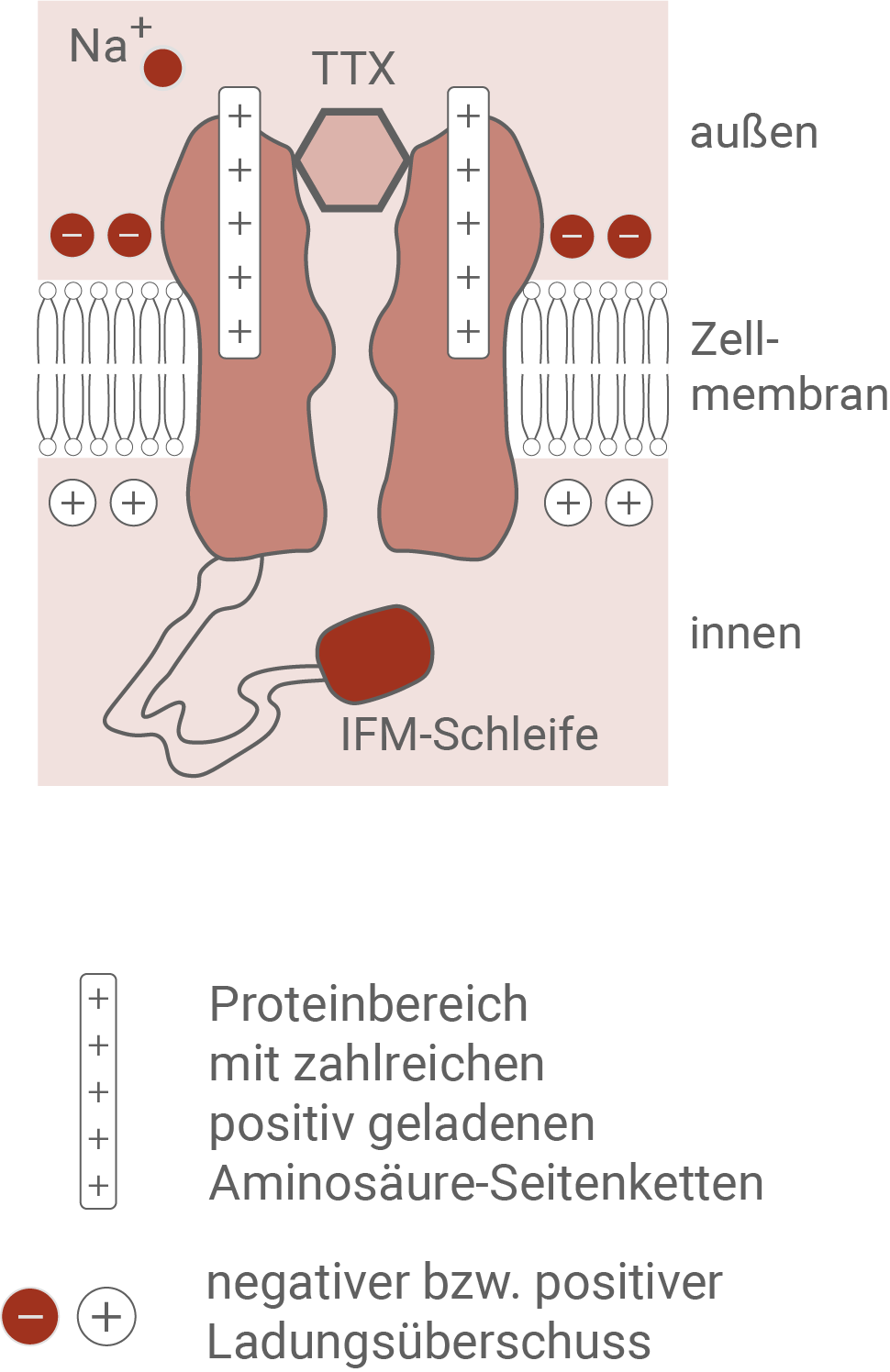
Die spannungsabhängigen Natrium-Ionenkanäle aller Neuronen werden von Membranproteinen gebildet, die aus ca. 2000 Aminosäuren bestehen. Das Kanalprotein enthält mehrere Bereiche mit zahlreichen positiv geladenen Aminosäure-Seitenketten und besitzt auf der Membraninnenseite eine charakteristische Struktur, die als IFM-Schleife bezeichnet wird.Modell der Zustände eines spannungsabhängigen Natrium-Ionenkanals während des Ruhe- bzw. Aktionspotenzials
Material 3
Wirkung von ExTxA auf Mäuse
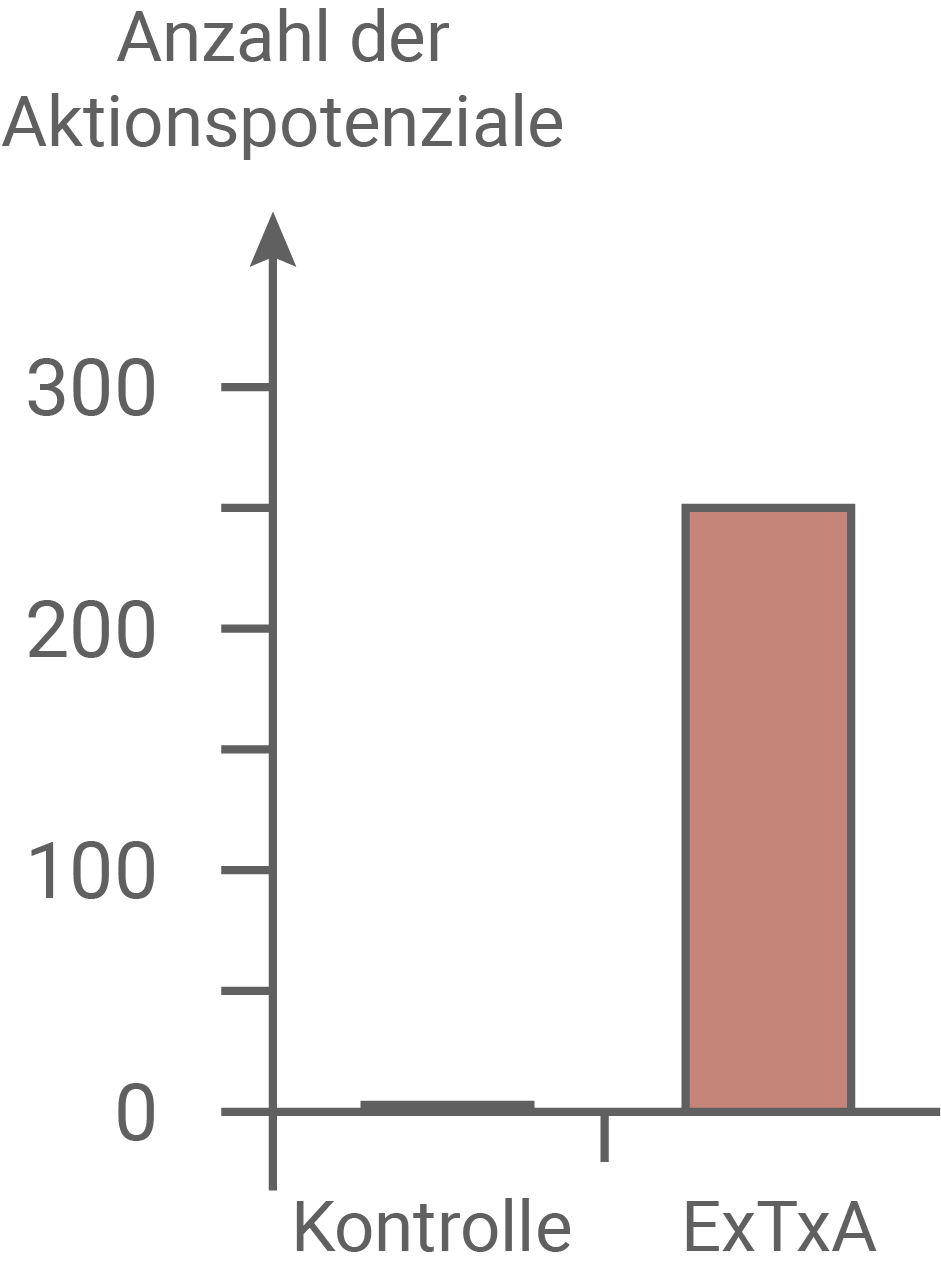
Schmerzhafte Reize in der Haut werden von spezialisierten sensorischen Nervenzellen registriert. Freie Nervenendigungen dieser Neuronen, die sogenannten Nozizeptoren, nehmen mechanische Reize, z. B. Stiche, oder chemische Reize auf. Die entstehenden Erregungen werden zunächst zum Zellkörper des sensorischen Neurons weitergeleitet, der sich in der Nähe des Rückenmarks befindet. Schließlich gelangen sie über das Rückenmark zum Gehirn, wo die Schmerzempfindung entsteht. Um zu überprüfen, ob das in den Brennhaaren von Dendrocnide excelsa gefundene Protein ExTxA für die extrem schmerzhafte Wirkung der Pflanzen verantwortlich ist, wurden zunächst die folgenden Experimente durchgeführt:Lösungen der reinen Substanz ExTxA in verschiedenen Konzentrationen wurden Mäusen in eine Hinterpfote injiziert. Die verwendeten Substanzmengen waren geringer als der Gehalt der jeweiligen Stoffe in einem einzigen Brennhaar der Pflanzen. Die Kontrollgruppe bekam eine Injektion der gleichen Menge physiologischer Kochsalzlösung. Es wurde anschließend eine Stunde lang beobachtet, wie oft die Mäuse in einem Zeitintervall von jeweils 10 Minuten ein Verhalten zeigten, das auf eine Schmerzempfindung in der betroffenen Pfote schließen ließ, z. B. Hochheben der Pfote, Schütteln, Lecken etc. (Abbildung 3.1). In einem weiteren Experiment wurde ExTxA auf die Haut aufgebracht und anschließend 5 Minuten lang in den Axonen der sensorischen Neuronen die Zahl der Aktionspotenziale gemessen (Abbildung 3.2).
Abb. 3.1: Schmerzreaktion nach Injektion von ExTxA
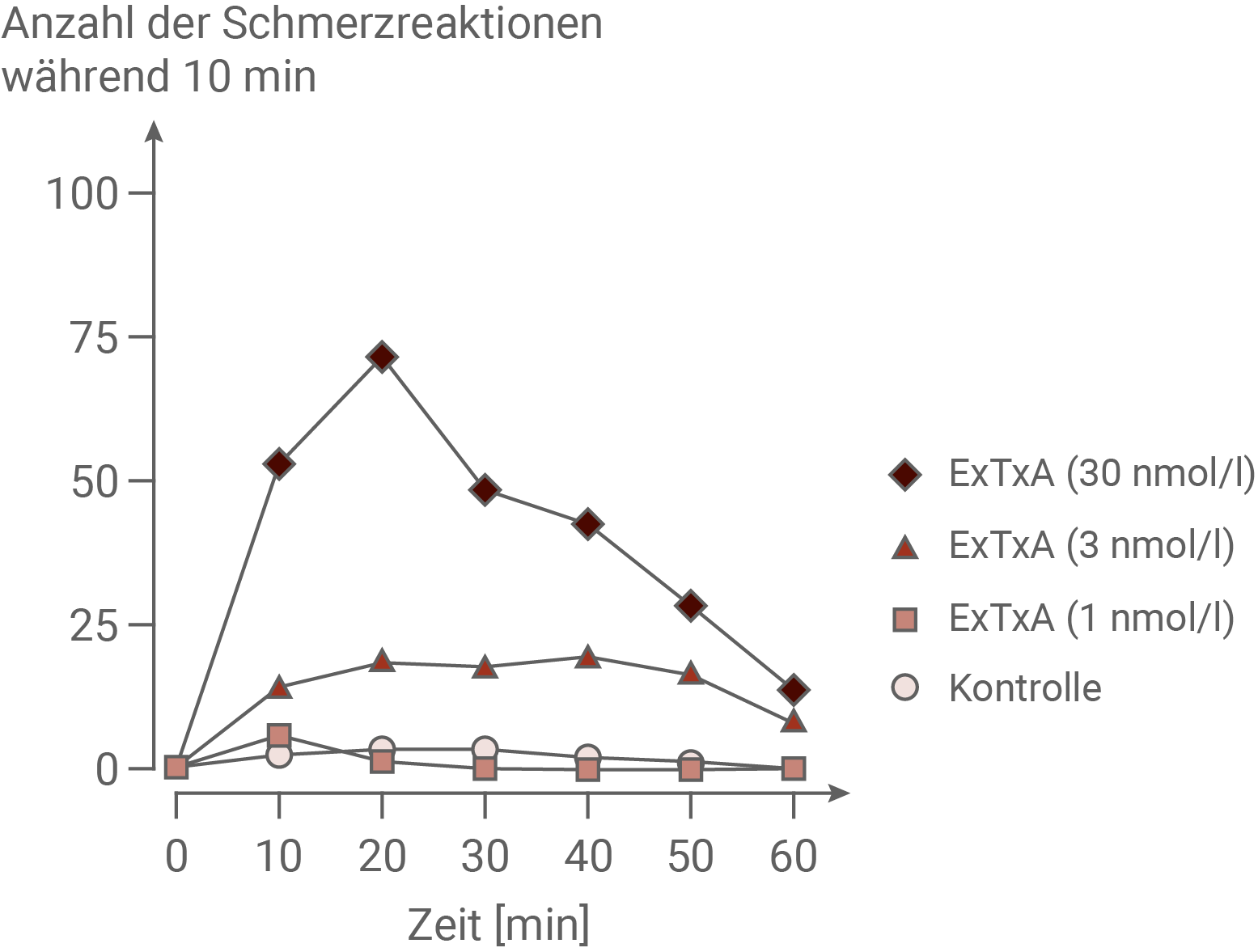
Abb. 3.2: Aktionspotenziale in sensorischen Axonen
Material 4
Wirkung von ExTxA auf spannungsabhängige Natrium-Ionenkanäle
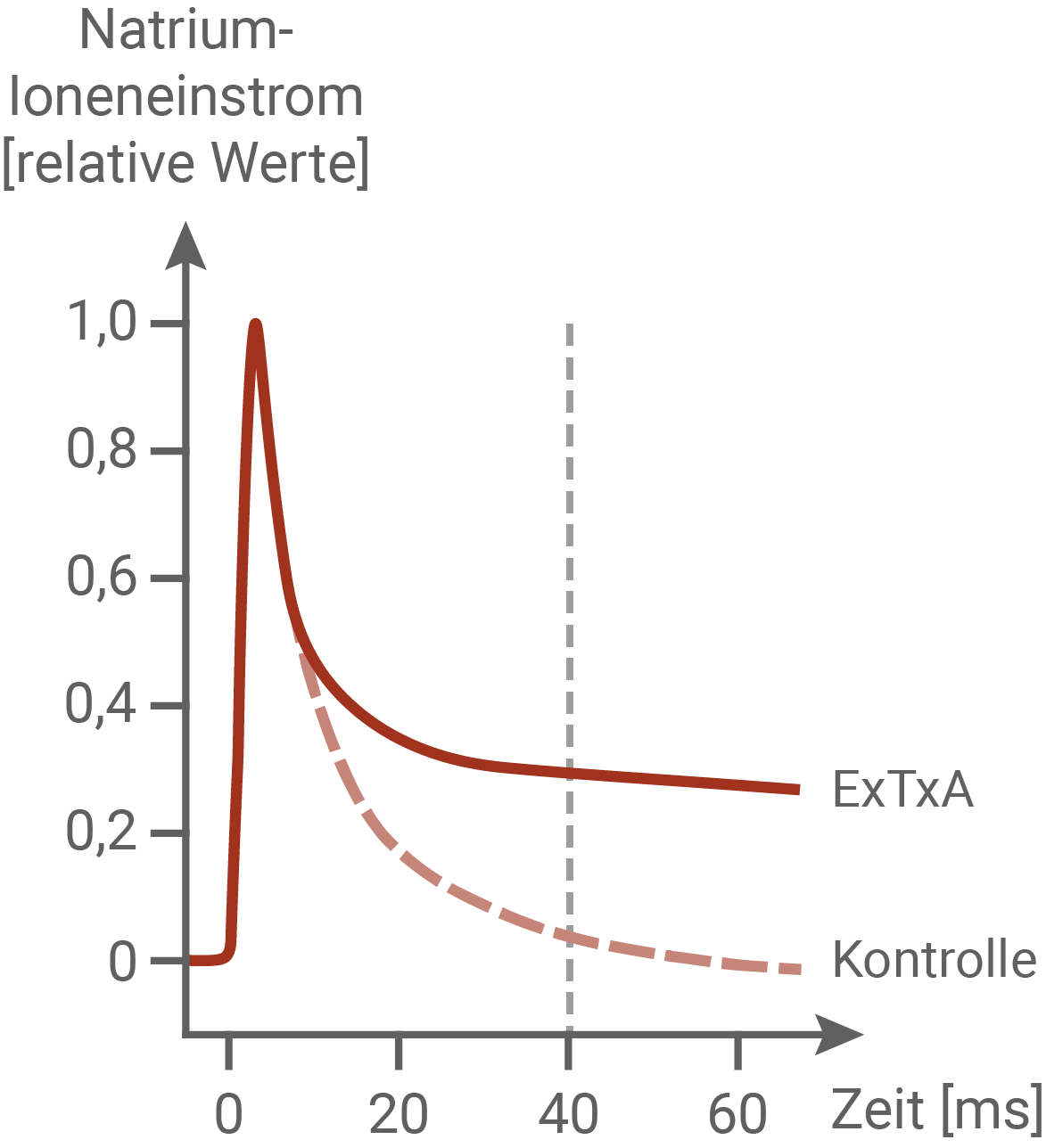
Für die Schmerzleitung verantwortliche sensorische Neuronen von Mäusen wurden isoliert und in einer Nährlösung kultiviert. Mithilfe einer speziellen Untersuchungstechnik wurde an diesen Zellen die Reaktion der Natrium-Ionenkanäle auf eine Potenzialänderung gemessen. Ausgehend von -80 mV wurde das Membranpotenzial ab dem Zeitpunkt 0 für den gesamten Messzeitraum auf -10 mV depolarisiert und der Verlauf des dadurch hervorgerufenen Natrium-Ioneneinstroms registriert. Die Abbildung zeigt den Zeitverlauf des Natrium-Ioneneinstroms bei einem Neuron in einer Lösung, die ExTxA in einer Konzentration von 50 nmol/l enthielt, sowie bei einem Neuron in einer Lösung ohne ExTxA (Kontrolle).Verlauf des Natrium-Ioneneinstroms nach Depolarisation
Material 5
Prüfung von Maßnahmen gegen die Wirkung von ExTxA
Als mögliche Maßnahmen gegen die Wirkung von ExTxA wurden ausführliches Waschen und die Substanz Tetrodotoxin (TTX) getestet. TTX ist eines der stärksten bekannten Gifte. Es kommt u. a. in Kugelfischen, wie z. B. dem in Japan als Delikatesse geltenden Fugu, vor. Beim Menschen bewirkt TTX abhängig von der Dosis Wahrnehmungs- und Koordinationsstörungen sowie Lähmungserscheinungen. Bereits eine Dosis von 0,5 bis 1 mg führt zum Tod durch Atemlähmung. TTX kann durch den Verdauungstrakt, über die Haut oder die Lunge aufgenommen werden. TTX ist kein Protein, es hat eine völlig andere Struktur als ExTxA. Um die Wirkung der möglichen Gegenmaßnahmen zu prüfen, wurde der Natrium-Ioneneinstrom an sensorischen Neuronen der Schmerzbahn in weiteren Experimenten mit der in Material 4 beschriebenen Versuchstechnik untersucht. Ausgehend von einem Membranpotenzial von -80 mV wurde die Membran für 100 ms auf -10 mV depolarisiert. Dieses Vorgehen wurde alle 30 s wiederholt. Der Verlauf des dadurch hervorgerufenen Natrium-Ioneneinstroms wurde gemessen. Abbildung 5.1 zeigt jeweils den Natrium-Ioneneinstrom 40 ms nach dem Beginn der Depolarisation. Die Neuronen wurden zunächst in einer Lösung ohne ExTxA untersucht. Nach einigen Minuten wurde ExTxA (Konzentration 1 μmol/l) hinzugegeben. In regelmäßigen Zeitabständen wurde frische Lösung ohne ExTxA hinzugegeben (= "waschen"). Nach 70 Einzelmessungen wurde zu den Neuronen eine Lösung mit TTX (Konzentration 1 μmol/l) hinzugegeben. Abbildung 5.2 zeigt ein Modell der Wirkung von TTX auf spannungsabhängige Natrium-Ionenkanäle.Abb. 5.1: Einfluss von Waschvorgängen und TTX auf die Wirkung von ExTxA
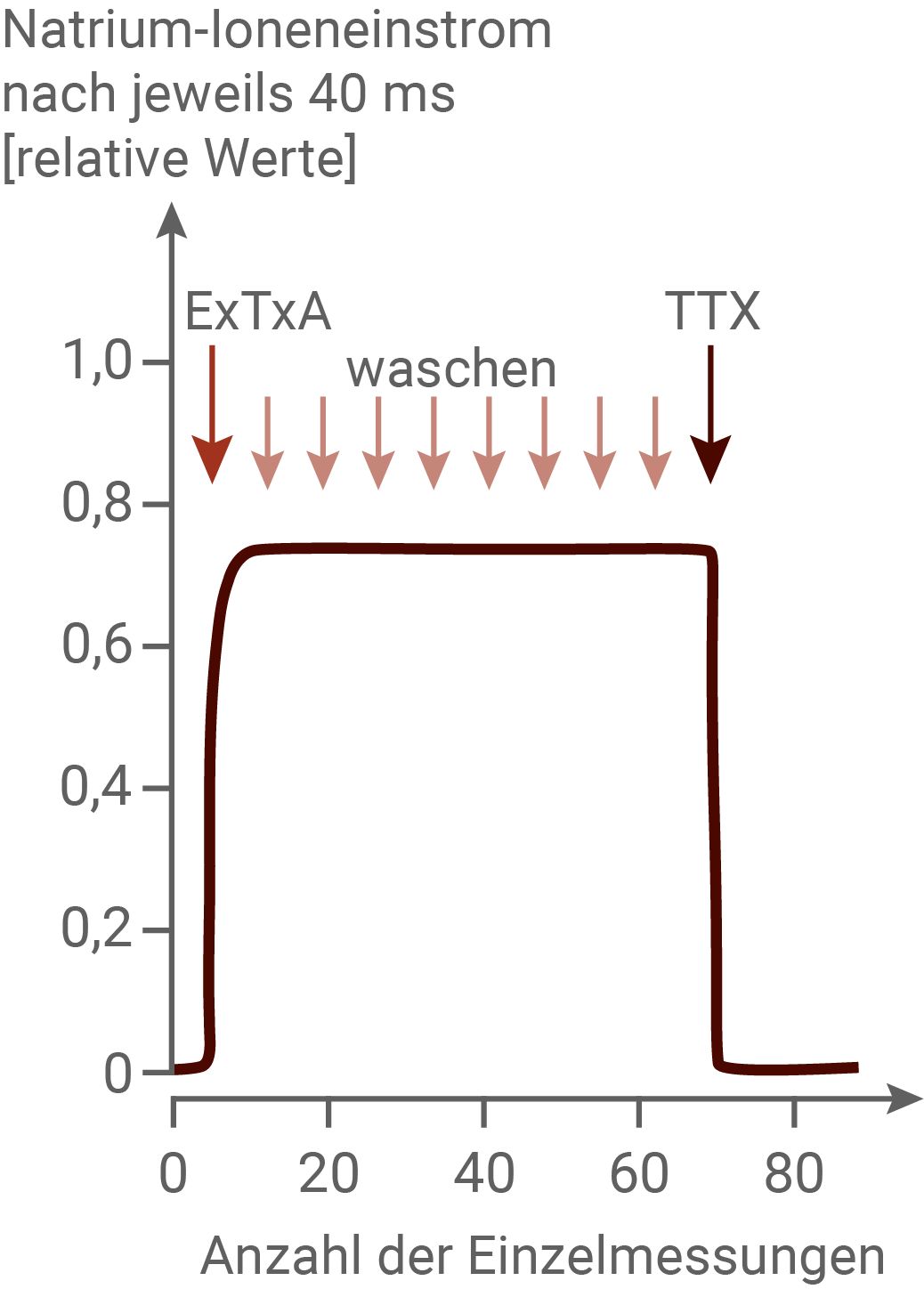
Abb. 5.2: Modell der Wirkung von TTX auf spannungsabhängige Natrium-Ionenkanäle
Material 6
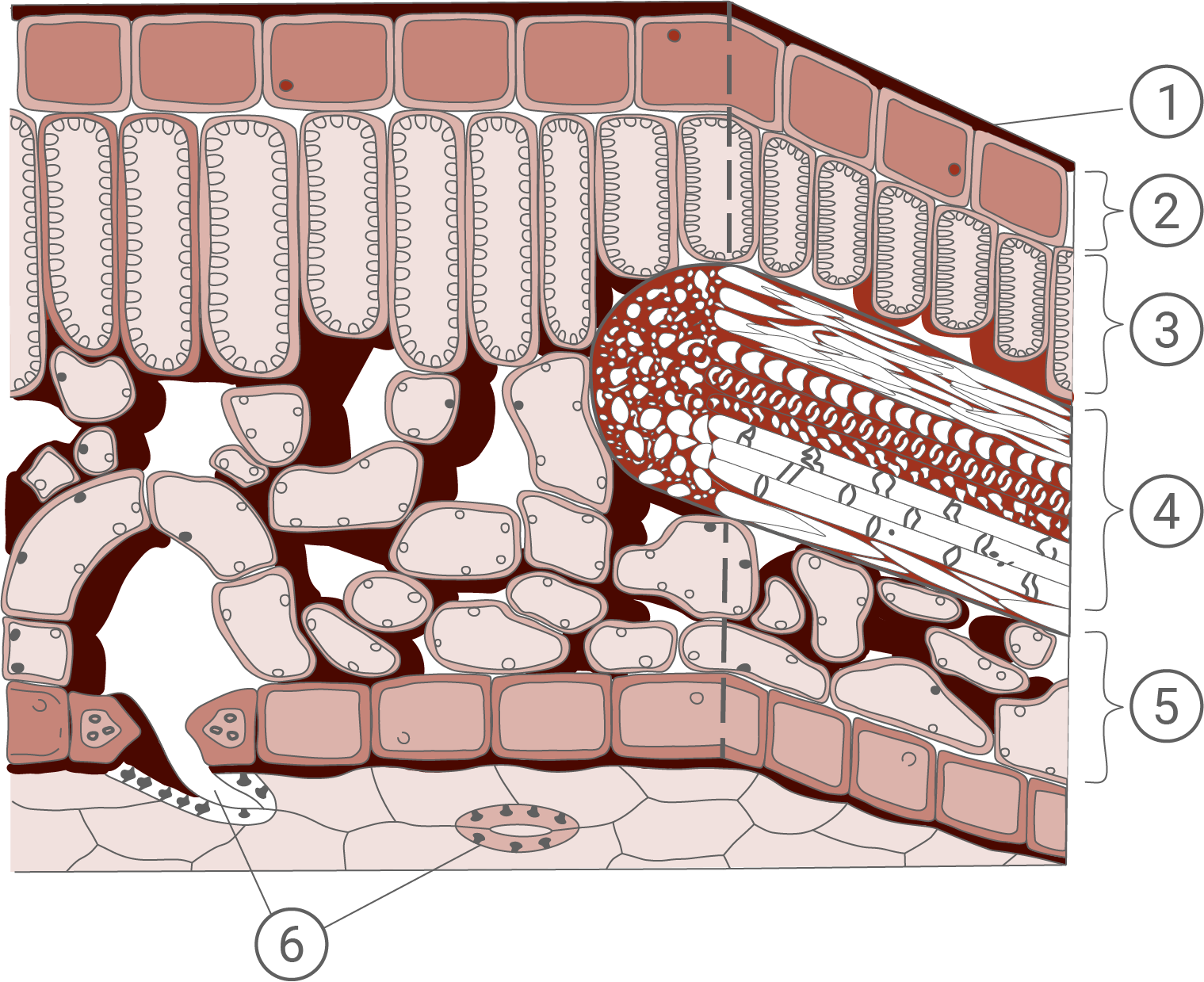
Aufbau eines Laubblatts (Schema)
Material 7
Ökologie von japanischen Brennnesseln
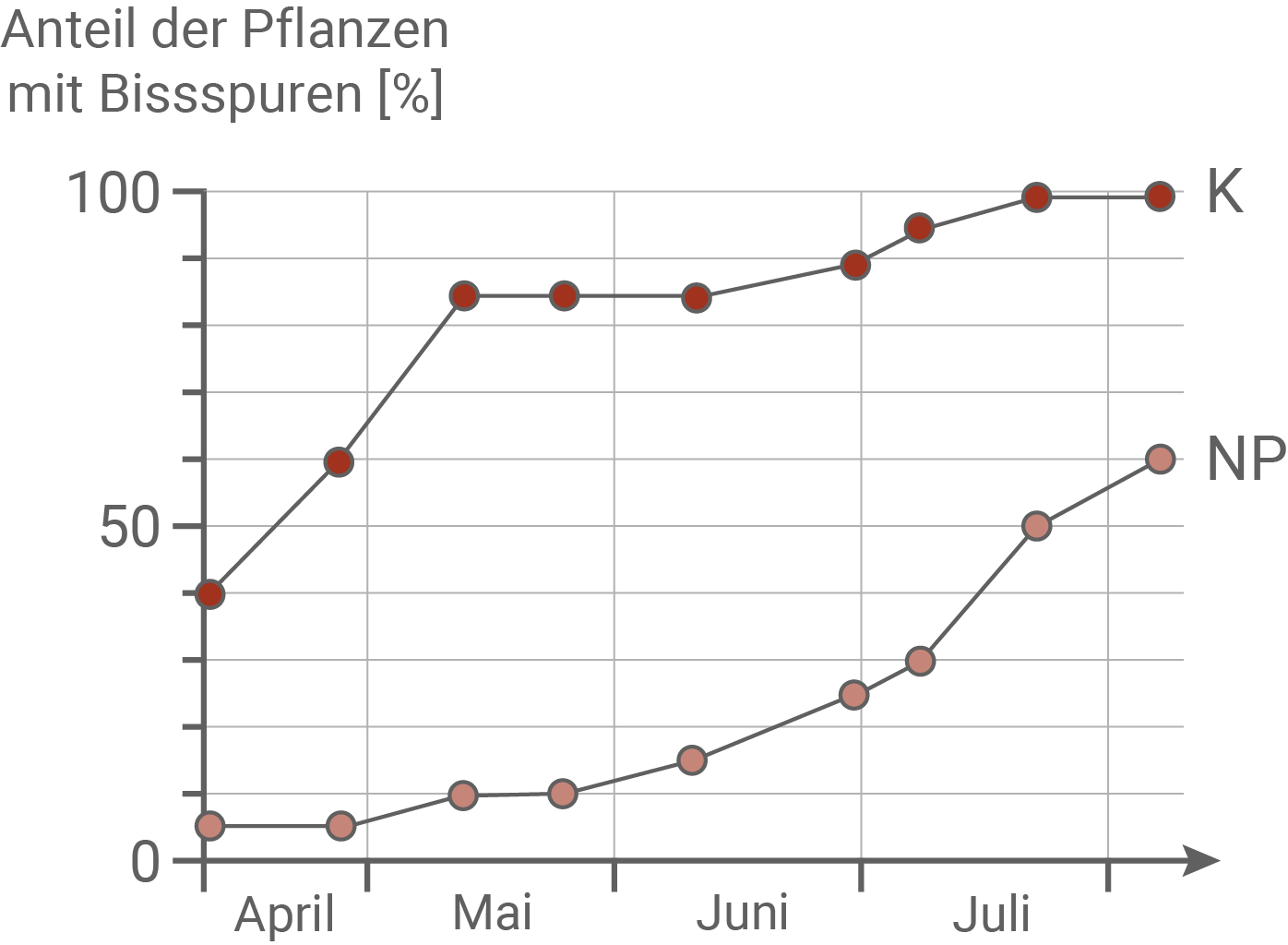
In Japan wächst eine Brennnesselart (Urtica thunbergiana), die der europäischen Brennnessel sehr ähnelt. Die japanischen Brennnesseln sind mehrjährige Pflanzen, die bis zu 80 cm hoch werden können. Sie blühen zwischen Juli und September, die Samen reifen zwischen August und Oktober. Auf Blättern und Stängeln der Pflanzen sind etwa 1 mm lange Brennhaare zu finden, die die gleichen Inhaltsstoffe enthalten wie bei der europäischen Art und bei Berührung dieselbe Wirkung, einen brennenden Juckreiz, hervorrufen. An der Universität Nara wurden Brennnessel-Populationen an verschiedenen Standorten untersucht. Im Nara-Park in der Nähe der Stadt wurde im 8. Jahrhundert ein Tempelbezirk angelegt. Seitdem existiert dort eine extrem dichte Population von Sika-Hirschen, die als heilige Tiere verehrt werden. Die Biologinnen und Biologen verglichen Brennnesseln aus diesem Park mit Brennnesseln aus verschiedenen Gebieten ohne Sika-Hirsche. Andere Pflanzenfresser kommen in diesen Gebieten nur in geringer Zahl vor. Das Team führte einen Verpflanzungsversuch durch: Im April wurden junge Pflanzen aus dem Nara-Park (NP) sowie aus einem anderen Gebiet als Kontrolle (K), wo es keine Sika-Hirsche gibt, ausgegraben und auf Versuchsflächen im Nara-Park ausgepflanzt, zu denen die Sika-Hirsche Zutritt hatten. Die Forschenden beobachteten über mehrere Monate, wie viele der Pflanzen Bissspuren der Hirsche zeigten und wie viele bis zum nächsten Frühjahr überlebten (Abbildung 7.1). Außerdem wurde die Dichte der Brennhaare auf den Blättern von Brennnesseln im Nara-Park (NP) und an mehreren Standorten ohne Sika-Hirsche als Kontrolle (K) im Herbst bestimmt (Abbildung 7.2). An den untersuchten Standorten wurden Samen der Brennnesseln gesammelt. Im nächsten Frühjahr wurden die Samen im Gewächshaus ausgesät. Die entstandenen Pflanzen wurden bis zum Herbst kultiviert und dann wiederum die Dichte der Brennhaare auf den Blättern bestimmt (Abbildung 7.3). Die im Gewächshaus verwendete Düngerlösung für die Pflanzen enthielt eine höhere Konzentration an Mineralstoffen als der Boden an den ursprünglichen Standorten.Abb. 7.1: Verpflanzungsversuch
A
B
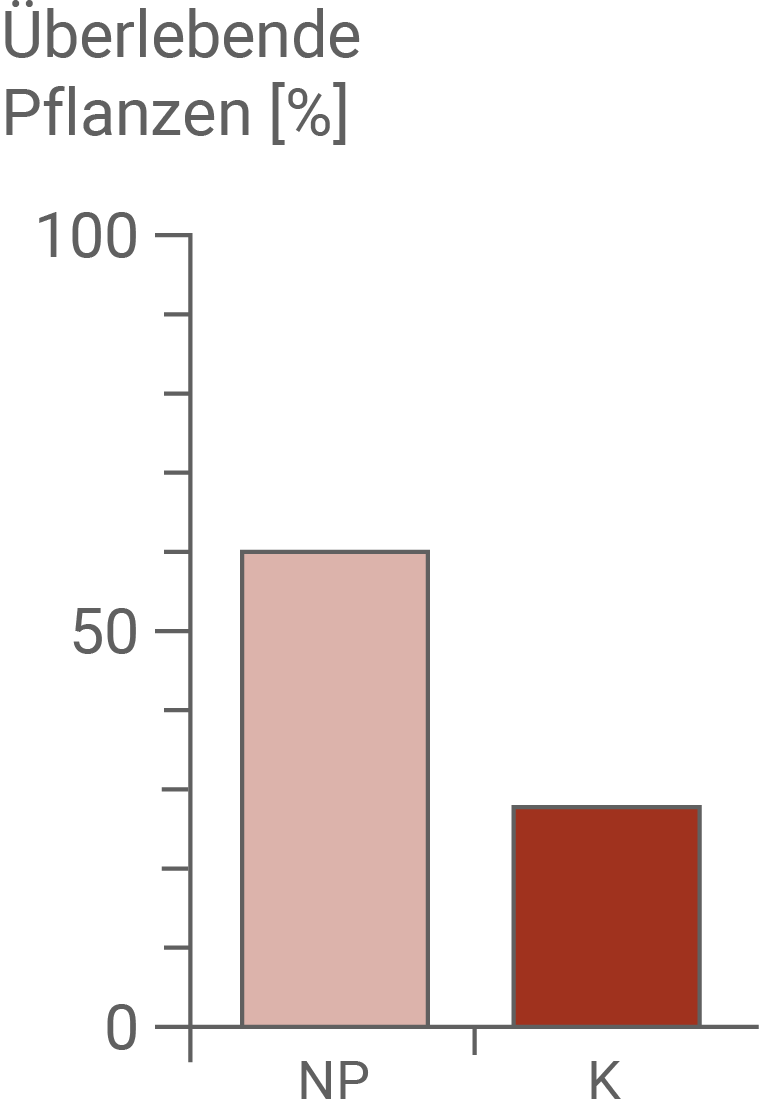
Abb. 7.2: Dichte der Brennhaare im Freiland
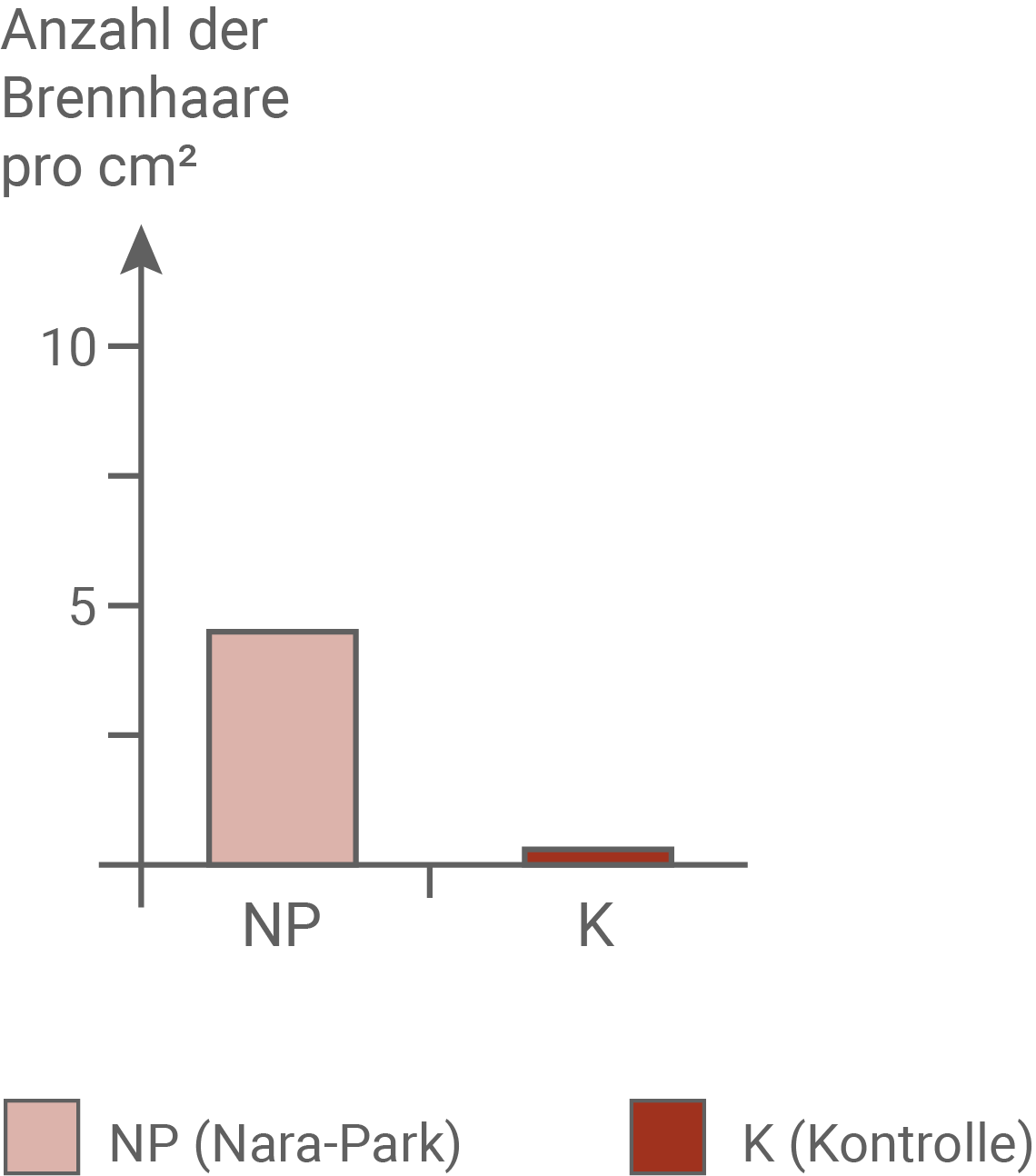
Abb. 7.3: Dichte der Brennhaare bei Anzucht aus Samen in Gewächshauskultur
Material 8
Eigenschaften von japanischen Brennnesseln in Gewächshauskultur
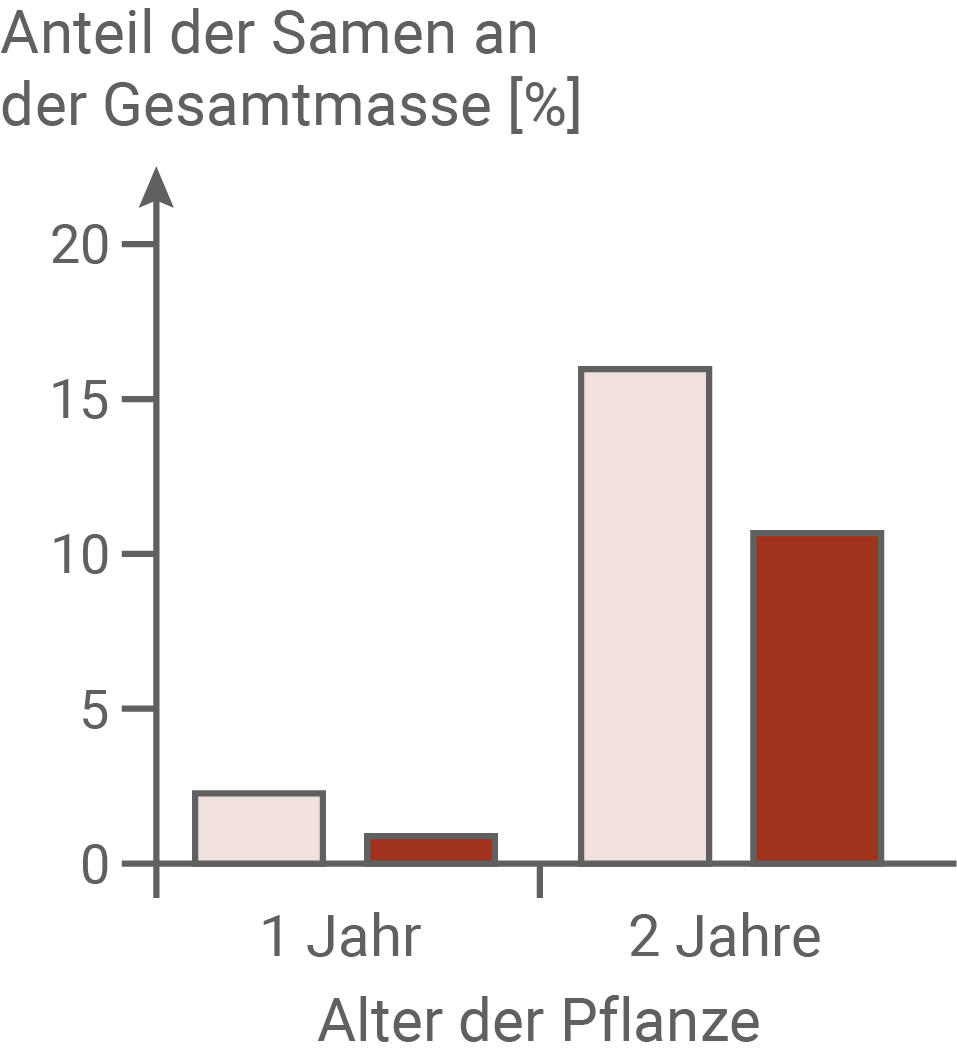
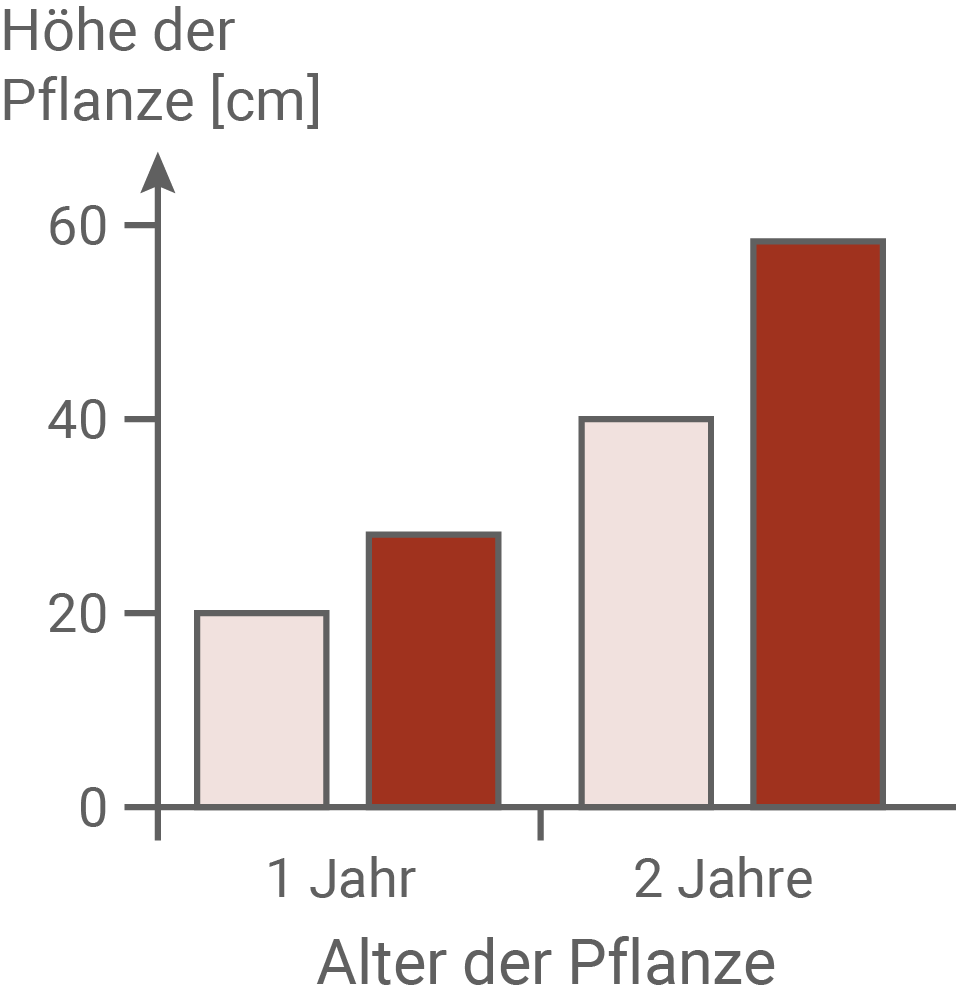
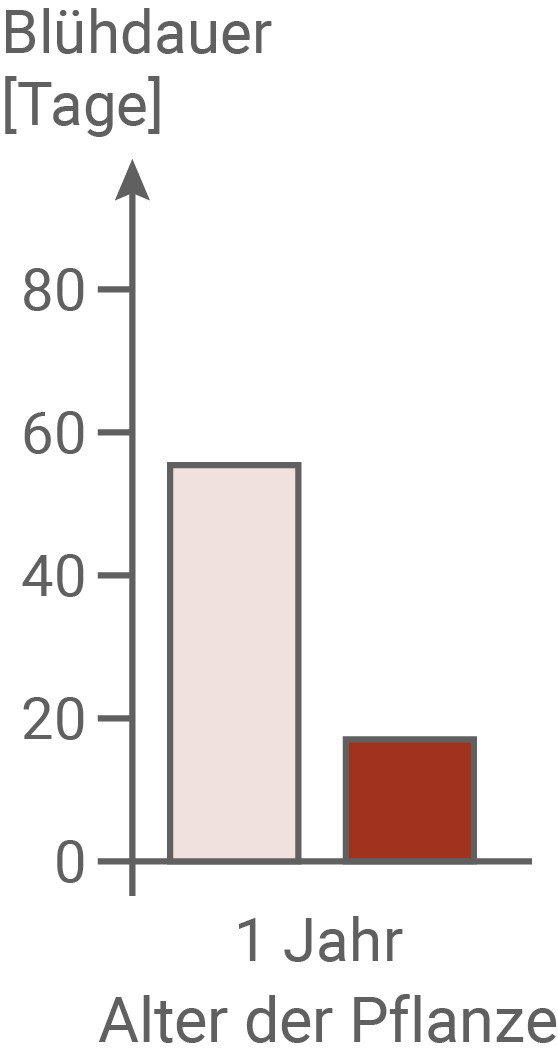
Im April wurden im mit Sika-Hirschen dicht besiedelten Nara-Park (NP) und an einem Standort ohne Sika-Hirsche (K) Keimlinge von Brennnesseln ausgegraben und im Gewächshaus über zwei Jahre weiter kultiviert. Im Herbst des ersten und des zweiten Jahres wurden die Zahl der Brennhaare pro Blatt und die Höhe der Pflanzen bestimmt. Außerdem wurde der Anteil der Samen an der Gesamtmasse der Pflanzen ermittelt. Zusätzlich wurde im ersten Jahr die Blühdauer protokolliert.Eigenschaften von Brennnesseln in Gewächshauskultur
A
C
B
D

Code-Sonne der mRNA

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.
Vom Gen zum Protein:
- Transkription: Synthese der einzelsträngigen prä-mRNA durch Ablesen des codogenen Strangs der DNA im Zellkern.
- Prozessierung: Capping der prä-mRNA am 5'-Ende, und Anfügen eines Poly-A-Schwanzes am 3'-Ende. Die nicht-codierenden Passagen (Introns) werden aus der prä-mRNA herausgeschnitten, und die codierenden Passagen (Exons) aneinandergefügt. Es liegt nun eine reife mRNA vor, die ins Cytoplasma wandert.
- Translation: Proteinbiosynthese durch Ablesen der mRNA an den Ribosomen. Dabei wird auf der mRNA ein Startcodon ausfindig gemacht, wo die Synthese startet. Mit Aminosäuren beladene tRNAs binden komplementär an je ein Basentriplett der mRNA. Die Aminosäuren werden zu einer Polypeptidkette verknüpft und nach Erreichen des Stoppcodons ins Cytoplasma abgegeben, wo diese die Konformation des fertigen Proteins einnimmt.
| Position | 8 | 9 | 10 | ||
|---|---|---|---|---|---|
| Aminosäure | Phe | Cys | Ser | ||
| mRNA | 5'... | UUC | UGU | AGC | ... 3' |
| codogener DNA-Strang | 3'... | AAG | ACA | TCG | ... 5' |
2.
Verlauf eines Aktionspotenzials:
 Vorgänge an der Axonmembran:
Vorgänge an der Axonmembran:

- Depolarisation: Bei Reizung einer Nervenzelle öffnen sich anfangs wenige Natriumionenkanäle. Durch den Einstrom der Natriumionen ins Zellinnere wird die Spannung im Zellinneren von -70 mV auf -50 mV angehoben. Das Überschreiten dieses Schwellenwertes löst die Öffnung weiterer Natriumionenkanäle, und damit das Aktionspotenzial aus. Der starke Einstrom der Natriumionen führt zu einer Depolarisation des Membranpotenzials auf +30 mV.
- Repolarisation: Die spannungsabhängigen Natriumionenkanäle schließen, es strömen also keine weiteren Natriumionen ins Zellinnere. Etwas zeitversetzt öffnen Kaliumionenkanäle, durch die Kaliumionen aus der Zelle herausströmen. Es kann so eine erneute Ladungsumkehr (die Repolarisation) erzielt werden. Die Membranaußenseite ist nun wieder positiv, und die Membraninnenseite negativ geladen.
- Hyperpolarisation: Da die Kaliumionenkanäle nicht sofort schließen, wenn das Ruhepotenzial erreicht ist, strömen noch weitere Kaliumionen aus der Zelle aus, sodass ein Membranpotenzial von ca. - 90 mV erreicht wird. Die Kaliumionenkanäle schließen nun, und das Ruhepotenzial wird wieder eingestellt. Dies geschieht durch die Natrium-Kalium-Pumpe, die unter ATP-Verbrauch drei Natriumionen aus der Zelle heraus, und zwei Kaliumionen in die Zelle hinein pumpt.
- Zustand A: Die Membraninnenseite ist negativ, und die Membranaußenseite positiv geladen. Natriumionen befinden sich auf der Membranaußenseite und können den Kanal nicht passieren, da er verschlossen ist. Der Bereich der positiv geladenen Aminosäure-Seitenketten befindet sich mittig im Kanal. Die IFM-Schleife liegt so im Cytoplasma, dass sie den Kanal nicht blockiert.
Dieser Zustand zeigt den Natrium-Ionenkanal während des Ruhepotenzials. Das Auslösen eines Aktionspotenzials ist damit möglich.
- Zustand B: In diesem Zustand hat eine Ladungsumkehr stattgefunden, sodass die Membraninnenseite positiv und die Membranaußenseite negativ geladen ist. Dadurch werden die positiven Aminosäure-Seitenketten nicht mehr durch die negativ geladene Membraninnenseite angezogen, und wandern in Richtung Membranaußenseite. Dies löst eine Konformationsänderung aus, die für die Öffnung des Kanals sorgt. Natriumionen können so entlang ihres Konzentrationsgefälles ins Axoninnere diffundieren. Die IFM-Schleife versperrt den Kanal dabei nicht.
Dieser Zustand zeigt die Phase der Depolarisation, in der Natriumionen in das Zellinnere einströmen.
- Zustand C: Die Konformation des Natrium-Ionenkanals und die Ladungsverteilung der Membran entspricht Zustand B. Allerdings wird der Kanal durch die IFM-Schleife blockiert. Es können dadurch keine Natriumionen ins Axoninnere gelangen.
Die positive Ladung der Membraninnenseite sowie die Blockade des Natrium-Ionenkanals lassen darauf schließen, dass hier der Beginn der Repolarisation dargestellt ist. In dieser Zeit kann kein neues Aktionspotenzial ausgelöst werden.
3.
Auswertung der in Material 3 dargestellten Versuchsergebnisse:
In dem Experiment wurde Mäusen ExTxA-Lösung der Konzentrationen 30 nmol pro Liter, 3 nmol pro Liter und 1 nmol pro Liter verabreicht. Einer Kontrollgruppe wurde dabei Kochsalzlösung injiziert. Im Anschluss wurde eine Stunde lang beobachtet, ob die Mäuse Schmerzreaktionen zeigten. Es wurde festgestellt, dass die Mäuse die ExTxA der Konzentration 1 nmol pro Liter innerhalb der Stunde kaum eine Reaktion auf die Injektion zeigten. Dieses Verhalten zeigte auch die Kontrollgruppe. Die Gruppe, die ExTxA der Konzentration 30 nmol pro Liter erhalten hatten, zeigten einen Anstieg der Schmerzreaktionen von null auf knapp unter 25 nach 20 Minuten. Bis Minute 50 blieb die Anzahl der Schmerzreaktionen auf diesem Niveau, danach fielen sie wieder ab. Die Mäuse, die die höchste Konzentration von ExTxA erhalten hatten, zeigten schon innerhalb der ersten 10 Minuten über 50 Schmerzreaktionen, nach weiteren 10 Minuten etwa 75 Schmerzreaktionen. Danach wurden die Schmerzreaktionen weniger und fielen auf unter 20 Reaktionen.
Wurde ExTxA auf die Haut aufgebracht, so wurden etwa 250 Aktionspotenziale in sensorische Axonen ausgelöst. Die Kontrollgruppe zeigte dagegen keine Reaktion.
Im Experiment konnte gezeigt werden, dass ExTxA erst ab einer Konzentration von über 1 nmol pro Liter Schmerzen hervorruft. Die Schmerzreaktion wurde durch die Ergebnisse des zweiten Versuches bestätigt.
4.
Deutung der Versuchsergebnisse zum Natrium-Ioneneinstrom
In dem Experiment wurde der Natrium-Ioneneinstrom bei einem isolierten Neuron bei einer künstlich hervorgerufenen Depolarisation und bei der Gabe von ExTxA mit einer Konzentration von 50 nmol pro Liter gemessen. Wurde das Axon künstlich auf -10 mV depolarisiert, so erfolgte der Natrium-Ioneneinstrom sehr schnell. Innerhalb von 5 ms wurde ein relativer Natriumioneneinstrom von 1 erreicht. Bis zu diesem Zeitpunkt ist der Verlauf der beiden Kurven deckungsgleich, woraus sich schließen lässt, dass ExTxA keinen Einfluss auf die Öffnung der Natrium-Ionenkanäle hat. Bei der Kontrolle nimmt der Natrium-Ioneneinstrom nach 5 ms rasch ab, und fällt wieder auf das Niveau vor der Reizung. Im Gegensatz dazu zeigt die Kurve von einer Reizung mit ExTxA kein Ende des Natriumeinstroms. Der Natriumeinstrom fällt nach 40 ms auf den relativen Wert von 0,3 und sinkt danach nur wenig weiter.
Während der Repolarisation werden die Natrium-Ionenkanäle normalerweise inaktiviert, und es strömen keine weitere Natriumionen in die Zelle. Die Kontrolle zeigt diesen normalen Verlauf des Natrium-Ioneneinstroms. Nach Verabreichung von ExTxA bleiben die Natriumionenkanäle jedoch dauerhaft geöffnet. Dies führt zu einer Dauererregung der Zelle, und bewirkt dadurch einen dauerhaften Schmerz.
Hypothese zur molekularen Wirkung von ExTxA im Zusammenhang mit Material 2:
Bei einem Kontakt mit ExTxA kann sich Zustand C der Natrium-Ionenkanäle nicht einstellen. Dadurch bleibt die Refraktärzeit aus, und die Kanäle bleiben weiterhin für Natriumionen permeabel. Im Normalfall würde die IFM-Schleife zu Beginn der Repolarisation die Natrium-Ionenkanäle an der Innenseite blockieren. Da unter Einwirken von ExTxA weiterhin Natriumionen in die Zelle einströmen, ist zu vermuten, dass ExTxA die Funktion der IFM-Schleife beeinträchtigt. Diese kann sich nicht mehr in die Kanalöffnung legen, und diese verschließen. Es lässt sich vermuten, dass ExTxA dazu gar nicht ins Innere der Nervenzelle gelangen, sondern bewirkt von außen eine Konformationsänderung des Kanals, wodurch der Kanal nicht mehr von der IFM-Schleife blockiert wird. Alternativ wäre es möglich, dass der Kanal durch ExTxA nur teilweise blockiert, sodass durch die unvollständige Abdichtung auch weiterhin Natriumionen ins Zellinnere strömen können. Dies würde die Ergebnisse des Experimentes in Material 4 unterstützen, aus denen hervorgeht, dass zwar weniger, aber immer noch deutlich messbar Natriumionen in die Nervenzelle einströmen.
5.
In Abbildung 5.1 dargestellte Versuchsergebnisse im Zusammenhang mit Abbildung 5.2:
In den Abbildungen 5.1 und 5.2 ist der Einfluss von Waschvorgängen und TTX auf die Wirkung von ExTxA dargestellt. Auch nach mehrmaligem Waschen mit frischer Lösung lässt die Wirkung von ExTxA nicht nach, und die Natrium-Ionenkanäle bleiben geöffnet. Da die Bindung von ExTxA auch nach mehrfachem waschen nicht nachlässt, liegt eine irreversible Bindung vor. Wird TTX als Gegengift eingesetzt, so sinkt der Natrium-Ioneneinstrom unmittelbar auf null ab. Demnach hebt TTX die Wirkung von ExTxA auf. Abbildung 5.2 liefert eine Erklärung dafür. TXX setzt sich in die äußere Kanalöffnung und verschließt diese so komplett. Es können dadurch keine Natrium-Ionen mehr ins Innere der Nervenzelle diffundieren.
6.
Eignung von Tetrodotoxin (TTX) zur Therapie der Symptome nach Kontakt mit Blättern von Dendrocnide excelsa :
Dem Experiment, welches in Abbildung 5.1 dargestellt ist, ist zu entnehmen, dass TTX die Wirkung von ExTxA vollständig aufhebt, indem es den Ionenkanal komplett blockiert. Es wirkt dadurch antagonisch zur Öffnung der Ionenkanäle durch ExTxA. Dies spricht für den Einsatz von TTX als Gegengift. Durch die Wirkung von TTX können keine Natriumionen ins Zellinnere strömen, es erfolgt keine Depolarisation und das Schmerzempfinden ist dadurch aufgehoben.
7.
Strukturen des Laubblattes und deren Funktion:
- Cuticula: Äußerste, wachshaltige Schicht, die das Blatt gegen Wasser- und Gasverlust schützt.
- Obere Epidermis: Feste Zellschicht, die das Blatt vor Tierfraß, mechanischen Belastungen und Infektionen (z.B. durch Mikroorganismen) schützt.
- Palisadenparenchym: Chloroplasten reiches Zellgewebe, in dem die Fotosynthese stattfindet.
- Leitbündel: Besteht einerseits aus Xylem, welches dem Wasser- und Mineralstofftransport dient, und Phloem, welches Assimilationsprodukte transportiert.
- Schwammparenchym: Lockeres Zellgewebe mit vielen Interzellularen, das der Speicherung und dem Austausch von Gasen und Wasser dient.
- Spaltöffnungen (Stoma): Öffnung auf der Blattunterseite, die aus zwei Schließzellen besteht, und so den Gas- und Wasseraustausch mit der Umwelt regulieren kann.
8.
In Material 7 dargestellte Versuchsergebnisse:
Im Experiment konnte gezeigt werden, dass Pflanzen der Kontrollgruppe gegenüber der Pflanzen aus dem Nara-Park von den Sika-Hirschen deutlich bevorzugt gefressen wurden. Die Hirsche waren also in der Lage, die beiden Pflanzenarten voneinander unterscheiden zu können. Im April wiesen nur 40 % der Pflanzen aus dem Kontrollgebiet Bissspuren auf, von Mai bis Juli stieg der Anteil jedoch auf 100 % an. Bei den Pflanzen aus dem Verbreitungsgebiet der Sika-Hirsche zeigten im April nur etwa 10 % Fraßschäden, wobei der Anteil bis Juli langsam auf 60 % anstieg.
Es ließ sich dabei eine Korrelation zwischen den Fraßspuren und der Überlebensrate der Pflanzen zeigen. Während 60 % der Pflanzen aus dem Nara-Park überlebten, hielten nur 30 % der Pflanzen aus dem Kontrollgebiet der Belastung stand. Dabei liegt die Vermutung nahe, dass das Fraßverhalten der Hirsche auf die Anzahl der Brennhaare einer Brennnessel pro  zurückzuführen ist. Im Freiland war die Anzahl der Brennhaare der Brennnessel aus dem Nara-Park mit etwa 5 Stück pro
zurückzuführen ist. Im Freiland war die Anzahl der Brennhaare der Brennnessel aus dem Nara-Park mit etwa 5 Stück pro  deutlich höher als bei den Pflanzen aus dem Kontrollgebiet mit unter Einem pro
deutlich höher als bei den Pflanzen aus dem Kontrollgebiet mit unter Einem pro  . Vermutlich wurden also die Pflanzen aus dem Kontrollgebiet zuerst von den Hirschen gefressen, und erst als deren Bestände zur Neige gingen, wurde auf die Brennnesseln aus dem Nara-Park umgestellt.
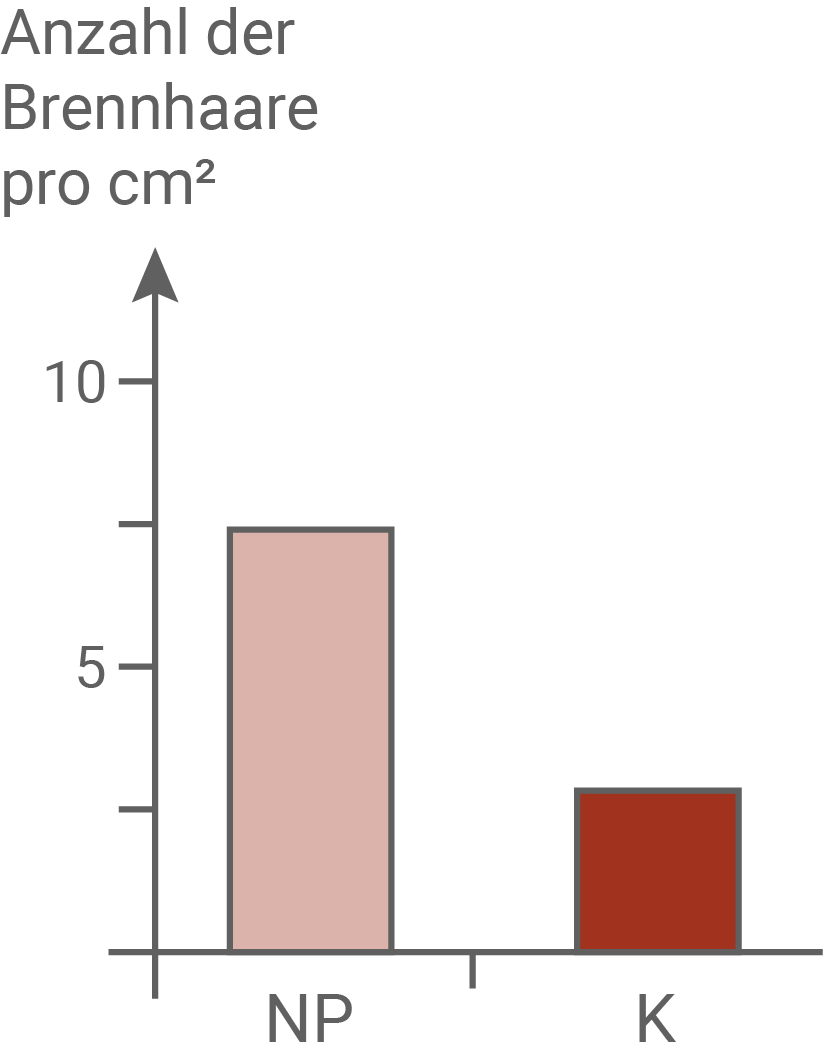
Wird die nachfolgende Generation der Pflanzen aus dem Freilandexperiment im Labor kultiviert, so konnte gezeigt werden, dass bei beiden Gruppen nur geringfügig mehr Brennhaare gebildet wurden. Dies ist vermutlich auf eine bessere Mineralstoffversorgung im Labor zurückzuführen. Da sich die Anzahl der Brennhaare und das Verhältnis zwischen Pflanzen aus dem Nara-Park und der Kontrollgruppe im Wesentlichen nicht verändert hatte, ist davon auszugehen, dass die Anzahl der Brennhaare in der Pflanze genetisch bedingt ist.
Wenn die Sika-Hirsche Pflanzen mit weniger Brennhaaren bevorzugt fressen, so können sich diese schlechter vermehren, und ihre Anzahl schrumpft auf Dauer. Im Gegensatz dazu können Pflanzen mit mehr Brennhaaren besser überleben, da die hohe Anzahl der Brennhaare einen Selektionsvorteil für diese Individuen darstellt. Da die Anlage zur Anzahl der Brennhaare genetisch fixiert ist, und damit auf die nachfolgende Generation übertragen wird, entstand im Laufe der Evolution über viele Jahre hinweg, eine Brennnesselpopulation mit einer erhöhten Brennhaardichte.
. Vermutlich wurden also die Pflanzen aus dem Kontrollgebiet zuerst von den Hirschen gefressen, und erst als deren Bestände zur Neige gingen, wurde auf die Brennnesseln aus dem Nara-Park umgestellt.
Wird die nachfolgende Generation der Pflanzen aus dem Freilandexperiment im Labor kultiviert, so konnte gezeigt werden, dass bei beiden Gruppen nur geringfügig mehr Brennhaare gebildet wurden. Dies ist vermutlich auf eine bessere Mineralstoffversorgung im Labor zurückzuführen. Da sich die Anzahl der Brennhaare und das Verhältnis zwischen Pflanzen aus dem Nara-Park und der Kontrollgruppe im Wesentlichen nicht verändert hatte, ist davon auszugehen, dass die Anzahl der Brennhaare in der Pflanze genetisch bedingt ist.
Wenn die Sika-Hirsche Pflanzen mit weniger Brennhaaren bevorzugt fressen, so können sich diese schlechter vermehren, und ihre Anzahl schrumpft auf Dauer. Im Gegensatz dazu können Pflanzen mit mehr Brennhaaren besser überleben, da die hohe Anzahl der Brennhaare einen Selektionsvorteil für diese Individuen darstellt. Da die Anlage zur Anzahl der Brennhaare genetisch fixiert ist, und damit auf die nachfolgende Generation übertragen wird, entstand im Laufe der Evolution über viele Jahre hinweg, eine Brennnesselpopulation mit einer erhöhten Brennhaardichte.
9.
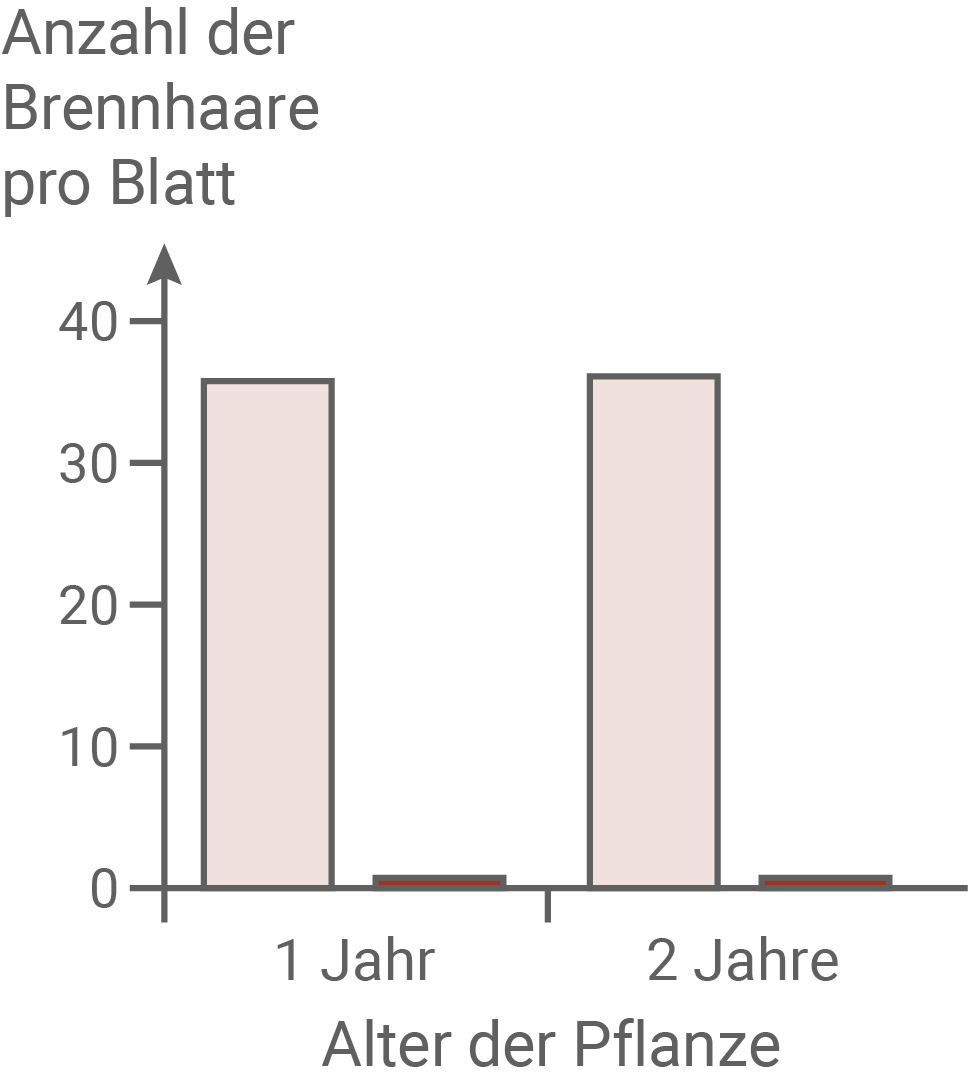
In Material 8 dargestellte Versuchsergebnisse im Hinblick auf die Fitness der Pflanzen anhand einer Kosten-Nutzen-Analyse:
Für eine Kosten-Nutzen-Analyse werden die Kosten, die eine Pflanze für Wachstum und Fortpflanzung aufwenden muss, gegen den Nutzen (die Erhöhung der reproduktiven Fitness), abgewogen. Im Experiment konnte gezeigt werden, dass die Pflanzen aus dem Nara-Park mit durchschnittlich 35 Brennhaaren pro Blatt eine deutlich höhere Brennhaardichte aufweisen, als die Pflanzen aus dem Kontrollgebiet. Auch ihr Anteil der Samen an der Gesamtmasse ist deutlich höher als bei Pflanzen der Kontrollgruppe. Außerdem blühen sie mehr als 50 Tage, während die Pflanzen aus dem Kontrollgebiet nur etwa 20 Tage lang blühen. Mehr Brennhaare verringern Fraßschäden durch Sika-Hirsche. Ein erhöhter Samenanteil sowie eine längere Blütezeit erhöhen den Fortpflanzungserfolg dieser Pflanzen. Allerdings müssen diese Pflanzen auch vermehrt Energie aufwenden, um mehr Samen zu produzieren und länger zu blühen. Daher können sie diese Energie nicht in ein Längenwachstum investieren, und bleiben kleiner als die Pflanzen der Kontrollgruppe. Dies stellt ebenfalls einen Selektionsvorteil für diese Pflanzen dar, da höhere Pflanzen früher von den Hirschen gefressen werden.
Bildet eine Pflanze verstärkt Brennhaare aus, und verlängert ihre Blühzeit, so stellen diese Anpassungen einen hohen Nutzen für die Pflanzen dar, da sie dadurch ihre reproduktive Fitness erhöhen können. Dieser Nutzen überwiegt dabei die hohen Kosten für Samenbildung und lange Blühzeit.