Vorschlag A – Venusfliegenfalle
Die Venusfliegenfalle – eine fleischfressende Pflanze
Die Venusfliegenfalle besitzt Fangblätter, die blitzschnell zuklappen können, wenn ein Beutetier darauf herumkrabbelt. Dabei werden im Fangblatt Aktionspotenziale ausgelöst. Die Beutetiere werden durch Enzyme der Pflanze verdaut und die gelösten Moleküle von der Pflanze aufgenommen. Die Vorgänge beim Beutefang und der Verdauung beeinflussen Fotosynthese und Zellatmung der Fangblätter und verursachen Kosten für die Pflanze.Neurophysiologische Aspekte
1
Zeichne ein beschriftetes Diagramm, das den Verlauf eines Aktionspotenzials an einem tierischen Neuron zeigt, und beschreibe die zugrunde liegenden Vorgänge an der Axonmembran.
(12 BE)
2
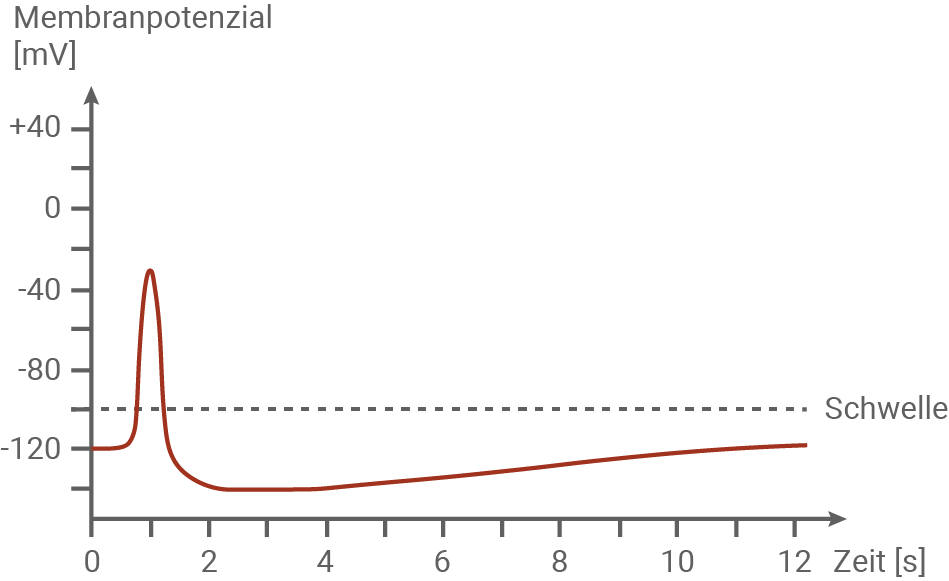
Vergleiche den Verlauf eines Aktionspotenzials bei der Venusfliegenfalle mit dem Verlauf eines Aktionspotenzials an einem tierischen Neuron. (Material 1)
(8 BE)
3
Beschreibe die in Material 3 dargestellten molekularen Prozesse und erkläre damit die Potenzialänderungen im Verlauf des Aktionspotenzials bei der Venusfliegenfalle. (Material 1, 2 und 3)
(18 BE)
Ökologische und stoffwechselphysiologische Aspekte
4
Beschreibe die wesentlichen Abschnitte des Calvin-Zyklus.
(6 BE)
5
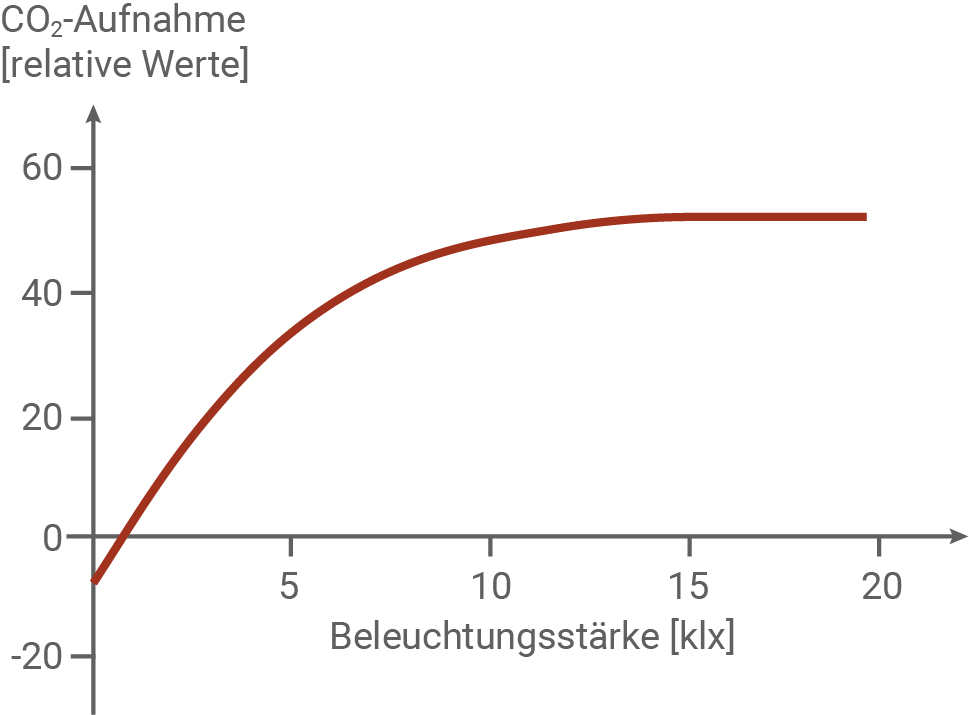
Beschreibe und erkläre den Kurvenverlauf. (Material 4)
(12 BE)
6
Deute die in den Abbildungen 6.1 sowie 5.1 und 5.2 dargestellten Versuchsergebnisse im Zusammenhang miteinander, auch unter Einbezug von Material 3. (Material 1, 3, 5 und 6)
(14 BE)
7
Deute die in Material 7 dargestellten Ergebnisse. Deute anschließend die in Abbildung 6.2 dargestellten Ergebnisse mithilfe von Material 7. (Material 1, 6 und 7)
(12 BE)
8
Stelle den Nutzen und die Kosten der fleischfressenden Lebensweise für die Venusfliegenfalle dar. Zeige, wodurch die Kosten-Nutzen-Relation für die Pflanze möglichst günstig ausfällt. (Material 1, 2, 3 und 6, 7, 8, 9)
(18 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1
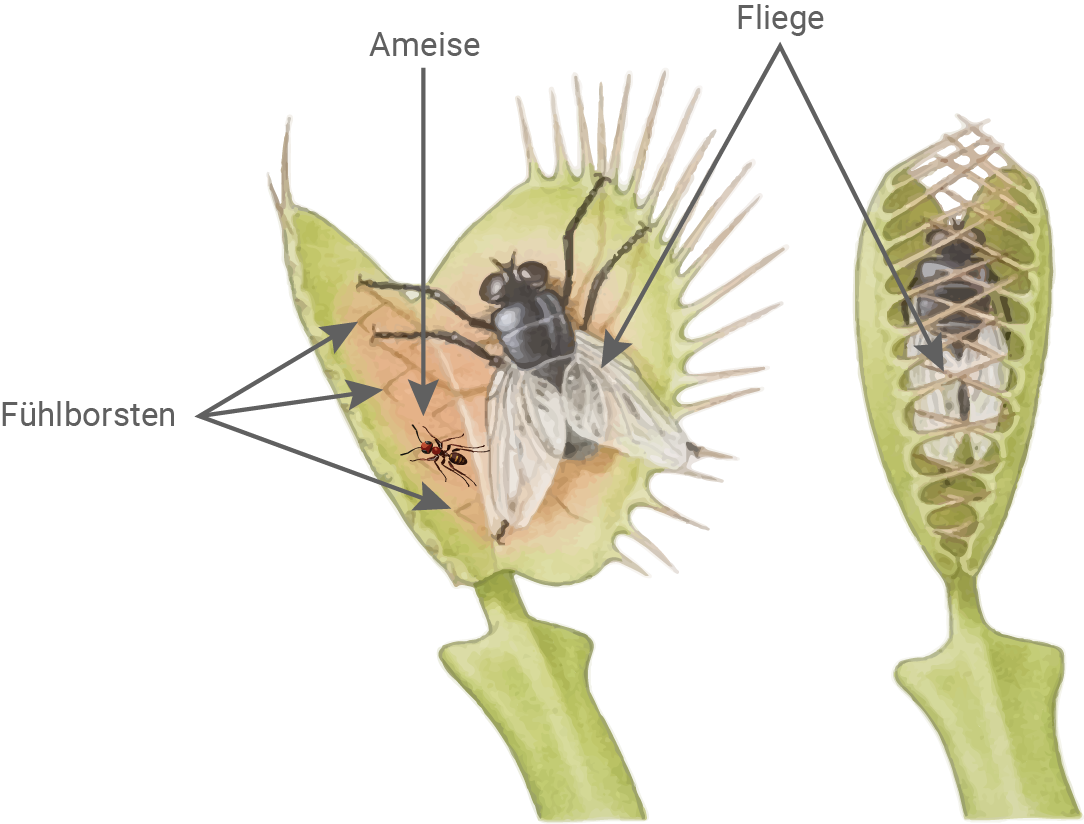
Beutefang der Venusfliegenfalle
Die Venusfliegenfalle (Dionaea muscipula) ist eine der bekanntesten fleischfressenden Pflanzen. Sie lebt an der Ostküste der USA auf Böden, die arm an Mineralstoffen - insbesondere an stickstoffhaltigen Verbindungen - sind. Ihre Blätter befinden sich dicht am Boden und dienen sowohl zur Fotosynthese als auch zum Fangen von Insekten und Spinnen. Der Blattstiel ist verbreitert und grün gefärbt, während die nicht klebrigen, bis zu ca. 4 cm langen Fangblätter auf der Innenseite rot sind. Die Beutetiere werden mithilfe von Duftstoffen angelockt. Auf jedem Fangblatt einer Venusfliegenfalle befinden sich drei bis neun Fühlborsten, unabhängig von Alter und Größe der Fangblätter. Werden die Fühlborsten verbogen, z. B. durch ein krabbelndes Beutetier, entsteht ein Aktionspotenzial. Das Aktionspotenzial läuft immer gleich ab, wenn eine bestimmte Schwelle überschritten wird. Es wird mit einer Geschwindigkeit von ca. 20 mm/s über das gesamte Fangblatt weitergeleitet, jedoch nicht in den Blattstiel. Wenn innerhalb von 30 Sekunden zweimal ein Aktionspotenzial entsteht, entweder an derselben Fühlborste oder an zwei verschiedenen Fühlborsten desselben Fangblatts, wird eine sehr schnelle Veränderung des Wassergehalts der Zellen in der Mitte des Fangblatts ausgelöst, wodurch die Blatthälften innerhalb von ca. 100 Millisekunden zuklappen. Wenn ein Tier gefangen wurde, bewegt es sich daraufhin heftig in der Falle, wodurch weitere Aktionspotenziale entstehen. Erst ab dem fünften kurz aufeinanderfolgenden Aktionspotenzial werden Gene für Verdauungsenzyme sowie für Transportproteine aktiviert. Die Verdauungsenzyme werden aus Drüsen aktiv in das Innere der geschlossenen Falle abgegeben, wo sie die Makromoleküle der Beutetiere aufspalten. Die Produktion der Enzyme erreicht ihren Höhepunkt nach ca. 4 Stunden und dauert mehr als 36 Stunden an. Durch aktive Transportprozesse werden gelöste Moleküle und Ionen aus der Beute in die Blattzellen aufgenommen. Dies kann mehr als eine Woche dauern, danach beginnt sich das Fangblatt wieder zu öffnen.
Abbildung 1.1: Venusfliegenfalle


Abbildung 1.2: Fangblatt mit gefangenem Insekt

Abbildung 1.3: Verlauf des Aktionspotenzials bei der Venusfliegenfalle

Material 2
Wahrnehmung von Berührungsreizen
Die Fühlborsten auf ausgewachsenen Fangblättern sind etwa 2 mm lang und stehen mehrere Millimeter voneinander entfernt. Sie enthalten im unteren Teil mehrere Sinneszellen. Wenn die Fühlborste kurzzeitig mit einer bestimmten Mindestkraft verbogen wird, entsteht in den Sinneszellen ein Aktions- potenzial, das ins Fangblatt weitergeleitet wird. Forschende ermittelten, dass etwa bei der Hälfte der Berührungen eines 10 mg schweren Beutetiers, z. B. einer 5 mm großen Ameise, ein Aktionspotenzial ausgelöst wird.Fühlborsten der Venusfliegenfalle

Material 3
Entstehung des Aktionspotenzials bei der Venusfliegenfalle
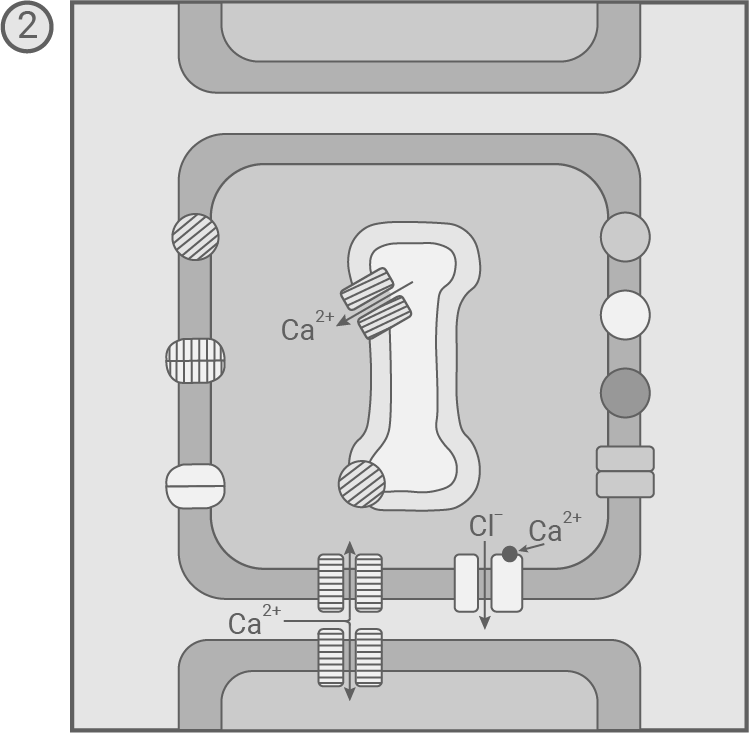
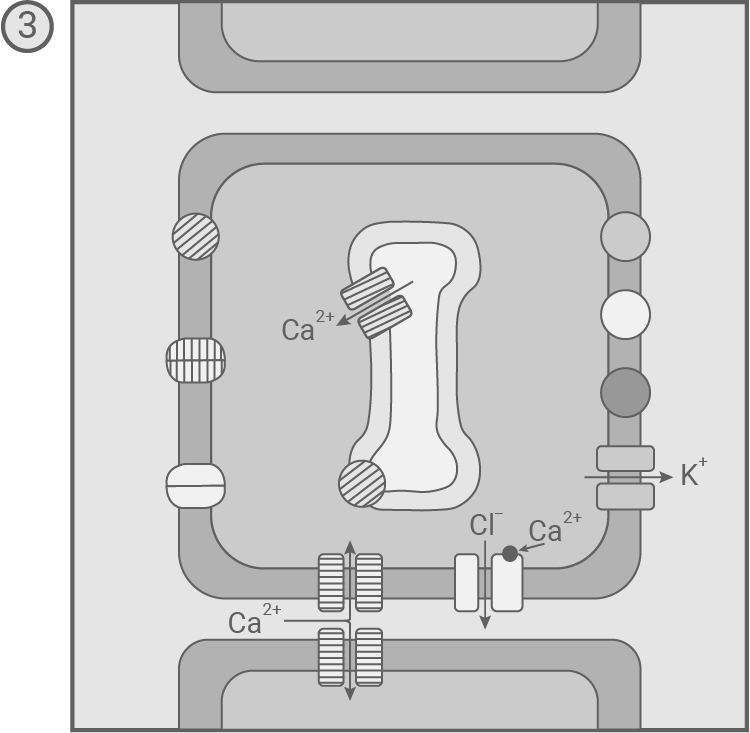
In den Sinneszellen der Fühlborsten wurden mechanosensitive Ionenkanäle entdeckt, die auf eine Verformung der Zelle reagieren. Außerdem fand man in den Sinneszellen sowie in den übrigen Zellen der Fühlborsten und Fangblätter verschiedene spannungsgesteuerte und ligandengesteuerte Ionenkanäle sowie mehrere Transportproteine für Ionen. Modell des zeitlichen Ablaufs der molekularen Prozesse nach kurzzeitiger Biegung einer Fühlborste 1 und anschließendem Wiederaufrichten 2 – 5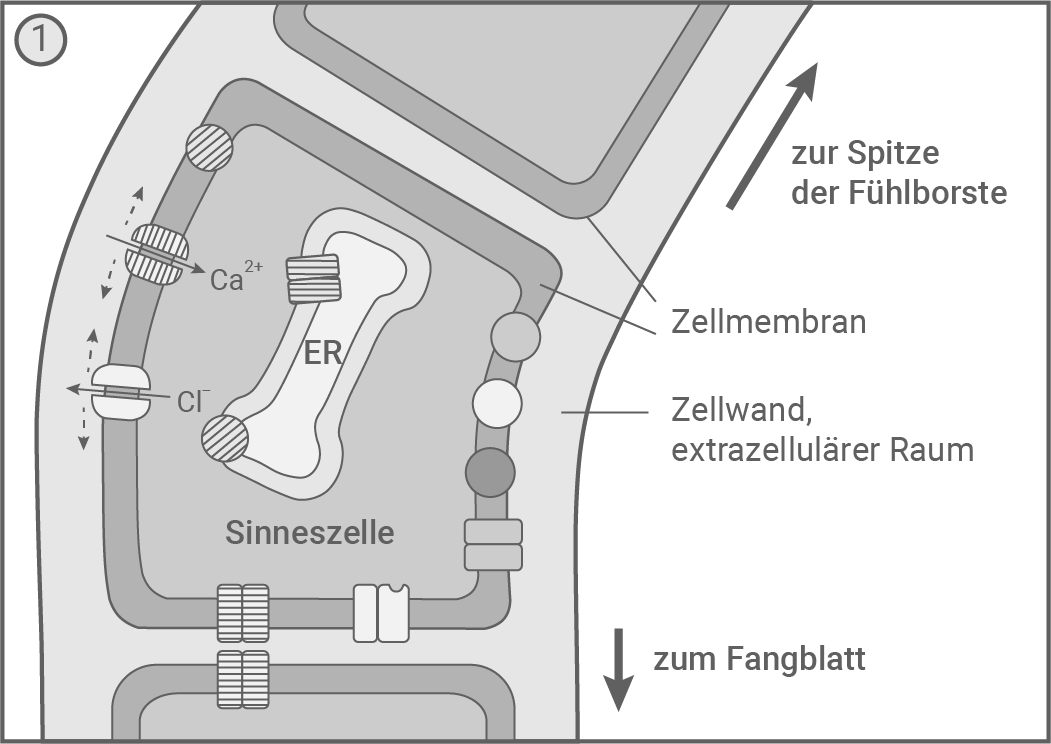
Material 4
Kohlenstoffdioxid-Stoffwechsel einer Pflanze in Luft
Material 5
Fotosynthese und Zellatmung bei der Venusfliegenfalle
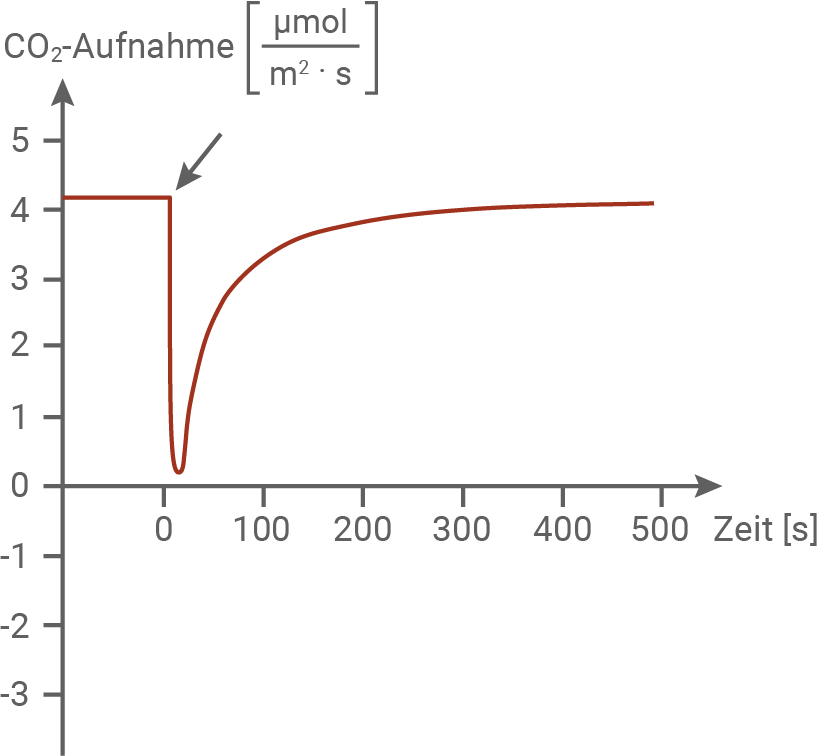
Für die in den folgenden Abbildungen dargestellten Messungen wurde ein Fangblatt in ein Messgefäß mit normaler Luft eingeschlossen. Zum Zeitpunkt 0 (siehe Pfeil) wurden zwei Fühlborsten mit einem dünnen Draht berührt und dadurch das Schließen des Fangblatts ausgelöst. Die Experimente wurden sowohl im Dunkeln als auch im Licht durchgeführt.
Abbildung 5.1: CO2-Gaswechsel im Dunkeln
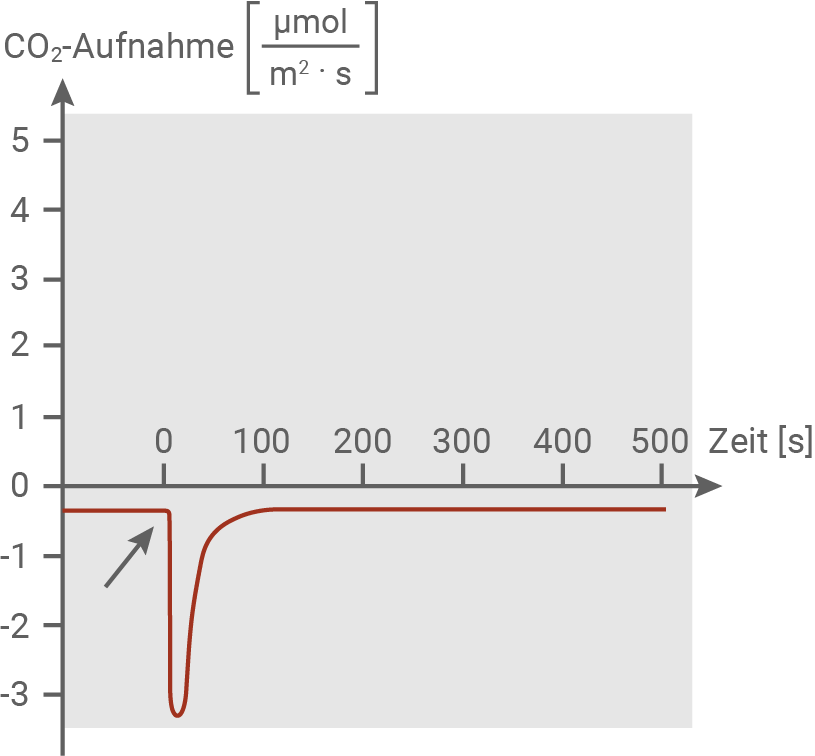

Abbildung 5.2: CO2-Gaswechsel im Licht

Material 6
ATP-Gehalt im Fangblatt
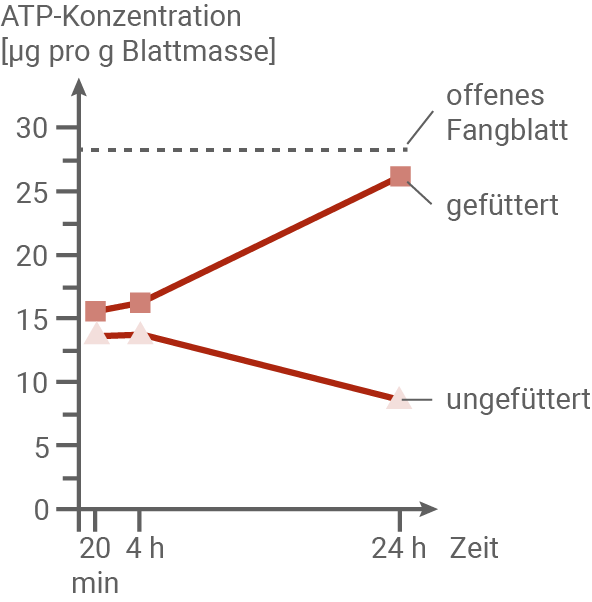
Zum Zeitpunkt 0 wurde das Zuklappen der Fangblätter durch zweifaches mechanisches Reizen der Fühlborsten mit einem dünnen Draht ausgelöst. Die Fühlborsten wurden in den geschlossenen Fangblättern während der folgenden 10 Sekunden wiederholt berührt. Während der folgenden 24 Stunden wurden Blätter zu bestimmten Zeitpunkten tiefgefroren, um alle Stoffwechselprozesse zu stoppen. Der ATP-Gehalt in den Zellen in der Mitte des Fangblatts wurde gemessen (siehe Abbildungen 6.1 und 6.2). Bei einem Teil der Fangblätter wurde zeitgleich mit der Reizung der Fühlborsten ein kleines Stück Filterpapier mit 10 mg getrocknetem Insektenfleisch und 25 μl Lösung der Aminosäure Glutamin in die Fangblätter eingebracht (= „gefüttert“). Die übrigen Fangblätter (= „ungefüttert“) wurden nur mit dem Draht wiederholt gereizt.
Abbildung 6.1: ATP-Gehalt in der Mitte des Fangblatts bis 30 s nach Reizung
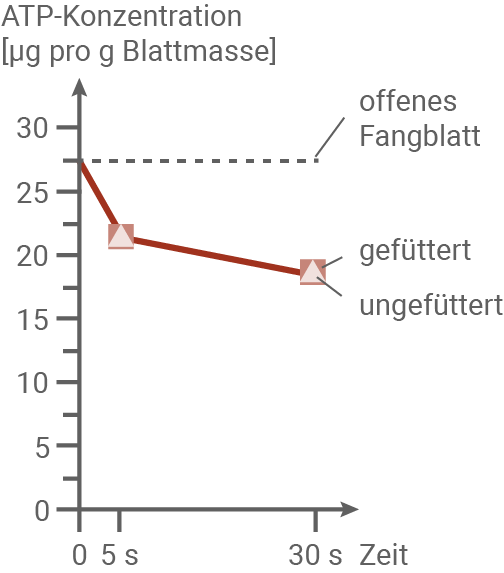

Abbildung 6.2: ATP-Gehalt in der Mitte des Fangblatts ab 20 min nach Reizung

Material 7
Verarbeitung der gefangenen Beute
Wie in Material 6 beschrieben, wurden die Fangblätter mit einem Draht wiederholt gereizt und zeitgleich mit 10 mg getrocknetem Insektenfleisch und 25 μl Lösung der Aminosäure Glutamin gefüttert. In dem hier dargestellten Experiment enthielten die Glutamin-Moleküle schwere C-Atome mit der Atommasse 13 u statt der normalen C-Atome mit der Atommasse 12 u. In geschlossenen Messgefäßen wurde ermittelt, wie viel CO2 mit C-Atomen der Masse 13 u (13CO2) von den Fangblättern abgegeben wurde. Auf diese Weise konnte gemessen werden, wie viel CO2 aus dem angebotenen Glutamin gebildet wurde. Abgabe von 13CO2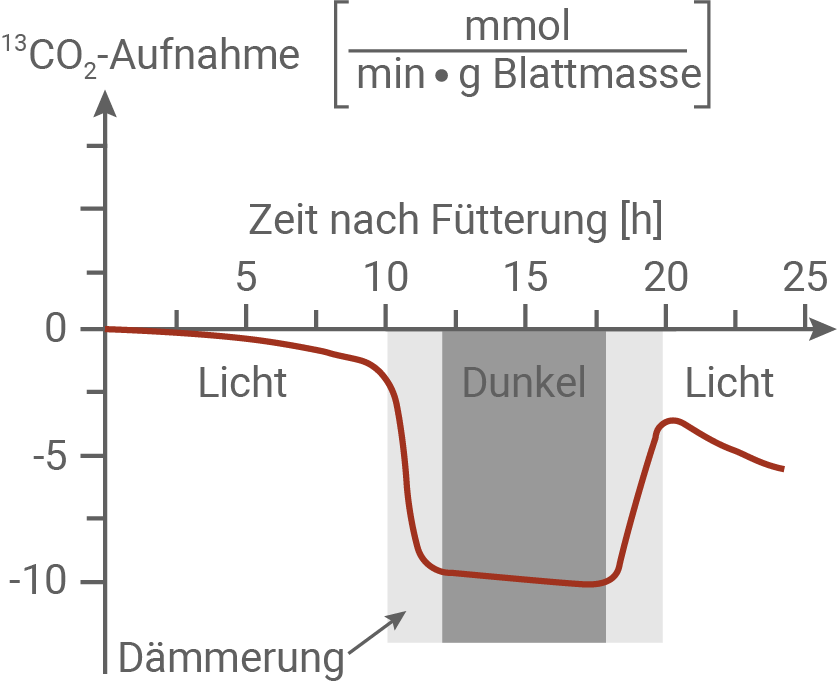
Material 8
Fangblattzyklen
Ein geöffnetes Fangblatt (Abbildung A) klappt zu, wenn an den Fühlborsten zwei Aktionspotenziale innerhalb von 30 Sekunden entstanden sind. Das Fangblatt ist dann aber noch nicht komplett verschlossen, sondern am Blattrand sind noch Lücken offen (Abbildung B). Wenn keine weiteren Aktionspotenziale ausgelöst werden, öffnet sich das Fangblatt innerhalb von etwa 22 Stunden wieder. Einen solchen Zyklus ohne Beutefang kann ein Fangblatt höchstens 10- bis 12-mal wiederholen. Dann stirbt es ab. Nur wenn ein eingeschlossenes Beutetier im zugeklappten Fangblatt durch seine Bewegungen weitere Aktionspotenziale auslöst, verschließt sich die Falle innerhalb von mehreren Stunden vollständig (Abbildung C) und die Verdauung der Beute beginnt. In diesem Fall beginnt sich das Fangblatt erst nach neun bis elf Tagen zu öffnen. Der Öffnungsprozess dauert weitere ein bis drei Tage. Diesen Zyklus mit Verdauung einer Beute kann ein Fangblatt maximal dreimal durchführen, bevor es abstirbt. Während des Öffnungsprozesses werden Ionen aktiv in bestimmte Bereiche des Blattes transportiert, sodass durch den folgenden osmotischen Wassereinstrom die Druckverhältnisse wiederhergestellt werden, die für ein erneutes Zuklappen erforderlich sind.Zustände eines Fangblatts

Material 9
Effizienz des Beutefangs
Forschende untersuchten den Beutefang von Venusfliegenfallen am natürlichen Standort. Sie erhielten die folgenden Ergebnisse:- An einem sonnigen Tag klappten innerhalb von 24 Stunden 10 von 201 Fangblättern zu, 6 davon enthielten ein Beutetier, 4 waren leer.
- An einem Tag, an dem sehr viel Regen fiel, klappten innerhalb von 24 Stunden 15 von 202 Fangblättern zu, jedoch war in keiner der Fallen Beute gefangen.
- Je größer die Fangblätter waren, desto größer waren die gefangenen Beutetiere.
Größenvergleich zwischen Fangblatt und Beutetieren
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Verlauf eines Aktionspotenzials an einem tierischen Neuron:
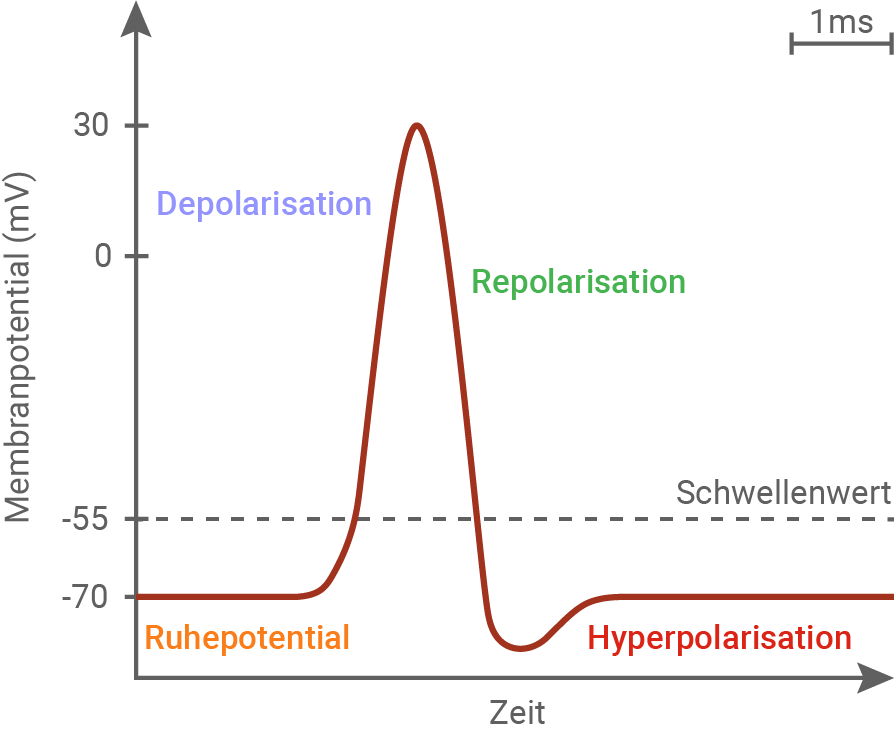
Die Änderung der Permeabilität der Neuronenmembran für Natrium- und Kaliumionen ist dafür verantwortlich, dass Aktionspotenziale entstehen können. Im Zustand des Ruhepotenzials ist die Kaliumionenkonzentration im Zellinneren höher als im extrazellulären Raum. Bei Natriumionen ist es umgekehrt. Ihre Konzentration ist intrazellulär niedriger als extrazellulär. Diese Ionenverteilung sorgt für eine Potenzialdifferenz zwischen Außen- und Innenseite.

- Depolarisation: Bei Reizung einer Nervenzelle öffnen sich anfangs wenige Natriumionenkanäle. Durch den Einstrom der Natriumionen ins Zellinnere wird die Spannung im Zellinneren von -70 mV auf -50 mV angehoben. Das Überschreiten dieses Schwellenwertes löst die Öffnung weiterer Natriumionenkanäle, und damit das Aktionspotenzial aus. Der starke Einstrom der Natriumionen führt zu einer Depolarisation des Membranpotenzials auf +30 mV.
- Repolarisation: Die spannungsabhängigen Natriumionenkanäle schließen, es strömen also keine weiteren Natriumionen ins Zellinnere. Etwas zeitversetzt öffnen Kaliumionenkanäle, durch die Kaliumionen aus der Zelle herausströmen. Es kann so eine erneute Ladungsumkehr (die Repolarisation) erzielt werden. Die Membranaußenseite ist nun wieder positiv, und die Membraninnenseite negativ geladen.
- Hyperpolarisation: Da die Kaliumionenkanäle nicht sofort schließen, wenn das Ruhepotenzial erreicht ist, strömen noch weitere Kaliumionen aus der Zelle aus, sodass ein Membranpotenzial von ca. - 90 mV erreicht wird. Die Kaliumionenkanäle schließen, und das Ruhepotenzial wird wieder eingestellt. Dies geschieht durch die Natrium-Kalium-Pumpe, die unter ATP-Verbrauch drei Natriumionen aus der Zelle heraus, und zwei Kaliumionen in die Zelle hinein pumpt. Die Zelle kann jetzt ein neues Aktionspotenzial ausbilden.
2
Vergleich des Aktionspotenzials bei der Venusfliegenfalle und einem tierischen Neuron:
Gemeinsamkeiten:
- Der grundlegende Verlauf beider Aktionspotenziale ausgehend vom Ruhepotenzial über Depolarisation, Repolarisation, Hyperpolarisation und Wiederherstellung des Ruhepotenzials ist identisch.
- In beiden Fällen wird das Aktionspotenzial erst durch Überschreiten des Schwellenwertes ausgelöst (Alles-oder-Nichts-Prinzip).
- Bei der Venusfliegenfalle wird das Aktionspotenzial durch mechanische Reize ausgelöst, wie die Biegung der Fühlborsten durch ein Beutetier, während bei tierischen Neuronen elektrische Reize das Potenzial initiieren.
- Ein bedeutender Unterschied liegt in der Geschwindigkeit der Erregungsleitung. Bei der Venusfliegenfalle beträgt die Leitungsgeschwindigkeit etwa 20 mm/s, während tierische Neuronen eine Leitungsgeschwindigkeit von bis zu 120 m/s erreichen können.
- Bei der Venusfliegenfalle führt das Aktionspotenzial zur physischen Reaktion des Fangblatts, indem es sich schnell schließt, um die Beute zu fangen. Im Gegensatz dazu dient das Aktionspotenzial bei tierischen Neuronen der Informationsübertragung zwischen Zellen.
- Ein weiterer wichtiger Unterschied liegt in der Anzahl der benötigten Reize: Bei der Venusfliegenfalle müssen mindestens zwei Aktionspotenziale innerhalb von 30 Sekunden ausgelöst werden, um das Fangblatt vollständig zu schließen. Darüber hinaus führt die kontinuierliche Bewegung der Beute zu weiteren Reizen, die schließlich die Produktion von Verdauungsenzymen auslösen. Diese Enzyme zersetzen die Beute, sodass die Pflanze die Nährstoffe aufnehmen kann.
- Das Ruhepotenzial tierischer Neuronen ist mit etwa -70 mV höher als bei der Venusfliegenfalle mit -120 mV. Auch der Schwellenwert tierischer Neuronen liegt mit etwa -50 mV höher als bei der Venusfliegenfalle mit -90 mV. Auch der Höhepunkt der Membranspannung unterscheidet sich. Bei tierischen Axonen steigt er bis auf ca. +30 mV, bei der Venusfliegenfalle liegt er bei etwa -30 mV.
- Das Aktionspotenzial der Venusfliegenfall dauert deutlich länger, als es bei Tieren der Fall ist.
3
Molekulare Prozesse und Potenzialänderungen bei der Venusfliegenfalle:
- Wird die Fühlborste (beispielsweise durch ein Beutetier) verbogen, so führt die Biegung zur Öffnung mechanosensitiver Ca2+- und Cl--Ionenkanälen in der Zellmembran der Sinneszelle. Daraufhin strömen positiv geladene Ca2+-Ionen vom extrazellulären Raum in die Sinneszelle hinein, und negativ geladene Cl--Ionen aus der Sinneszelle hinaus. Die Erhöhung der positiven Ladung im Inneren führt zur Depolarisation der Sinneszelle.
- Richtet sich die Fühlborste wieder in ihre Ausgangsposition auf, so schließen sich die mechanosensitiven Ca2+- und Cl--Ionenkanälen in der Zellmembran. Durch die Depolarisation der Zelle wird der Schwellenwert überschritten, und es öffnen andere spannungsgesteuerte Ca2+-Ionenkanäle in der Zellmebran der Sinneszelle und ihrer Umgebungszellen sowie im ER, wodurch weitere Ca2+-Ionen ins Zellinnere gelangen. Ca2+-Ionen binden an ligandengesteuerte Cl--Ionenkanälen, und sorgen damit für ein Ausströmen von Cl--Ionen aus dem Zellinneren. Diese Prozesse bewirken ein weiteres Erhöhen der Spannung in der Zellmembran.
- Im nächsten Schritt öffnen spannungsabhängige K+-Ionenkanäle in der Zellmembran, und K+-Ionen strömen aus dem Zellinneren aus. Die Spannung im Zellinneren sinkt, und die Repolarisationsphase beginnt.
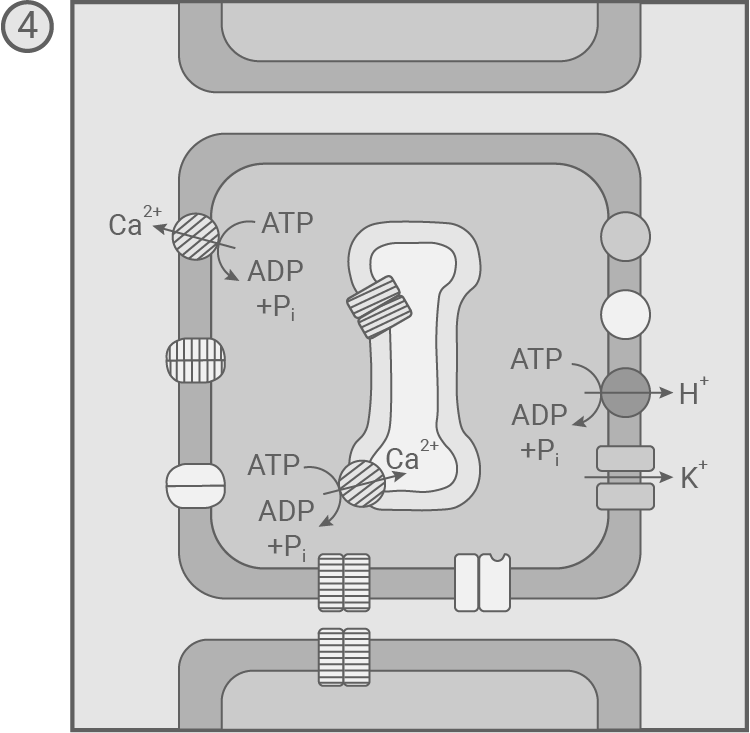
- Die spannungsabhängigen Ca2+-Ionenkanäle schließen. Unter ATP-Verbrauch werden Ca2+-Ionen zurück in den extrazellulären Raum und ins ER transportiert. Der Entzug der Ca2+-Ionen führt auch zum Schließen der Cl--Ionenkanäle. K+-Ionen strömen weiter aus der Zelle hinaus, während H+-Ionen aktiv aus der Zelle hinaus befördert werden. Durch diese Prozesse sinkt das Potenzial weiter, und es kommt zur Hyperpolarisation.
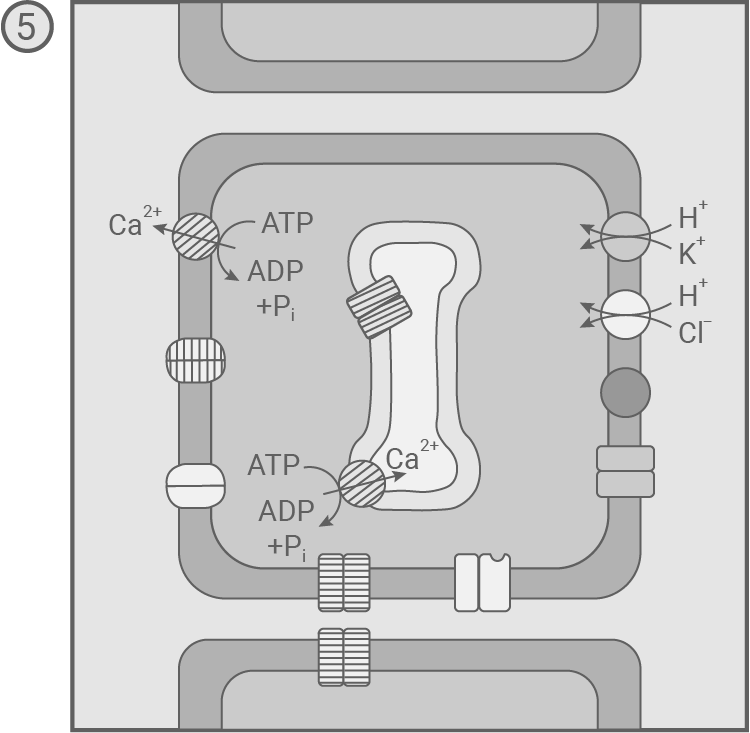
- Die spannungsabhängigen K+-Ionenkanäle schließen. Während Ca2+-Ionen weiterhin aus der Zelle hinaus transportiert werden, werden im Symport mit H+-Ionen K+- und Cl--Ionen aus dem Extrazellularraum in die Sinneszelle befördert. So wird das Ruhepotenzial wiederhergestellt.
4
Wesentliche Abschnitte des Calvin-Zyklus:
Der Calvin-Zyklus besteht aus drei wesentlichen Phasen: der Kohlenstofffixierung, der Reduktion und der Regeneration. In der Kohlenstofffixierung bindet das Enzym Rubisco CO2 an Ribulose-1,5-bisphosphat. Dies führt zur Bildung eines instabilen Zwischenprodukts, das zu zwei Molekülen 3-Phosphoglycerinsäure (3-PGA) zerfällt. In der zweiten Phase, der Reduktion, wird 3-PGA mit Hilfe von ATP und NADPH zu Glycerinaldehyd-3-phosphat (G3P) reduziert.
Ein Teil des G3P wird für die Synthese von Glucose und anderen Kohlenhydraten verwendet, während der Rest in der dritten Phase, der Regeneration, verwendet wird, um Ribulose-1,5-bisphosphat wiederherzustellen. Diese Regeneration ist wichtig, um den Calvin-Zyklus kontinuierlich fortzuführen. ATP und NADPH, die für den Zyklus benötigt werden, stammen aus den Lichtreaktionen der Photosynthese. Der Calvin-Zyklus findet im Stroma der Chloroplasten statt und ist von zentraler Bedeutung für die Umwandlung von CO2 in organische Verbindungen, die der Pflanze als Energiequelle und Baumaterial dienen.
5
Kurvenverlauf und Erklärung:
Die Abbildung zeigt den CO2-Gaswechsel der Venusfliegenfalle unter verschiedenen Lichtbedingungen. Auf der x-Achse ist die Beleuchtungsstärke in Kilolux und auf der y-Achse die CO2-Aufnahme in relativen Werten angegeben. Negative Werte bedeuten eine CO2-Abgabe, was auf die Zellatmung hinweist, während positive Werte eine CO2-Aufnahme anzeigen, die mit der Photosynthese verbunden ist. Im Dunkeln (bis zu einer Beleuchtungsstärke von etwa 1 klx) gibt die Pflanze CO2 ab, da keine Photosynthese stattfinden kann und nur die Zellatmung aktiv ist. An dieser Stelle schneidert die Kurve die x-Achse, und der Lichtkompensationspunkt ist erreicht.
Sobald mehr Licht auf die Pflanze trifft, beginnt die Photosynthese, und die CO2-Aufnahme steigt stark an. Bis zu einer Beleuchtungsstärke von 5 klx steigt die CO2-Aufnahme proportional zur Beleuchtungsstärke an. Bis zu einer Bleuchtungsstärke von 15 klx verringert sich die Steigung, danach stagniert die CO2-Aufnahme bei einem relativen Wert von 50. Ab diesem Punkt bewirkt die Erhöhung der Bleuchtungsstärke keine Erhöhung der CO2-Aufnahme. Hier ist die maximal mögliche Photosyntheserate erreicht.
6
Deutung der Versuchsergebnisse:
In einem geöffneten Fangblatt bleibt die ATP-Konzentration in der Blattmitte über die gesamte Beobachtungszeit konstant in einem hohen Bereich. Nach einer Reizung des Fangblatts sinkt die ATP-Konzentration jedoch innerhalb von 30 Sekunden deutlich ab, unabhängig davon, ob Insektenfleisch zugeführt wird oder das Fangblatt leer bleibt (Abbildung 6.1). Dies deutet darauf hin, dass der ATP-Abfall durch die Reizung verursacht wird und nicht durch das Vorhandensein von Nahrung. Bei einer Reizung entstehen Aktionspotenziale, die zur Wiederherstellung des Ruhepotenzials Ionenpumpen aktivieren. Diese benötigen ATP, um Ionen zu transportieren (Material 3), was den Rückgang der ATP-Konzentration erklärt.
Wird ein Fangblatt über die Fühlborsten stimuliert, zeigt sich im Dunkeln für etwa 100 Sekunden eine stark erhöhte CO2-Abgabe (Abbildung 5.1). Im Hellen kommt es in demselben Zeitraum hingegen zu einer deutlich verminderten CO2-Aufnahme (Abbildung 5.2), was nahezu zur Einstellung der Nettofotosynthese führt. Dieser Effekt ist auf eine gesteigerte Zellatmungsaktivität zurückzuführen, die in beiden Lichtbedingungen auftritt. Nach dieser Phase kehren die Werte im Dunkeln und im Hellen allmählich zu den Ausgangswerten zurück.
Die Zellatmung dient dabei der Regeneration des durch die Ionenpumpen verbrauchten ATPs. Außerdem ist eine ausreichende ATP-Bereitstellung essenziell für die Vorgänge des Calvin-Zyklus, wodurch sichergestellt wird, dass die Fotosynthese weiterhin effizient ablaufen kann.
7
Deutung der Ergebnisse aus Material 7:
In der Dunkelheit geben die Fangblätter über die Spaltöffnungen große Mengen an CO2 ab, das schwere Kohlenstoffatome enthält. Das zeigt, dass die zugeführte Aminosäure Glutamin im Stoffwechselprozess abgebaut wird. Das dabei freigesetzte 13CO2 entsteht während der Zellatmung. Auch im Licht wird 13CO2 freigesetzt, jedoch in deutlich geringerem Umfang, da ein Teil des während der Zellatmung entstandenen 13CO2 direkt wieder in die Fotosynthese eingebunden wird. Im Verlauf des Experiments steigt die Menge des abgegebenen 13CO2 an, da der Abbau des schweren Glutamins zunehmend voranschreitet.
Interpretation der Ergebnisse aus Abb. 6.2:
Die ATP-Konzentration in gereizten Fangblättern wurde über einen Zeitraum von 24 Stunden gemessen. Während die ATP-Konzentration in offenen Fangblättern unverändert bleibt, zeigt sich ein deutlicher Unterschied zwischen gefütterten und ungefütterten Fangblättern: Bei gefütterten Fangblättern steigt die ATP-Konzentration kontinuierlich an, während sie bei ungefütterten Fangblättern stetig abnimmt. In beiden Fällen wird ATP benötigt, um nach der Reizung das Ruhepotenzial der Zellen wiederherzustellen. Zusätzlich verbrauchen andere Prozesse im Fangblatt, wie die Produktion von Verdauungsenzymen, Transportproteinen und anderen energieaufwendigen Stoffwechselaktivitäten, ebenfalls ATP. Bei gefütterten Fangblättern sorgen die aufgenommenen organischen Stoffe aus der Nahrung für eine verstärkte ATP-Produktion durch Zellatmung, sodass die ATP-Konzentration trotz des hohen Verbrauchs durch andere Prozesse ansteigt. Fehlt jedoch die Nahrung, stehen den ungefütterten Fangblättern lediglich eigene Reserven, wie Kohlenhydrate aus der Fotosynthese, für die ATP-Produktion zur Verfügung. Diese Ressourcen reichen nicht aus, um den hohen Energiebedarf zu decken, weshalb die ATP-Konzentration kontinuierlich abfällt.
8
Nutzen und Kosten der fleischfressenden Lebensweise der Venusfliegenfalle:
Nutzen:
- Der größte Nutzen liegt in der Aufnahme von Stickstoff und anderen Nährstoffen, die für das Wachstum der Pflanze entscheidend sind. Die Venusfliegenfalle lebt auf nährstoffarmen Böden, auf denen Stickstoff, Phosphor und Kalium oft in geringen Mengen vorhanden sind. Durch den Beutefang kann die Pflanze diese Nährstoffe effizient aus der Beute gewinnen.
- Die Pflanze kann es sich so auch leisten die Nische tief am Boden zu besetzen, da sie nicht, wie viele andere Pflanzen, auf eine hohe Sonneneinstrahlung zur Energiegewinnung angewiesen ist.
- Die Kosten dieser Lebensweise liegen im hohen Energieaufwand, den die Pflanze für den Beutefang und die Verdauung aufbringen muss. Das Schließen der Fangblätter, die Produktion von Verdauungsenzymen und der Transport der Nährstoffe in die Zellen erfordern eine erhebliche Menge an Energie. Um diese Kosten zu minimieren, hat die Pflanze Mechanismen entwickelt, um nur dann Energie für den Verdauungsprozess zu investieren, wenn es lohnende Beute gibt. Die Fangblätter schließen sich nur vollständig, wenn mehrere mechanische Reize ausgelöst wurden, was darauf hindeutet, dass sich ein Beutetier in der Falle befindet.
- Ein weiterer Kostenfaktor ist der eingeschränkte Zugang zur Photosynthese während der Verdauungsphase. Solange das Fangblatt geschlossen ist, kann es keine Photosynthese betreiben. Während der Verdauung ist die Pflanze daher auf die restlichen Blattflächen angewiesen, um Photosynthese zu betreiben. Dennoch trägt die Verdauung der Beute zur Energiegewinnung bei, da die Pflanze die Nährstoffe in ATP umwandelt, das für den Stoffwechsel genutzt wird.
- Die Fangblätter sterben nach einiger Zeit ab, und müssen erneuert werden. Die häufige Regeneration dieser Organe stellt ebenfalls einen hohen Kostenfaktor für die Pflanze dar.