Vorschlag A – Long-QT-Syndrom
Long-QT-Syndrom
Das sogenannte Long-QT-Syndrom ist eine angeborene genetische Herzerkrankung. Es handelt sich aber nicht um einen Herzfehler im üblichen Sinn, denn das Herz ist hier normal entwickelt. Das Long-QT-Syndrom ist eine der häufigsten Ursachen des plötzlichen und unerwarteten Herztodes im Kindes- und Jugendalter. Spezielle Medikamente können vorbeugen bzw. im Akutfall lebensrettend sein.Long-QT-Syndrom aus neurobiologischer Sicht
1
Beschreibe die Vorgänge während der Entstehung und des Verlaufs eines neuronalen Aktionspotenzials.
(10 BE)
2
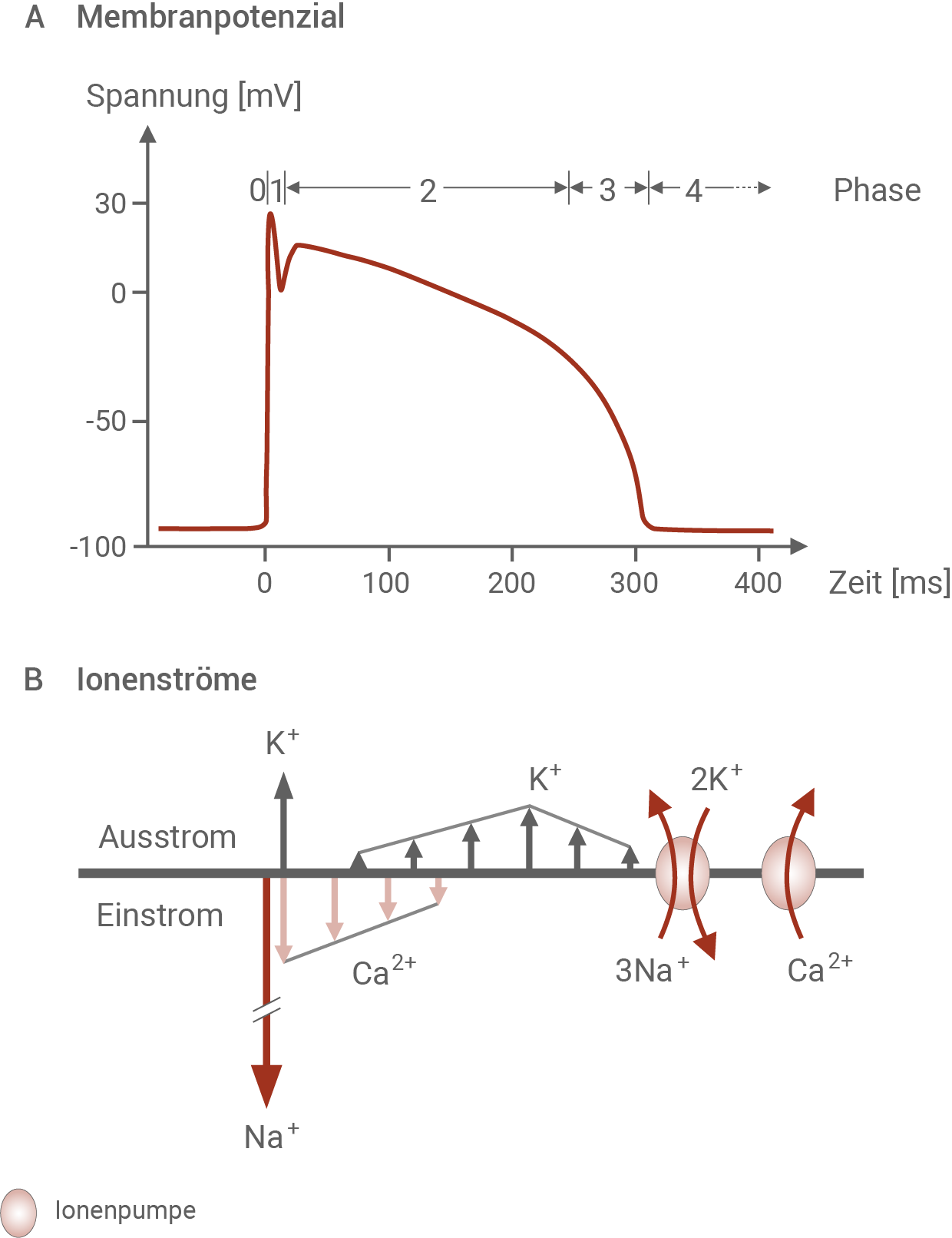
Stelle die Zusammenhänge zwischen den Phasen 0 bis 4 eines Herzaktionspotenzials und den Ionenströmen unter Berücksichtigung der Konzentrationsgradienten der am Aktionspotenzial beteiligten Ionen dar. Nenne zwei wesentliche Unterschiede zwischen einem neuronalen Aktionspotenzial und einem Herzaktionspotenzial. (Material 1)
(18 BE)
Genetik und Therapie des Long-QT-Syndroms
3
Beschreibe den Ablauf der Translation.
(10 BE)
4
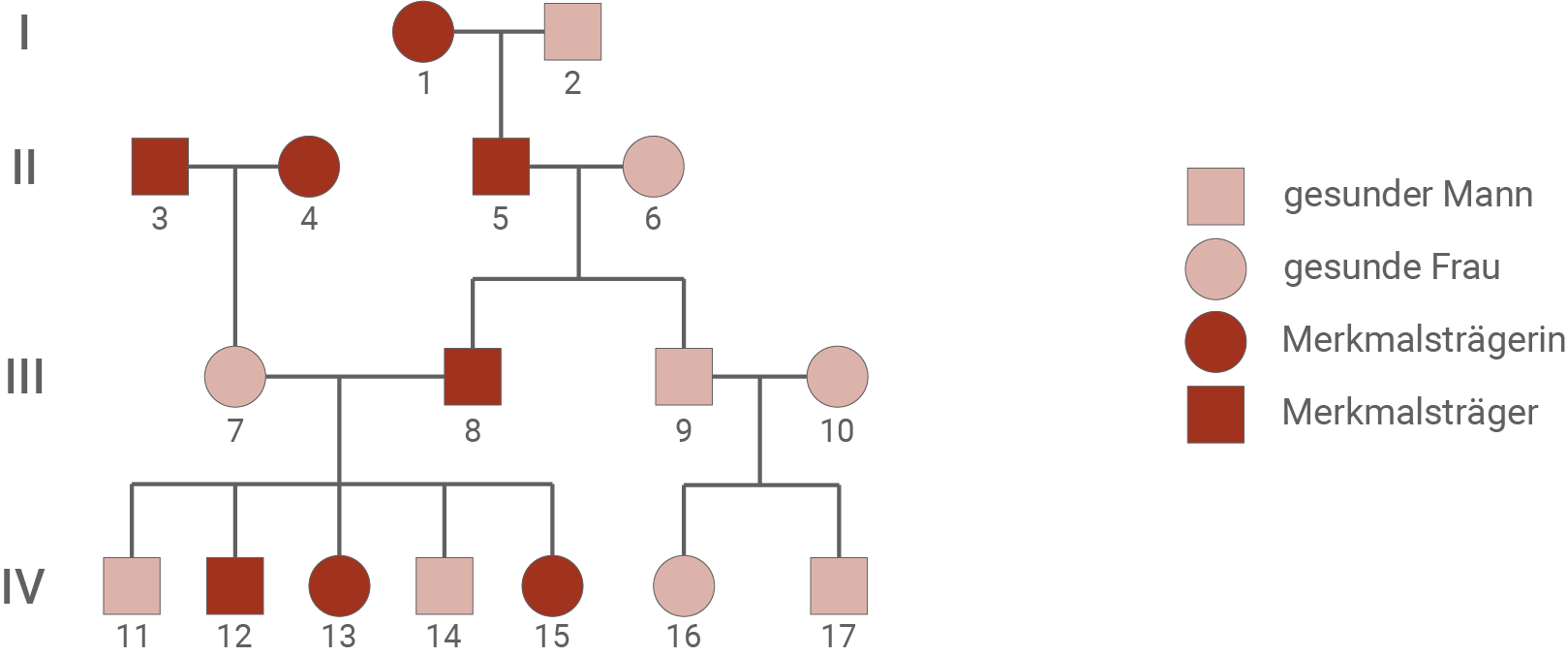
Analysiere den Stammbaum zum Long-QT-Syndrom im Hinblick auf mögliche Vererbungsmodi. Ordne den Personen 1, 5 und 7 mögliche Genotypen zu und gib die Bedeutung der von dir verwendeten Symbole an. (Material 2)
(10 BE)
5
Gib für den Ausschnitt des mutierten Allels eines Patienten mit LQT1 (Abbildung 3.1) die Sequenz des codogenen Strangs, die Sequenz der mRNA und die entsprechende Aminosäuresequenz an. Bestimme für beide LQT-Typen jeweils den Mutationstyp und die Folge der Mutation für die Primärstruktur des Proteins. (Material 3 und Code-Sonne der mRNA)
(10 BE)
6
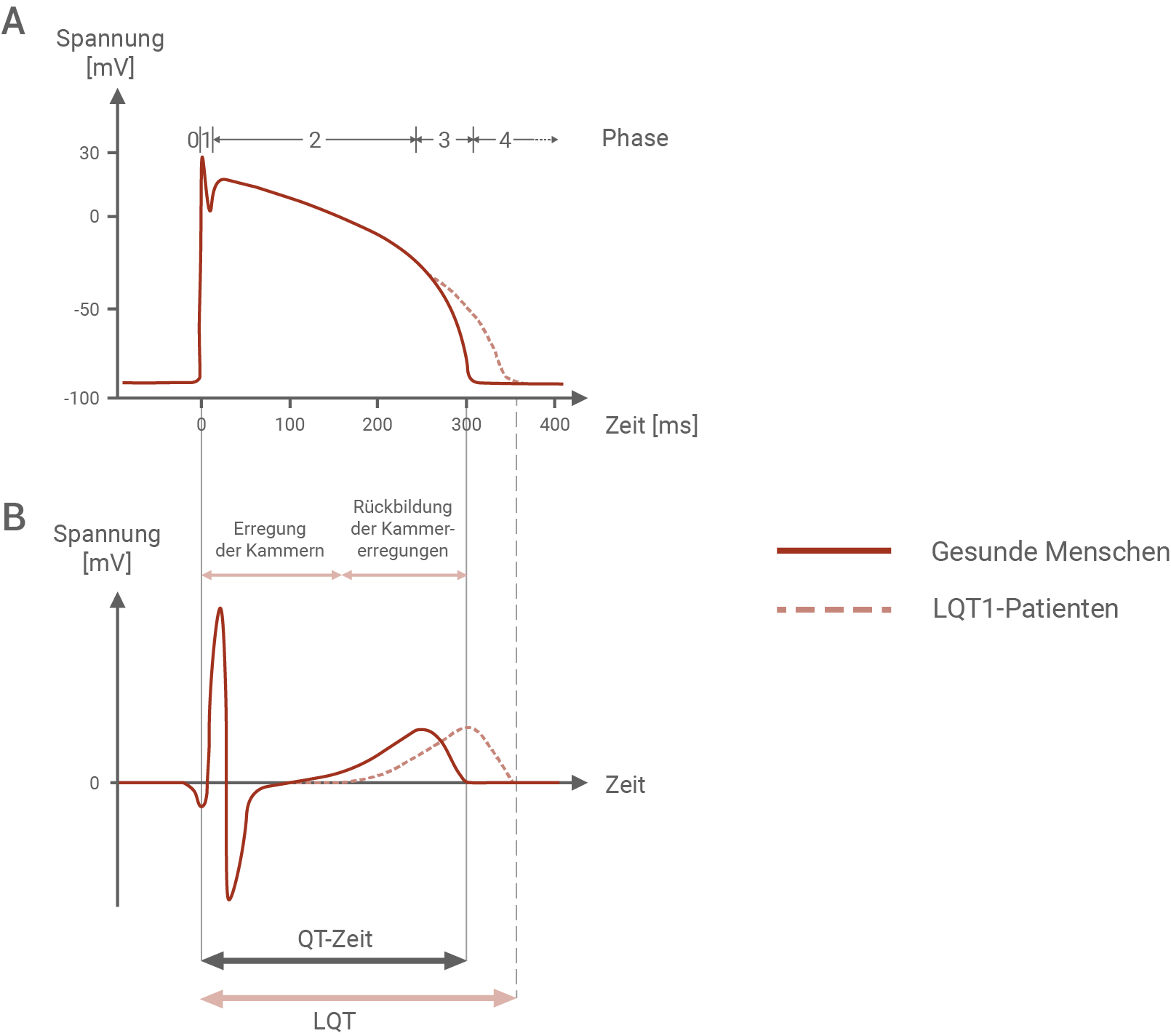
Erkläre für den LQT1-Typ (Material 4) die Zusammenhänge zwischen der zugrundeliegenden Mutation und den Besonderheiten des Herzaktionspotenzials sowie des EKGs dieser Patienten. Entwickle für einen Patienten mit LQT3 (Material 5) eine Hypothese zur Erklärung des Verlaufs des Aktionspotenzials. (Material 1, 3, 4 und 5)
(15 BE)
7
Erläutere den Einfluss von Adrenalin auf Herzmuskelzellen. (Material 6)
(7 BE)
8
Erkläre den Wirkmechanismus von Betablockern zur Normalisierung des EKGs beim LQT1. (Material 1, 4, 6 und 7)
(10 BE)
9
Untersuche anhand von Material 8 die Wirksamkeit von Betablockern zur Vorbeugung eines Herzstillstands bei den verschiedenen LQT-Typen. (Material 3, 6, 7 und 8)
(10 BE)
(100 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1
Das Aktionspotenzial der Herzmuskelzelle eines Menschen
Das Herz hat die Aufgabe, das Blut durch den Körper zu pumpen. Dazu muss sich die Herzmuskulatur abwechselnd kontrahieren und entspannen. Dies wird durch die rhythmische elektrische Aktivität der einzelnen Herzmuskelzellen gesteuert. Jeder reguläre Herzschlag wird ausgelöst von einem spontanen elektrischen Impuls, der von einer spezialisierten Gruppe von Zellen im Herzen, den sogenannten Schrittmacherzellen, ausgeht. Von dort breitet sich der Impuls sehr schnell über alle Herzmuskelzellen aus. Jede einzelne Herzmuskelzelle besitzt in ihrem Inneren Eiweißstrukturen, die sich auf dieses Aktionspotenzial hin zusammenziehen. Dadurch kontrahiert die Zelle und leistet somit ihren Beitrag zur Kontraktion des gesamten Herzmuskels. Ähnlich wie in Nervenzellen verändert sich auch an den einzelnen Herzmuskelzellen die Membranspannung in charakteristischer Weise, so dass man hier ebenfalls von Aktionspotenzialen (AP) spricht. Ein Aktionspotenzial wird ausgelöst, indem ein bereits erregter Bereich des Herzmuskels an einer benachbarten Stelle eine lokale Depolarisation bewirkt. Wird der Schwellenwert, der bei einer Herzmuskelzelle bei ca. -70 mV liegt, überschritten, läuft die weitere Änderung des Membranpotenzials selbsttätig ab. Während des Aktionspotenzials werden verschiedene Ionenkanäle in einer genau festgelegten Reihenfolge aktiviert. Die folgende Abbildung zeigt den charakteristischen Verlauf des Membranpotenzials an einer Herzmuskelzelle nach Erregung zum Zeitpunkt Null sowie die Rolle einiger beteiligter Ionenkanäle. Das Aktionspotenzial kann in verschiedene Phasen eingeteilt werden.Phasen eines Herzaktionspotenzials und Ionenströme
Hinweis
Die Ionenverteilung einer ruhenden Herzmuskelzelle entspricht ungefähr der einer Nervenzelle. Die Calcium-Ionenkonzentration ist außerhalb der Zelle erheblich höher als innerhalb.Die Ionenströme für Kalium-Ionen resultieren aus der Aktivität mehrerer verschiedener Kalium-Ionenkanäle.
Material 2
Das Long-QT-Syndrom
Das sogenannte Long-QT-Syndrom ist eine genetisch bedingte Herzerkrankung, die durch eine Störung der Erregungsbildung im Herzmuskel hervorgerufen wird. Charakteristisch sind anfallsartig auftretende Zustände von Herzrasen, die im schlimmsten Fall über einen Bewusstseinsverlust zum Tod durch Herzstillstand führen können.Stammbaum einer Familie mit Long-QT-Syndrom
Material 3
Molekulargenetische Untersuchungsergebnisse zum Long-QT-Syndrom
Ursache dieser Erkrankung sind Mutationen, durch die die Durchlässigkeit von Ionenkanälen verändert ist. Dies kann entweder zur Behinderung oder zur Steigerung der Kanalaktivität führen. Bis heute sind für das Long-QT-Syndrom verschiedene Typen, LQT1 bis LQT13, bekannt, die 13 verschiedene Gene betreffen. 75 % aller bisher bekannten Mutationen entfallen dabei auf die drei am häufigsten betroffenen Gene, welche die Varianten LQT1, LQT2 und LQT3 hervorrufen. Auslöser des LQT1 sind Mutationen im KCNQ1-Gen. Dieses Gen codiert für einen spannungsabhängigen Kalium-Ionenkanal.Beim LQT3 sind bis heute 90 Mutationen bekannt, die alle das SCN5A-Gen betreffen. Dieses Gen codiert für den spannungsgesteuerten Natrium-Ionenkanal
Abb. 3.1: Ausschnitte des nicht-codogenen DNA-Strangs des KCNQ1-Gens (LQT1)

Abb. 3.2: Ausschnitte des nicht-codogenen DNA-Strangs des SCN5A-Gens (LQT3)
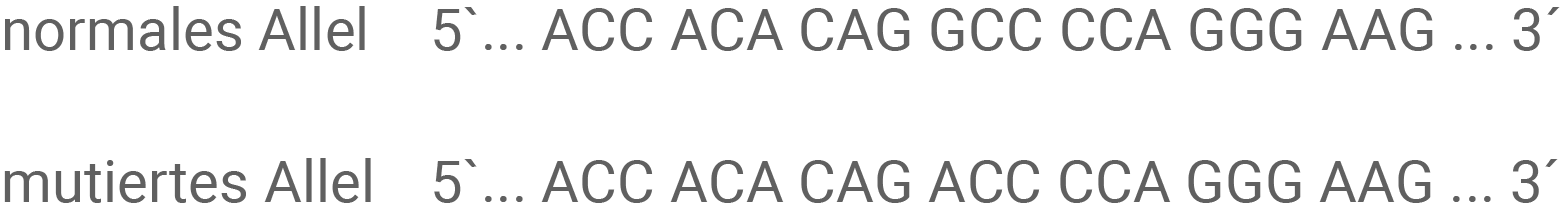
Material 4
EKG und Long-QT-Syndrom
Zur Diagnose vieler Herzerkrankungen eignet sich als Untersuchungsmethode das Elektrokardiogramm (EKG). Hierbei wird die Summe aller sich überlagernden Aktionspotenziale der Milliarden von Herzmuskelzellen mit Elektroden von der Körperoberfläche als elektrisches Signal abgeleitet und auf einem Monitor als Kurve abgebildet. Bei einer normalen Herzfunktion hat diese Kurve immer eine charakteristische Form und die einzelnen Abschnitte sind immer gleich lang (z. B. QT-Zeit). Bei allen drei Typen des Long-QT-Syndroms zeigt sich eine QT-Zeit-Verlängerung im EKG.Aktionspotenzial einer Herzmuskelzelle (A) und EKG (B) von gesunden Menschen und von LQT1-Patienten
Material 5
Elektrophysiologische Eigenschaften von  -Kanälen und das Herzaktionspotenzial beim LQT3-Syndrom
-Kanälen und das Herzaktionspotenzial beim LQT3-Syndrom
Für elektrophysiologische Untersuchungen der Eigenschaften von Abb. 5.1: Natrium-Ioneneinstrom als Reaktion auf eine Spannungsänderung
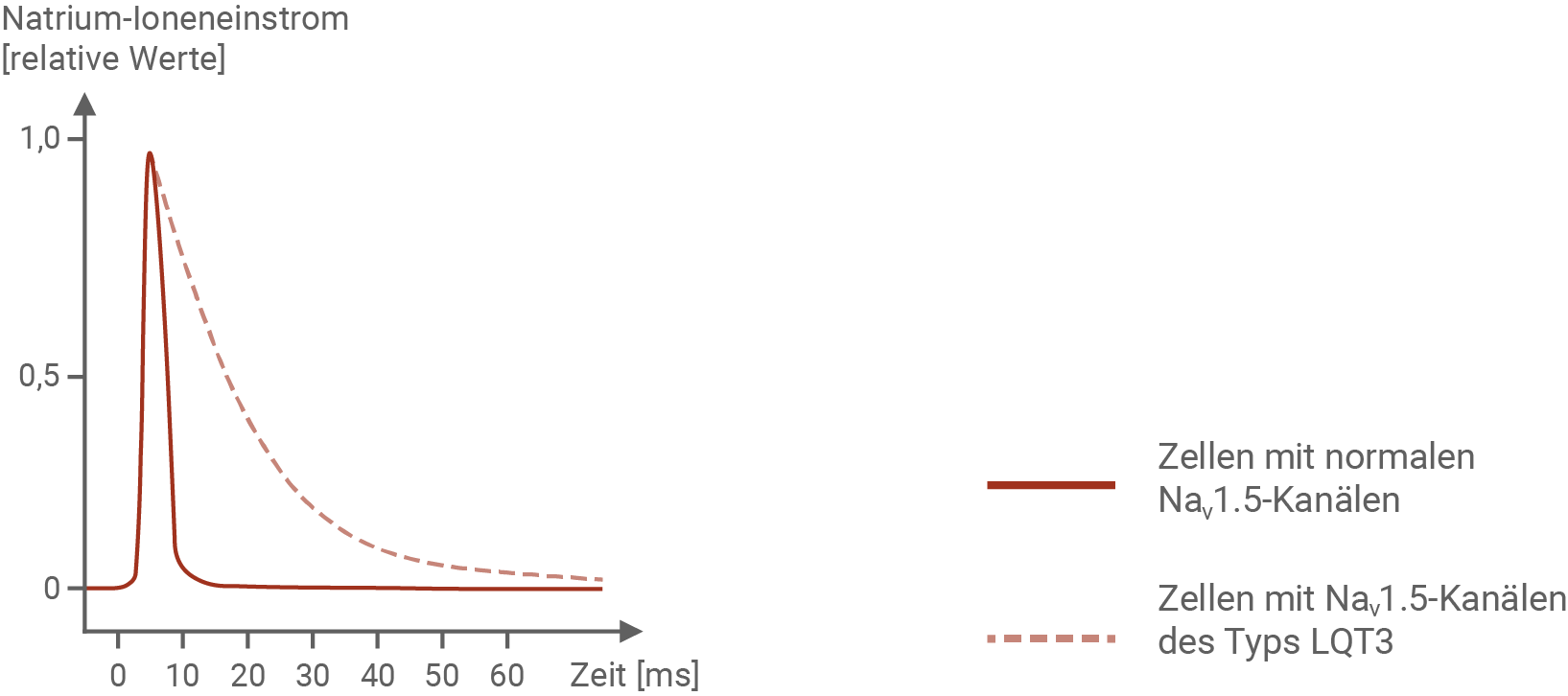
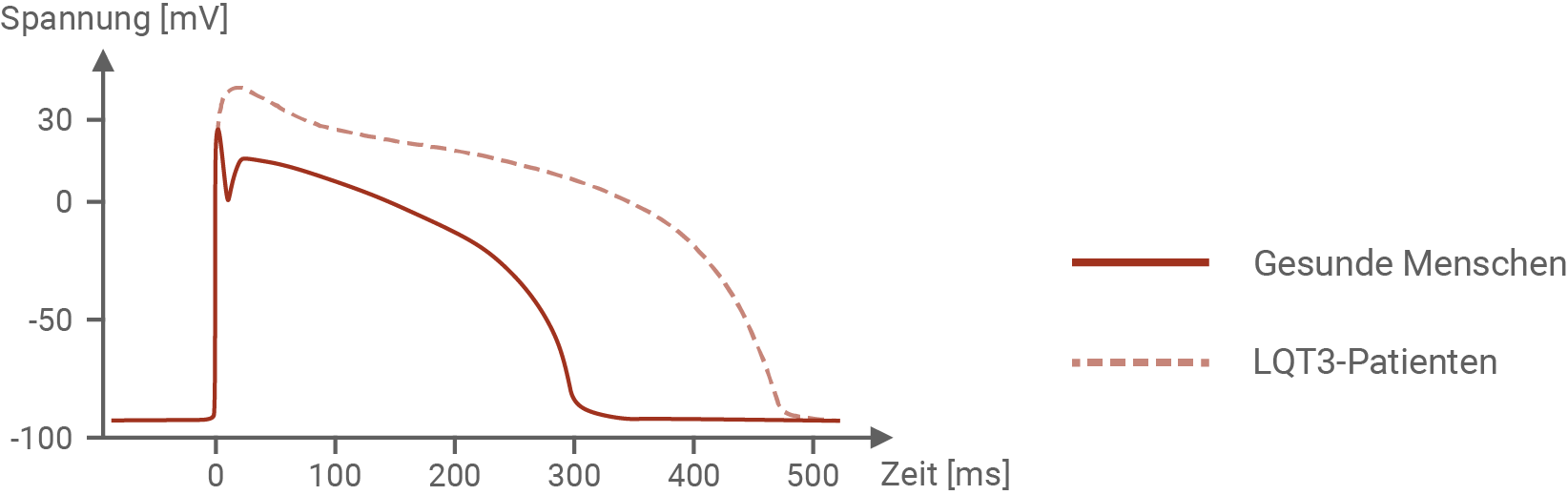
Abb. 5.2: Aktionspotenzial einer Herzmuskelzelle von Patienten mit LQT3
Material 6
Wirkung von Adrenalin an Herzmuskelzellen und Steuerung der Kontraktion des Herzmuskels
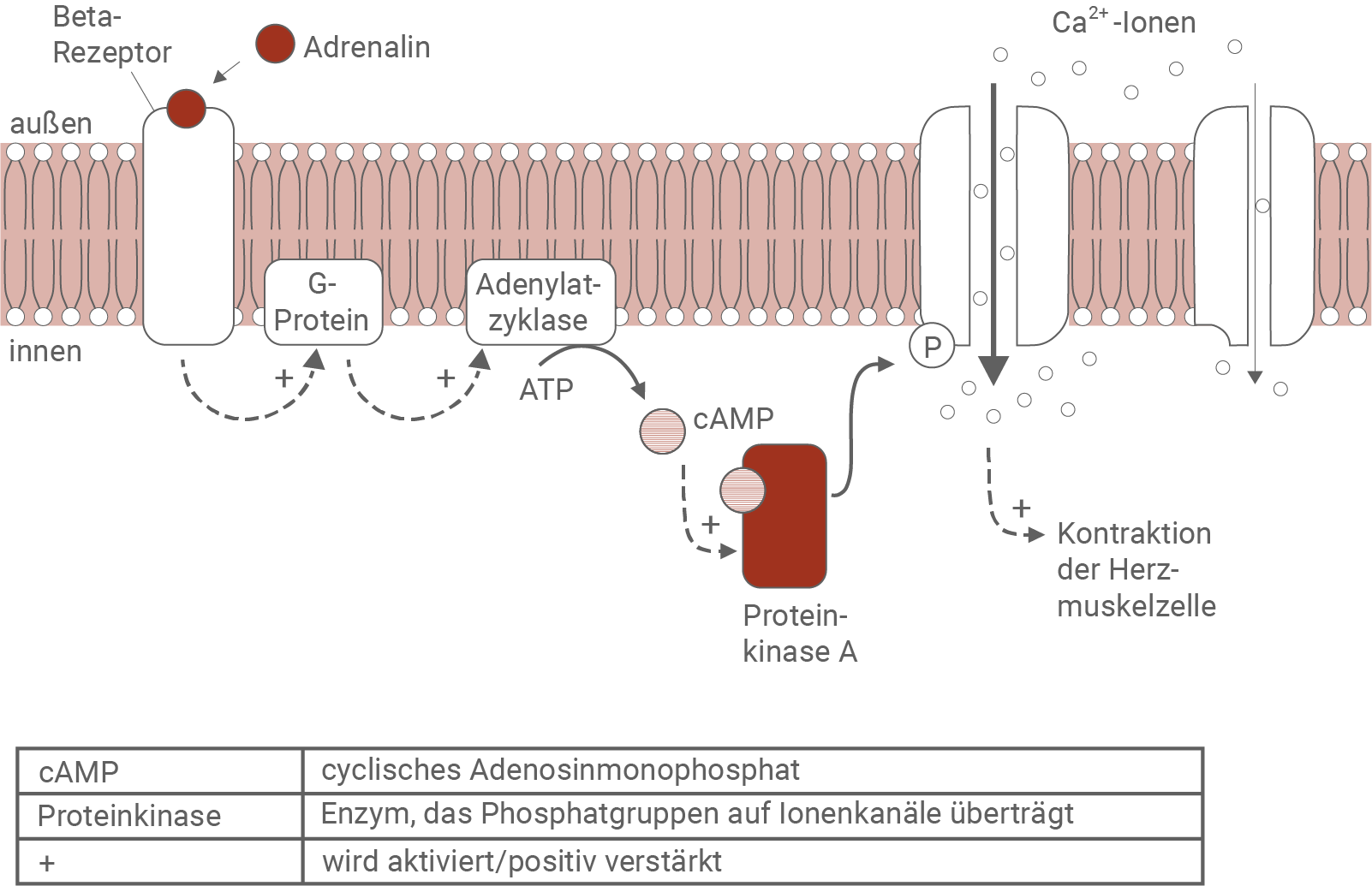
Eine prinzipielle Möglichkeit, die Kontraktion zu beeinflussen, besteht durch das im Nebennierenmark gebildete Hormon Adrenalin, das in Stresssituationen oder unter körperlicher Anstrengung ins Blut ausgeschüttet wird. Calcium-Ionen im Zellinneren einer Herzmuskelzelle vermitteln ein Signal zur Aktivierung kontraktiler Strukturen und haben damit Einfluss auf die Kontraktionskraft (= Kraft, mit der sich ein Muskel zusammenzieht) des Herzmuskels. Eine übermäßige Steigerung der Kontraktionskraft kann zum Herzstillstand führen. Der Zusammenhang zwischen Kontraktionskraft und Herzstillstand ist nicht Gegenstand der Aufgabenstellung.Adrenalinwirkung an einer Herzmuskelzelle
Material 7
Medikamentöse Therapie des LQT-Syndroms
Zur medikamentösen Therapie des Long-QT-Syndroms werden sogenannte Beta-Rezeptorenblocker (kurz: Betablocker) eingesetzt. Das Medikament bindet an die Beta-Rezeptoren in der Membran der Herzmuskelzellen und blockiert dann deren Funktion. Bei konsequenter langzeitiger Einnahme konnte allein durch Betablocker die Wahrscheinlichkeit tödlicher Ereignisse beim Long-QT-Syndrom von ehemals 70 % auf unter 10 % gesenkt werden.Material 8
Auslöser für den Herzstillstand
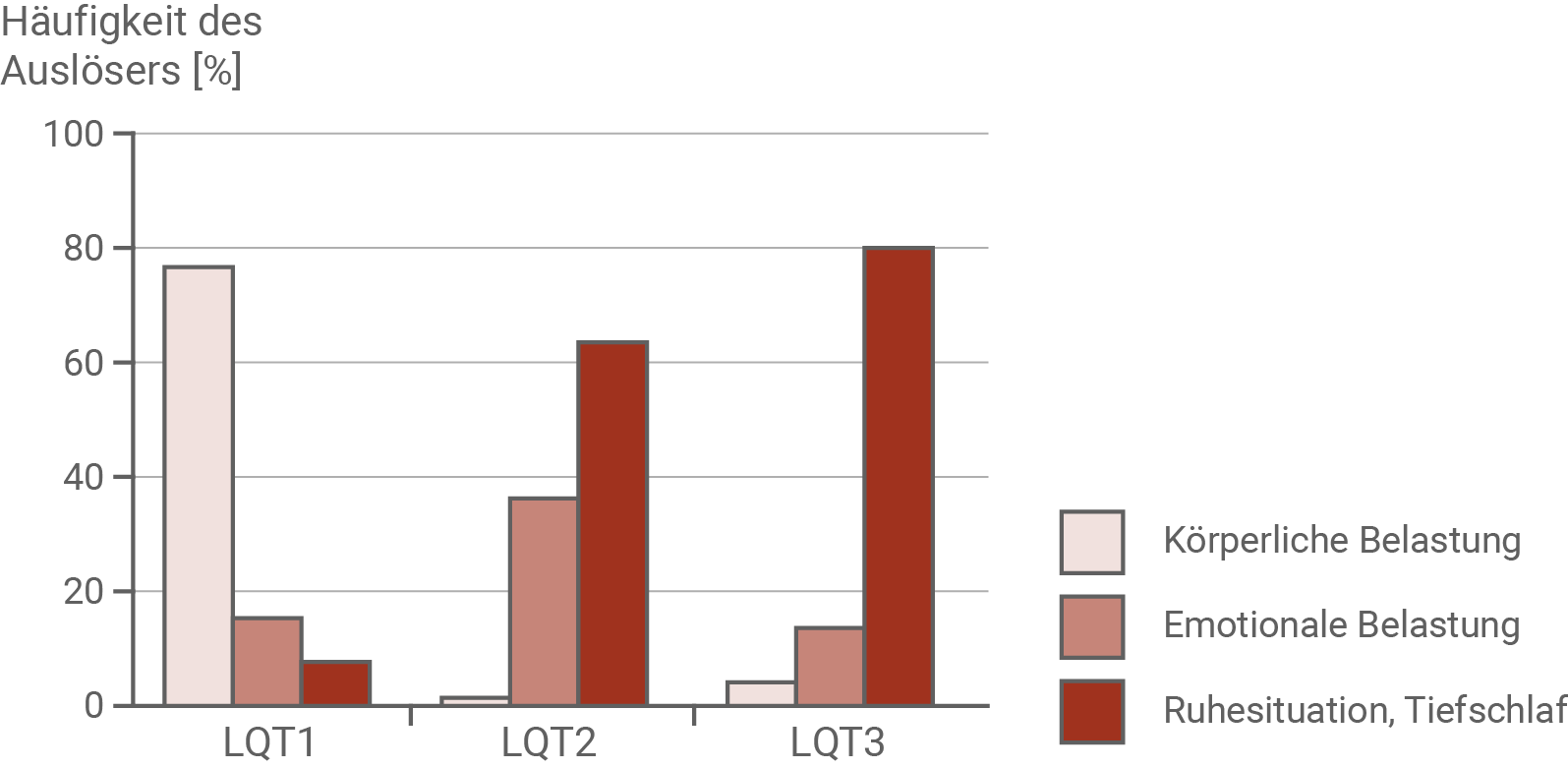
Obgleich es sich beim Long-QT-Syndrom um eine zeitlebens bestehende Anomalie der Herzmuskelzellen handelt, sind damit keine ständigen Symptome oder Beschwerden verbunden. Hierzu sind spezielle Auslöser erforderlich, die für jeden Long-QT-Typ unterschiedlich sind. Die situationsbedingt auftretenden Symptome unterscheiden sich allerdings nur wenig. Sie reichen von Herzrhythmusstörungen, Herzrasen bis zum Herzstillstand, d. h., sie können im Einzelfall durchaus lebensbedrohlich werden. Bei einem Long-QT-Syndrom ist es daher wichtig, das Risiko für einen tödlich verlaufenden Herzstillstand abzuschätzen. Neben Alter und Geschlecht wurden noch weitere Risikofaktoren ausgemacht.Häufigkeit verschiedener Auslöser für das Auftreten tödlicher Ereignisse bei drei verschiedenen LQT-Typen
Code-Sonne der mRNA

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Vorgänge während der Entstehung und dem Verlauf eines Aktionspotenzials:
- Depolarisation: Bei Reizung einer Nervenzelle öffnen sich anfangs wenige Natriumionenkanäle. Durch den Einstrom der Natriumionen ins Zellinnere wird die Spannung im Zellinneren von -70 mV auf -50 mV angehoben. Das Überschreiten dieses Schwellenwertes löst die Öffnung weiterer Natriumionenkanäle, und damit das Aktionspotenzial aus. Der starke Einstrom der Natriumionen führt zu einer Depolarisation des Membranpotenzials auf +30 mV.
- Repolarisation: Die spannungsabhängigen Natriumionenkanäle schließen, es strömen also keine weiteren Natriumionen ins Zellinnere. Etwas zeitversetzt öffnen Kaliumionenkanäle, durch die Kaliumionen aus der Zelle herausströmen. Es kann so eine erneute Ladungsumkehr (die Repolarisation) erzielt werden. Die Membranaußenseite ist nun wieder positiv, und die Membraninnenseite negativ geladen.
- Hyperpolarisation: Da die Kaliumionenkanäle nicht sofort schließen, wenn das Ruhepotenzial erreicht ist, strömen noch weitere Kaliumionen aus der Zelle aus, sodass ein Membranpotenzial von ca. - 90 mV erreicht wird. Die Kaliumionenkanäle schließen, und das Ruhepotenzial wird wieder eingestellt. Dies geschieht durch die Natrium-Kalium-Pumpe, die unter ATP-Verbrauch drei Natriumionen aus der Zelle heraus, und zwei Kaliumionen in die Zelle hinein pumpt. Die Zelle kann jetzt ein neues Aktionspotenzial ausbilden.
2
Zusammenhänge zwischen den Phasen 0 bis 4 eines Herzaktionspotenzials und den Ionenströmen unter Berücksichtigung der Konzentrationsgradienten:
Hinweis: Es genügt der Vergleich von zwei Aspekten.
- Phase 0: Die Schrittmacherzellen lösen einen elektrischen Impuls aus, der in der Herzmuskelzelle ein Aktionspotenzial hervorruft. Das Membranpotenzial steigt sprunghaft vom Ruhepotenzial bei -90 mV auf etwa +30 mV an. Diese Depolarisation wird durch einen kurzzeitigen und sehr starken Natrium-Ioneneinstrom entlang ihres Konzentrationsgefälles verursacht, der durch das Öffnen spannungsabhängiger Natrium-Ionenkanäle ausgelöst wird.
- Phase 1: Nach den ersten 10 ms nach Auslösen des Aktionspotenzials findet eine erste kurze Repolarsation auf etwa 0 mV statt. Das Membranpotenzial sinkt aufgrund einer Öffnung spannungsabhängiger Kalium-Ionenkanäle. Kaliumionen strömen kurzzeitig entlang ihres Konzentrationsgefälles aus der Zelle hinaus.
- Phase 2: Ein kurzzeitiger Einstrom von Calciumionen lässt das Membranpotenzial auf etwa +15 mV ansteigen. Die Depolarisation wird durch geöffnete spannungsabhängige Calcium-Ionenkanäle ausgelöst. Ab dann sinkt das Membranpotenzial über eine relativ lange Zeit von 250 ms auf ein Membranpotenzial von -20 mV ab. Dabei werden spannungsabhängige Kalium-Ionenkanäle geöffnet und Kaliumionen folgen ihrem Konzentrationsgefälle, und strömen aus der Zelle aus. Dabei werden zunächst wenige Kanäle geöffnet, und erst etwa 80 ms nach Beginn des Aktionspotenzials erreicht der Kaliumausstrom seinen Höhepunkt. Dass die Membran zu Beginn von Phase 2 nur langsam repolarisiert, liegt an den einströmenden Calciumionen. Die Calcium-Ionenkanäle schließen sukzessive, der Einstrom der Calciumionen kommt zum Erliegen und die Membran wird durch die einströmenden Kaliumionen stärker depolarisiert.
- Phase 3: 250 ms nach Auslösen des Aktionspotenzials sinkt das Membranpotenzial auf eine Spannung von -90 mV, dem Wert des Ruhepotenzials. Dieser Prozess wird durch die nach wie vor geöffneten Kalium-Ionenkanäle ausgelöst. Natriumionen folgen ihrem Konzentrationsgefälle aus der Zeller heraus, bis die Kanäle nach und nach wieder schließen.
- Phase 4: Etwa 310 ms nach Auslösen des Aktionspotenzials ist das Ruhepotenzial von -90 mV wieder hergestellt. Durch die Aktivität der Natrium-Kalium-Pumpe werden je drei Natriumionen aus der Zeller heraus und zwei Kaliumionen in die Zelle hinein gepumpt. Die Calcium-Ionenpumpe befördert Calciumionen aus dem Zellinneren in den Extrazellularraum.
| Aspekte | neuronales Aktions- potenzial |
Herz- aktions- potenzial |
|---|---|---|
| Dauer in ms |
1–2 | 400 |
| Repolarisations- phase |
kurz, in einem Schritt, starkes Absinken der Spannung |
lang, mehrstufig |
| Calcium- Ionenaustausch |
nein | ja |
| Hyper- polarisation unter das Ruhepotenzial |
ja | nein |
| Calcium- Ionenpumpen |
nein | ja |
| Ruhepotenzial in mV |
-70 | -90 |
3
Ablauf der Translation:
Bei der Translation wird eine reife mRNA Nukleotidsequenz an den Ribosomen in eine Aminosäuresequenz übersetzt. Dabei wird eine Polypeptidkette bzw. ein Protein synthetisiert.
Die reife mRNA-Sequenz wird durch die Kernporen ins Cytoplasma transportiert. Dort lagert sich zunächst die kleine ribosomale Untereinheit an die mRNA an. Sie wandert in 3'  5'-Richtung die mRNA entlang, bis sie auf eine tRNA trifft, die eine Bindung an das Startcodon eingeht. Nun lagert sich die große ribosomale Untereinheit an die mRNA an. An jedes aus einem Basentriplett bestehendes Codon der mRNA kann eine tRNA mit entsprechendem Anticodon binden. Je nachdem, welches Triplett vorliegt, lagert sich eine tRNA, die mit einer spezifischen Aminosäure beladen ist, an die mRNA an. Zu Beginn des Prozesses befindet sich die tRNA, welche komplementär zum Startcodon ist, in der P-Stelle. Die nächste tRNA kann sich an die A-Bindungsstelle anlagern. Dabei wird die wachsende Polypeptidkette immer auf die tRNA in der A-Bindungsstelle übertragen. Die nun unbeladene tRNA wird in die E-Stelle verschoben, und verlässt das Ribosom im nächsten Schritt. Die einzelnen Aminosäuren werden so nach und nach durch Peptidbindungen zu einem Polypeptid verknüpft. Der Prozess endet, sobald das Ribosom auf ein Stopcodon trifft. Das Ribosom löst sich von der mRNA und zerfällt in seine Untereinheiten. Die freigesetzte Polypeptidkette faltet sich nun in ihre endgültige Konformation.
5'-Richtung die mRNA entlang, bis sie auf eine tRNA trifft, die eine Bindung an das Startcodon eingeht. Nun lagert sich die große ribosomale Untereinheit an die mRNA an. An jedes aus einem Basentriplett bestehendes Codon der mRNA kann eine tRNA mit entsprechendem Anticodon binden. Je nachdem, welches Triplett vorliegt, lagert sich eine tRNA, die mit einer spezifischen Aminosäure beladen ist, an die mRNA an. Zu Beginn des Prozesses befindet sich die tRNA, welche komplementär zum Startcodon ist, in der P-Stelle. Die nächste tRNA kann sich an die A-Bindungsstelle anlagern. Dabei wird die wachsende Polypeptidkette immer auf die tRNA in der A-Bindungsstelle übertragen. Die nun unbeladene tRNA wird in die E-Stelle verschoben, und verlässt das Ribosom im nächsten Schritt. Die einzelnen Aminosäuren werden so nach und nach durch Peptidbindungen zu einem Polypeptid verknüpft. Der Prozess endet, sobald das Ribosom auf ein Stopcodon trifft. Das Ribosom löst sich von der mRNA und zerfällt in seine Untereinheiten. Die freigesetzte Polypeptidkette faltet sich nun in ihre endgültige Konformation.
4
Analyse des Stammbaums zum Long-QT-Syndrom:
- Eine X-chromosomale Vererbung kann ausgeschlossen werden, da die Tochter (7) merkmalsfrei ist. Anderenfalls hätte sie von ihrem Vater zwingend das betroffene X-Chromosom geerbt.
- Von der Krankheit sind sowohl Männer als auch Frauen betroffen, wobei das Geschlechterverhältnis gleich ist. Man kann somit auch einen Y-chromosomalen Erbgang ausschließen. Vermutlich liegt also ein autosomaler Erbgang vor.
- Die von dem Long-QT Syndrom betroffenen Eltern (3 und 4) haben eine gesunde Tochter (7). Dies ist nur dann möglich, wenn die Krankheit dominant vererbt wird, da das Kind so von jedem der heterozygoten Elternteile ein nicht-mutiertes Allel erben kann.
- Die Krankheit wird somit autosomal-dominant vererbt.
- Es wurde A für ein mutiertes Allel und a für ein nicht-mutiertes Allel gewählt.
- Person 1 kann den Genotyp Aa oder AA haben.
- Person 5 muss den Genotyp Aa besitzen, egal ob seine Mutter (Person 1) den Genotyp AA oder Aa hat.
- Person 7 muss den Genotyp aa haben, da zwar beide Eltern von der Krankheit betroffen sind, die Person selbst aber gesund ist.
5
Angabe der Sequenz des codogenen DNA-Strangs, der mRNA-Sequenz und der Aminosäuresequenz (ASS) bei einem Patienten mit LQT1:
Mutationstyp und Folge der Mutation für die Primärstruktur des Proteins bei LQT1:
Im vierten Triplett in der zweiten Position wurde die Base Cytosin (im codogenen Strang) gegen Thymin getauscht (Substitution). Es liegt somit eine Punktmutation vor. Im Normalfall codiert dieses Triplett für die Aminosäure Arginin, durch die Mutation wird jedoch Glutamin eingebaut. Dies führt zu einer Missense-Mutation, da die eingebaute Mutation ein Protein mit veränderten Eigenschaften erzeugt.
Mutationstyp und Folge der Mutation für die Primärstruktur des Proteins bei LQT3:
Hier liegt eine Substitution der ersten Base des vierten Tripletts vor. Beim nicht mutierten Gen ist im codogenen Strang die Base Cytosin enthalten, durch die Mutation wurde allerdings die Base Thymin eingebaut. Als Konsequenz wird in der Aminosäuresequenz Alanin statt Threonin eingebaut. Somit handelt es sich auch hier um eine Missense-Mutation, die eine Funktionsveränderung des synthetisierten Proteins hervorruft.
| codogener Strang |
3'... GTG AAG TTG GTC GTC TAG GGC ... 5' |
|---|---|
| mRNA | 5'... CAC UUC AAC CAG CAG AUC CCG ... 3' |
| ASS | ... His - Phe - Asn - Gln - Gln - Ile - Pro ... |
6
Zusammenhänge zwischen der zugrunde liegenden Mutation, den Besonderheiten eines Herzaktionspotenzials und des EKGs eines Patienten mit LQT1:
Beim Herzaktionspotenzial eines gesunden Menschen verläuft die Repolarisation in Phase 3 schnell, wobei die Spannung rapide sinkt. Bei Betroffenen von LQT1 ist dieser Vorgang deutlich verzögert, und von einer längeren Dauer. Im EKG zeigt sich dies in einer ausgedehnten QT-Zeit. Dies ist damit zu erklären, dass Patienten mit LQT1 eine Mutation im KCNQ1-Gen aufweisen. Dieses Gen codiert für die Kalium-Ionenkanäle, die im Normalfall für die Repolarisation verantwortlich sind. Durch die Mutation sind die Kalium-Ionenkanäle jedoch so in ihrer Funktion beeinträchtigt, dass weniger Kaliumionen pro Zeiteinheit ausströmen können, die Repolarisation erschwert, und die QT-Zeit verlängert wird.
Hypothese zur Erklärung des Verlaufs eines Aktionspotenzials bei einem Patienten mit LQT3:
Bei LQT3 Patienten sind spannungsabhängige Natrium-Ionenkanäle in ihrer Funktion beeinträchtigt. Im Normalzustand öffnen und schließen sich die Kanäle innerhalb einer kurzen Zeitspanne von 10 ms. Natrium-Ionenkanäle von betroffenen Personen benötigen jedoch ca. 60 ms, um sich zu schließen. Durch diese Beeinträchtigung der Natrium-Ionenkanäle können viel mehr Natriumionen einströmen, als gewöhnlich. Die Spannung steigt dadurch auf +30 mV. Im Vergleich zu gesunden Menschen, bei denen die Repolarisationsphase ca. 300 ms einnimmt, dauert bei Betroffenen die Repolarisation etwa 200 ms länger. Ziel der Repolarisation ist es, das Ruhepotenzial der Zelle wieder herzustellen. Strömen mehr Natriumionen in die Zelle ein, so müssen auch mehr Kaliumionen aus der Zelle ausströmen, um dieses Ziel zu erreichen. Dieser Prozess nimmt dementsprechend mehr Zeit in Anspruch, was sich wiederum in einem verlängerten Aktionspotenzial zeigt.
7
Der Einfluss von Adrenalin auf die Herzmuskelzelle:
Die Abbildung zeigt ein Ausschnitt der Membran einer Herzmuskelzelle. In die Membran sind ein Beta-Rezeptor und Calcium-Ionenkanäle in Form integraler Membranproteine eingelagert. Auf der Membraninnenseite sind ein G-Protein, und das Enzym Adenylatzyklase als integrale Proteine verankert. Im Zelllumen ist das Enzym Proteinkinase A vorhanden. Bindet das Hormon Adrenalin an den Beta-Rezeptor auf der Membranaußenseite, so wird das G-Protein an der Membraninnenseite aktiviert. Dieser Prozess aktiviert wiederum die Adenylatzyklase, welche die Umwandlung von ATP in cAMP katalysiert. Das gebildete cAMP bindet an die Proteinkinase A, welche dadurch aktiviert wird. Dadurch bindet ein Phosphatrest an einen Calcium-Ionenkanal auf der Membraninnenseite. Die Phosphorylierung bewirkt eine Öffnung des Kanals, wodurch Calciumionen in die Herzmuskelzelle einströmen. Die Erhöhung der Konzentration der Calciumionen auf der Membraninnenseite führt zu einer verstärkten Kontraktion der Herzmuskelzelle.
8
Wirkmechanismus von Betablockern zur Normalisierung des EKGs beim LQT1:
Betablocker sind in der Lage, an die Beta-Rezeptoren an der Außenseite der Membran einer Herzmuskelzelle zu binden. Dadurch wird deren Funktion außer Kraft gesetzt, und die Signalkaskade zur Öffnung der Calcium-Ionenkanäle kann nicht mehr ablaufen. Es gelangen dadurch weniger Calciumionen in die Herzmuskelzelle und die Stärke der Kontraktion der Herzmuskelzelle nimmt ab. Bei einem normalen Herzaktionspotenzial strömen Calciumionen ins Zellinnere ein, und verstärken dadurch die Depolarisation. Um das Ruhepotenzial durch Repolarisation wiederherzustellen, strömen Kalium-Ionen aus der Zelle hinaus. Bei Betroffenen von LQT1 ist dieser Kalium-Ionenausstrom behindert, was zu einer verlängerten Repolarisationsphase führt. Wird durch Betablocker der Calcium-Ioneneinstrom herabgesetzt, so müssen weniger Kaliumionen aus der Zelle ausströmen. Der durch die Mutation hervorgerufene Kanaldefekt kann durch die Betabocker ausgeglichen werden, da der Calcium-Ioneneinstrom herabgesetzt wird, und weniger Kaliumionen ausströmen müssen. Die Repolarisation läuft durch den Einsatz der Betablocker schneller ab, die QT Zeit wird verringert, und das EKG gleicht dem eines nicht betroffenen Menschen.
9
Wirksamkeit von Betablockern zur Vorbeugung eines Herzstillstandes bei den verschiedenen LQT-Typen:
Das Hormon Adrenalin wird im Nebennierenmark gebildet, und in emotionalen oder körperlichen Stresssituationen ins Blut abgegeben. In den Herzmuskelzellen bewirkt es einen verstärkten Calcium-Ioneneinstrom, was wiederum die Kontraktionskraft der Herzmuskelzellen erhöht. Betablocker schwächen diesen Vorgang ab. Dadurch kann in Situationen, in denen vom Körper Adrenalin freigesetzt wird, die Belastung für das Herz verringert werden.
 Es ist also zu erwarten, dass die Verabreichung von Betablockern bei Patienten mit LQT1-Typ am erfolgreichsten sein wird, da hier vor allem körperliche und emotionale Belastungen für einen tödlichen Herzstillstand verantwortlich sind. Auch bei Typ 2 ist eine positive Wirkung der Betablocker zu erwarten, da hier auch häufig emotionale Belastungen zu einem Herzstillstand führen. Beim LQT3-Typ hingegen werden die Betablocker nur geringfügig wirksam sein, da ein Herzstillstand meist in Ruhesituationen eintritt.
Es ist also zu erwarten, dass die Verabreichung von Betablockern bei Patienten mit LQT1-Typ am erfolgreichsten sein wird, da hier vor allem körperliche und emotionale Belastungen für einen tödlichen Herzstillstand verantwortlich sind. Auch bei Typ 2 ist eine positive Wirkung der Betablocker zu erwarten, da hier auch häufig emotionale Belastungen zu einem Herzstillstand führen. Beim LQT3-Typ hingegen werden die Betablocker nur geringfügig wirksam sein, da ein Herzstillstand meist in Ruhesituationen eintritt.
- Beim LQT1-Typ sind in nahezu 80 % aller Fälle körperliche Belastungen die Ursache für einen Herzstillstand. Etwa 15 % entfallen auf emotionale Belastungen und ca. 5 % auf Ruhesituationen.
- Beim LQT2-Typ wird ein tödlicher Herzstillstand in 60 % aller Fälle bei Ruhesituationen, knapp unter 40 % aller Fälle durch emotionale Belastung und nur äußert selten durch körperliche Belastung ausgelöst.
- Beim LQT3-Typ sind Ruhesituationen mit 80 % der Hauptauslöser für einen tödlichen Herzstillstand. Nur in 15 % aller Fälle wird ein Herzstillstand durch emotionale Belastung und in etwa 5 % durch körperliche Belastung hervorgerufen.