Teil B
1
Material 1: Lithiumgewinnung aus Mineralien
Der Hauptanteil der Lithiumproduktion wird zur Herstellung von Akkumulatoren verwendet. Angesichts steigender Weltmarktpreise sind die Lagerstätten in Deutschland zur Gewinnung von Lithium in den Vordergrund gerückt. Abbaubare Mineralien bei Zinnwald im Erzgebirge enthalten ca.  Lithium.
Lithium.
Die Gewinnung des Lithiums erfolgt schrittweise.
Ein wichtiger Schritt (I) ist die Bildung von Lithiumcarbonat. Hierbei kommt es durch die zusätzliche Entstehung von Lithiumhydrogencarbonat zu Verunreinigungen. Über die Beeinflussung des Über die Beeinflussung des -Gleichgewichts (II) wird möglichst reines Lithiumcarbonat erzeugt. Die Zersetzung des
-Gleichgewichts (II) wird möglichst reines Lithiumcarbonat erzeugt. Die Zersetzung des  erfolgt in einer endothermen Reaktion.
erfolgt in einer endothermen Reaktion.






Die Gewinnung des Lithiums erfolgt schrittweise.
Ein wichtiger Schritt (I) ist die Bildung von Lithiumcarbonat. Hierbei kommt es durch die zusätzliche Entstehung von Lithiumhydrogencarbonat zu Verunreinigungen. Über die Beeinflussung des Über die Beeinflussung des
(I)
(II)
1.1
Bestimme alle Oxidationszahlen in den angegebenen Lithiumverbindungen.
(03 BE)
1.2
Leite aus dem Bau des Lithiumcarbonats den Aggregatzustand bei  ab.
ab.
(02 BE)
1.3
Berechne die Masse an Lithiumcarbonat, die bei der Reaktion von  Lithiumhydroxid entsteht.
Lithiumhydroxid entsteht.
(02 BE)
1.4
Ermittle rechnerisch die molare Standardreaktionsenthalpie für die Gewinnung von Lithiumcarbonat aus Lithiumhydroxid. Gib den energetischen Verlauf der Reaktion an.
(03 BE)
1.5
Beurteile den Wahrheitsgehalt folgender Aussagen hinsichtlich der Beeinflussung des  -Gleichgewichts (M1).
-Gleichgewichts (M1).
A)
Die Entfernung des Kohlenstoffdioxids aus dem Gleichgewicht führt zu einer verstärkten Bildung des Lithiumcarbonats.
B)
Eine Druckveränderung hat keinen Einfluss auf die Gleichgewichtslage.
C)
Durch eine Temperaturerhöhung steigt die Ausbeute des Lithiumcarbonats.
(03 BE)
2
Material 2: Lithiumgewinnung aus Thermalwasser
Durch ein Verfahren der Geothermie wird heißes Tiefenwasser (Thermalwasser) seit Jahren zur Stromversorgung und Bereitstellung von Wärme genutzt. Vielfältige Untersuchungen der letzten Jahre haben ergeben, dass das Thermalwasser Lithium-Ionen enthält. Das Thermalwasser wird nach der Gewinnung der Lithium-Ionen vor Ort in einem Kreislaufprozess wieder in den Boden zurückgeleitet. Es kommt aus dem Kreislauf heraus zu keiner  -Emission. Lange Transportwege werden vermieden.
Chemische Parameter des Tiefenwassers des Oberrheingrabens bei Bruchsal
pH-Wert:
-Emission. Lange Transportwege werden vermieden.
Chemische Parameter des Tiefenwassers des Oberrheingrabens bei Bruchsal
pH-Wert: 
| Ionen | |
| Chlorid | |
| Natrium | |
| Calcium | |
| Kalium | |
| Lithium | |
| Hydrogencarbonat |
(Quelle der Daten_KIT,2010 \& G.E.I.E.,2010)
2.1
Begründe die Gewinnung von Lithium-Ionen aus dem Tiefenwasser des Oberrheingrabens aus ökologischer und ökonomischer Sicht.
(02 BE)
2.2
Beschreibe für zwei Parameter (M2) des Tiefenwassers jeweils einen Nachweis.
(04 BE)
3
Lithiumethanoat  Lithiumacetat,
Lithiumacetat,  wird als Katalysator bei der Herstellung verschiedener Polymere (z. B. Polyester) verwendet. Die Darstellung von Lithiumethanoat erfolgt entweder aus Lithiumhydroxid und Ethansäure oder Lithiumcarbonat und Ethansäure.
wird als Katalysator bei der Herstellung verschiedener Polymere (z. B. Polyester) verwendet. Die Darstellung von Lithiumethanoat erfolgt entweder aus Lithiumhydroxid und Ethansäure oder Lithiumcarbonat und Ethansäure.
3.1
Entwickle die Reaktionsgleichungen für die beiden Darstellungen des Lithiumethanoats.
(02 BE)
3.2
Erkläre die Reaktion der Ethansäure mit Wasser als Säure-Base-Reaktion nach der Theorie von BRØNSTED. Berechne den pH-Wert einer Ethansäurelösung mit der Stoffmengenkonzentration 
(05 BE)
3.3
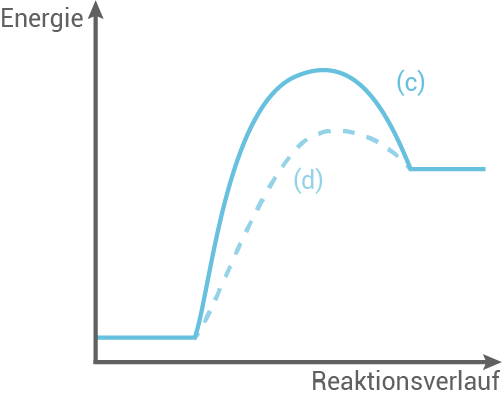
Die Diagramme 1 und 2 zeigen grafische Darstellungen für jeweils eine chemische Reaktion mit und ohne Katalysator.
Nenne zwei Merkmale eines Katalysators.
Ordne eine der vier Kurven einer endotherm verlaufenden Reaktion mit Katalysator zu. Begründe deine Zuordnung.
Diagramm 1:
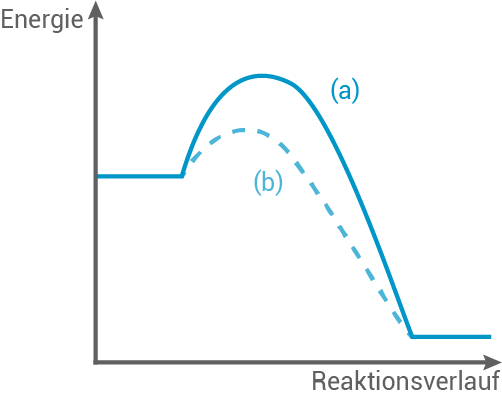 Diagramm 2:
Diagramm 2:


(04 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Oxidationszahlen in den angegebenen Lithiumverbindungen
1.2
Aggregatzustand bei  Lithiumcarbonat
Lithiumcarbonat  ist ein Salz, welches ionische Bindungen zwischen den Lithium-Ionen
ist ein Salz, welches ionische Bindungen zwischen den Lithium-Ionen  und den Carbonat-Ionen
und den Carbonat-Ionen  aufweist. Diese starke ionische Bindung führt dazu, dass Lithiumcarbonat bei Raumtemperatur
aufweist. Diese starke ionische Bindung führt dazu, dass Lithiumcarbonat bei Raumtemperatur  fest ist.
fest ist.
1.3
Berechnung der Masse an Lithiumcarbonat
Die Reaktionsgleichung für die Reaktion von Lithiumhydroxid lautet:
Zunächst wird die die Stoffmenge an Lithiumhydroxid berechnet:
![\(\begin{array}[t]{rll}
n(LiOH)&=& \dfrac{m(LiOH)}{M(LiOH)} & \\[5pt]
&=& \dfrac{1\ 000\,\text{g}}{23,9\, \text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx& 41,8 \, \text{mol}
\end{array}\)](https://mathjax.schullv.de/457e5c4a4291473d630758174a1f77f5e20f3d59532ed6097744dd97d0ebd027?color=5a5a5a) Aus der Reaktionsgleichung folgt das Stoffmengenverhältnis:
Aus der Reaktionsgleichung folgt das Stoffmengenverhältnis:


 Es gilt:
Es gilt:
![\(\begin{array}[t]{rll}
n(LiOH) &=& 2 \cdot (Li_2CO_3) & \\[5pt]
n (Li_2CO_3) &=& \dfrac{n(LiOH)}{2} & \\[5pt]
&=& \dfrac{41,8 \, \text{mol}}{2} & \\[5pt]
&=& 20,9 \, \text{mol} & \\[5pt]
\end{array}\)](https://mathjax.schullv.de/90b8c73125efc9eedd8ed45a30508e0052c32a6e0aa09273a3b0fe91be3b801b?color=5a5a5a) Daraus folgt für die Masse an Lithiumhydroxid:
Bei der Reaktion von
Daraus folgt für die Masse an Lithiumhydroxid:
Bei der Reaktion von  Lithiumhydroxid entstehen etwa
Lithiumhydroxid entstehen etwa  Lithiumcarbonat.
Lithiumcarbonat.
1.4
Ermittlung der molaren Standardreaktionsenthalpie
Für die Reaktionsenthalpie  gilt:
Mit den aus dem Anhang entnommenen Werten ergibt sich:
Die molare Standardreaktionsenthalpie für die Gewinnung von Lithiumcarbonat aus Lithiumhydroxid beträgt
gilt:
Mit den aus dem Anhang entnommenen Werten ergibt sich:
Die molare Standardreaktionsenthalpie für die Gewinnung von Lithiumcarbonat aus Lithiumhydroxid beträgt  Energetischer Verlauf
Die ermittelte molare Standardreaktionsenthalpie ist negativ, womit die Reaktion exotherm ist. Das heißt, es wird Energie in Form von Wärme frei.
Energetischer Verlauf
Die ermittelte molare Standardreaktionsenthalpie ist negativ, womit die Reaktion exotherm ist. Das heißt, es wird Energie in Form von Wärme frei.
1.5
Beurteilung des Wahrheitsgehalts
A)
Die Entfernung des Kohlenstoffdioxids aus dem Gleichgewicht führt zu einer verstärkten Bildung des Lithiumcarbonats.
Die Aussage ist richtig.
Durch die Entfernung von wird das Gleichgewicht nach rechts verschoben, was die Bildung von
wird das Gleichgewicht nach rechts verschoben, was die Bildung von  begünstigt.
begünstigt.
Durch die Entfernung von
B)
Eine Druckveränderung hat keinen Einfluss auf die Gleichgewichtslage.
Die Aussage ist falsch.
Eine Druckerhöhung würde das Gleichgewicht nach rechts verschieben, da die Anzahl der Gasmoleküle abnimmt.
Eine Druckerhöhung würde das Gleichgewicht nach rechts verschieben, da die Anzahl der Gasmoleküle abnimmt.
C)
Durch eine Temperaturerhöhung steigt die Ausbeute des Lithiumcarbonats.
Die Aussage ist falsch.
Da die Zersetzung des endotherm ist, würde eine Temperaturerhöhung das Gleichgewicht nach links verschieben.
endotherm ist, würde eine Temperaturerhöhung das Gleichgewicht nach links verschieben.
Da die Zersetzung des
2.1
Begründung der Gewinnung von Lithium-Ionen
| Ökologische Sicht | Ökonomische Sicht |
|---|---|
|
|
2.2
Nachweise für zwei Parameter des Tiefenwassers
- Nachweis von Chlorid-Ionen
Chlorid-Ionen können mit dem Silbernitrat-Test nachgewiesen werden. Dabei reagieren die-Ionen mit einer Silbernitratlösung und bilden einen weißen Niederschlag von Silberchlorid.
- Nachweis von Calcium-Ionen
: Der Nachweis von
erfolgt über den Oxalat-Test. Die Ionen reagieren hierbei mit einer Ammoniumoxalatlösung und bildet einen weißen Niederschlag von Calciumoxalat.
3.1
Reaktionsgleichungen für beide Darstellungen von Lithiumethanoat
- Aus Lithiumhydroxid und Ethansäure:
- Aus Lithiumcarbonat und Ethansäure:
3.2
Erklärung der Reaktion von Ethansäure mit Wasser
Ethansäure ist eine schwache Säure und dissoziiert demnach nur teilweise. Die Konzentration der undissoziierten Säure in guter Näherung als konstant gleich der Anfangskonzentration an
Ethansäure reagiert wie folgt mit Wasser:


 Nach BRØNSTED ist Ethansäure
Nach BRØNSTED ist Ethansäure  eine Säure, da sie ein Proton
eine Säure, da sie ein Proton  an Wasser
an Wasser  abgeben kann. Wasser wirkt demnach als BRØNSTED-Base, da es das Proton aufnimmt.
Berechnung des pH-Werts
Zunächst gilt:
abgeben kann. Wasser wirkt demnach als BRØNSTED-Base, da es das Proton aufnimmt.
Berechnung des pH-Werts
Zunächst gilt:
![\(K_S = \dfrac{[CH_3COO^-] \cdot [H^+]}{[CH_3COOH]}\)](https://mathjax.schullv.de/d6d3ce79f61d68a203ca34499dabafa94b9ca8271ef73ba2aec340d09c6f72cc?color=5a5a5a) Da Ethansäure eine schwache Säure ist, dissoziiert nur ein kleiner Teil der Säuremoleküle. Daher ist die Konzentration der undissoziierten Säure bei Gleichgewicht nahezu gleich der anfänglichen Konzentration.
Demnach gilt weiterhin:
Da Ethansäure eine schwache Säure ist, dissoziiert nur ein kleiner Teil der Säuremoleküle. Daher ist die Konzentration der undissoziierten Säure bei Gleichgewicht nahezu gleich der anfänglichen Konzentration.
Demnach gilt weiterhin:
![\(K_S = \dfrac{[H^+]^2}{[CH_3COOH]}\)](https://mathjax.schullv.de/486c02f8807a5bcf642a0032bd89e4c7aa00d9489a017ac683c0283b7330b7ca?color=5a5a5a) Daraus folgt:
Nun kann der pH-Wert berechnet werden:
Daraus folgt:
Nun kann der pH-Wert berechnet werden:
![\(\begin{array}[t]{rll}
pH&=& -\log [H^+] & \\[5pt]
&=& -\log (0,00189) & \\[5pt]
&=& 2,72
\end{array}\)](https://mathjax.schullv.de/0dbe3d0b366dd347428f924e83afca0c1ca3c3ee9b5b8a3c3e517b715c7b8cf1?color=5a5a5a) Der pH-Wert der Ethansäurelösung mit einer Konzentration von
Der pH-Wert der Ethansäurelösung mit einer Konzentration von  beträgt
beträgt 
3.3
Zwei Merkmale eines Katalysators:
- Ein Katalysator beschleunigt die Reaktionsgeschwindigkeit, indem er die Aktivierungsenergie der Reaktion senkt.
- Ein Katalysator wird während der Reaktion nicht verbraucht und geht unverändert bzw. unverbraucht aus der Reaktion heraus.