Teil B – Ammoniumnitrat
Am 4. August 2020 ereignete sich in der libanesischen Hauptstadt Beirut eine folgenschwere Explosion. Die Ursache war ein durch Schweißarbeiten verursachtes Feuer in einem Lagerraum für Feuerwerkskörper, das ca.  Tonnen daneben gelagertes Ammoniumnitrat zur Explosion brachte.
Tonnen daneben gelagertes Ammoniumnitrat zur Explosion brachte.
1
Bestimme die Oxidationszahlen der Stickstoffatome im Ammoniumnitrat.
Begründe diese mithilfe deiner Kenntnisse über den Atombau.
Begründe diese mithilfe deiner Kenntnisse über den Atombau.
(03 BE)
2
Ammoniumnitrat gehört zur Stoffklasse der Ionensubstanzen.
Beschreibe den Bau und die Bindungsverhältnisse der Ionensubstanzen.
Leite aus dem Bau zwei Eigenschaften ab.
Leite aus dem Bau zwei Eigenschaften ab.
(04 BE)
3
Ein möglicher Syntheseweg zur Herstellung von Ammoniumnitrat ist in folgender Übersicht dargestellt. Bei den Reaktionen 1 bis 4 handelt es sich um Gleichgewichtsreaktionen.
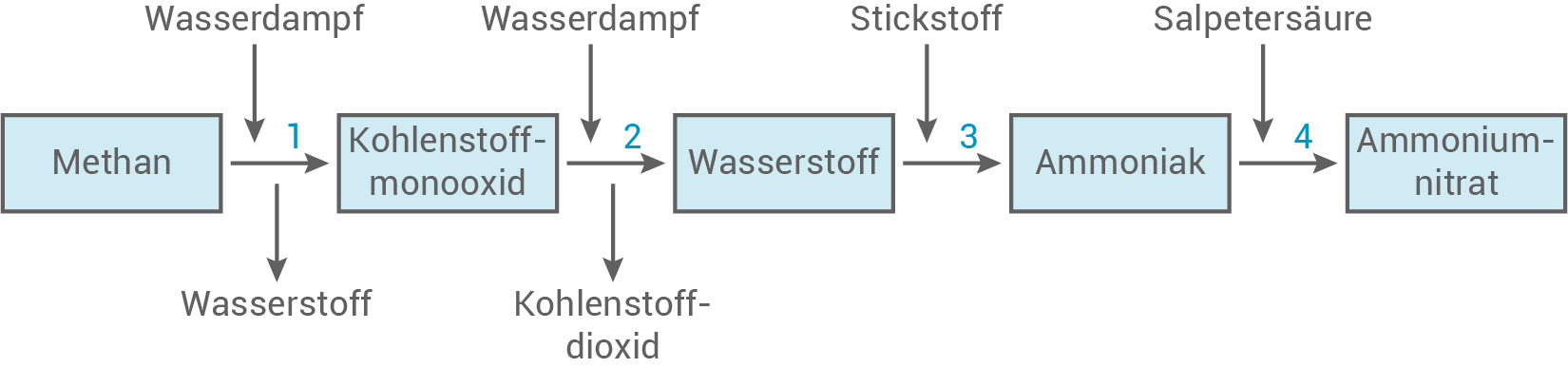

3.1
Nenne zwei Merkmale des chemischen Gleichgewichts.
(02 BE)
3.2
Der Reaktionsschritt 2 wird als Konvertierung bezeichnet.



 Begründe zwei Maßnahmen, um den Anteil an Kohlenstoffmonooxid im chemischen Gleichgewicht zu verringern.
Begründe zwei Maßnahmen, um den Anteil an Kohlenstoffmonooxid im chemischen Gleichgewicht zu verringern.
(02 BE)
3.3
Berechne mithilfe des Massenwirkungsgesetzes die Stoffmenge an Wasserstoff, die bei der Konvertierung im chemischen Gleichgewicht vorliegt, wenn  Kohlenstoffmonooxid und
Kohlenstoffmonooxid und  Wasserdampf als Ausgangsstoffe eingesetzt werden.
Wasserdampf als Ausgangsstoffe eingesetzt werden.
Die Gleichgewichtskonstante beträgt
Die Gleichgewichtskonstante beträgt
(03 BE)
3.4
Entwickle für alle anderen Reaktionsschritte die Reaktionsgleichungen.
Wähle eine der Aufgaben 4 oder 5 aus und bearbeite diese.
(03 BE)
4
Durch eine starke Initialzündung, wie bei der Explosion von Beirut, reagiert Ammoniumnitrat zu Wasserdampf, Stickstoff und Sauerstoff. Die enorme Sprengkraft von Ammoniumnitrat ist auf die Entstehung gasförmiger Reaktionsprodukte zurückzuführen.



4.1
Berechne die molare Standardreaktionsenthalpie.
(02 BE)
4.2
Berechne das Volumen der gasförmigen Reaktionsprodukte bei  wenn
wenn  Ammoniumnitrat zerfällt. Das molare Volumen von Gasen beträgt unter diesen Bedingungen
Ammoniumnitrat zerfällt. Das molare Volumen von Gasen beträgt unter diesen Bedingungen 
(02 BE)
5
Erläutere den Nachweis der Ammonium-Ionen im Ammoniumnitrat.
(04 BE)
6
Ammoniumchlorid findet u. a. Anwendung als Elektrolyt in Zink-Kohle-Batterien. Dieses Primärelement ist eine zuverlässige Energiequelle. Die Abbildung zeigt vereinfacht den Aufbau einer Zink-Kohle-Batterie.
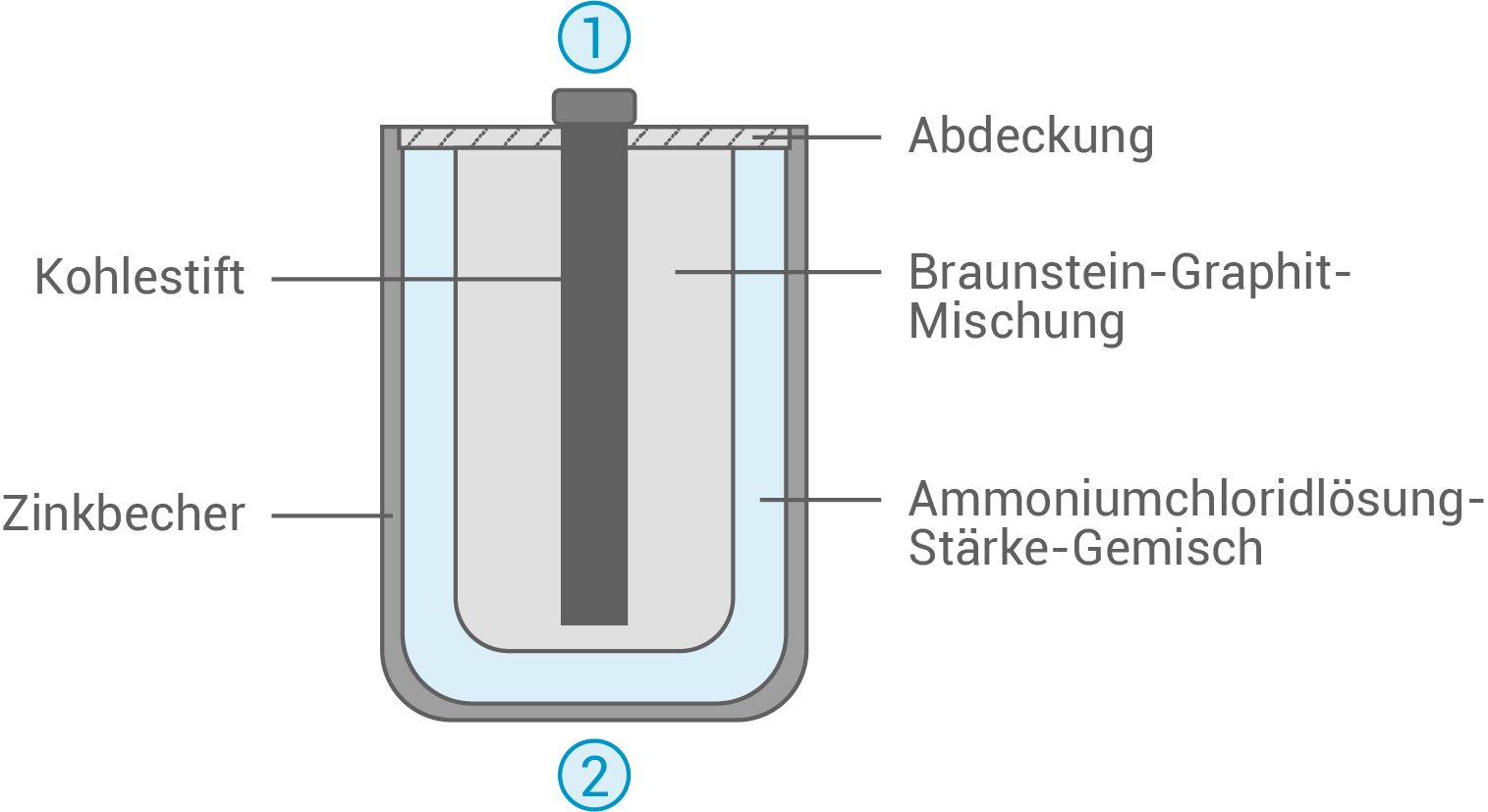

6.1
Ordne den Ziffern 1 und 2 die Begriffe Pluspol und Minuspol zu.
(01 BE)
6.2
An der Kathode läuft vereinfacht die folgende Reaktion ab.


 Entwickle die Reaktionsgleichungen für die Anodenreaktion und die Gesamtreaktion in dieser Batterie.
Entwickle die Reaktionsgleichungen für die Anodenreaktion und die Gesamtreaktion in dieser Batterie.
(02 BE)
6.3
In der Zink-Kohle-Batterie wird Braunstein mit Graphitpulver versetzt und die Ammoniumchloridlösung mit Stärke eingedickt.
Begründe eine dieser Maßnahmen.
(01 BE)
7
Zink wird u.a. durch Elektrolyse einer Zink -salzlösung hergestellt.
-salzlösung hergestellt.
7.1
Berechne die Masse an Zink, die in  Stunden bei einer Stromstärke von
Stunden bei einer Stromstärke von  abgeschieden wird.
abgeschieden wird.
(02 BE)
7.2
Vergleiche die Vorgänge in einer galvanischen Zelle mit denen in einer Elektrolysezelle hinsichtlich Reaktionsart, Freiwilligkeit des Reaktionsablaufs und Energieumwandlung.
(03 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1
Oxidationszahlen der Stickstoffatome im Ammoniumnitrat
- Ein Stickstoffatom verfügt über fünf Valenzelektronen, wodurch es entweder drei Elektronen aufnehmen oder fünf Elektronen abgeben kann, um die Oktettregel zu erfüllen.
- Die Oxidationszahl eines Atoms ergibt sich aus der tatsächlichen Ladung oder aus der quasi gedachten Ladung aufgrund der Polarität der chemischen Bindungen.
- Das Ammonium-Ion erreicht durch die Abgabe von drei Elektronen die Elektronenkonfiguration des Neonatoms und besitzt die Oxidationsstufe -3.
- Das Nitrat-Ion erreicht die Elektronenkonfiguration des Heliumatoms durch die formale Abgabe von fünf Elektronen und besitzt die Oxidationsstufe +5.
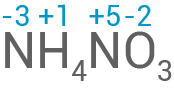
2
Bau, Bindungsverhältnisse und Eigenschaften der Ionensubstanzen
- Ionenverbindungen bilden kristalline Strukturen aus Ionen, bei denen positiv geladene Kationen und negativ geladene Anionen in einem regelmäßigen Muster angeordnet sind – jedes Ion ist von mehreren entgegengesetzt geladenen Ionen umgeben.
- Die Bindung zwischen den Ionen ist eine Ionenbindung, die auf der starken elektrostatischen Anziehung zwischen den entgegengesetzten Ladungen beruht. Aufgrund dieser starken Anziehungskräfte haben Ionensubstanzen in der Regel hohe Schmelz- und Siedetemperaturen, da viel Energie benötigt wird, um die Bindungskräfte zu überwinden.
- Die regelmäßige Anordnung der Ionen im Gitter und ihre relative Unbeweglichkeit verhindern die elektrische Leitfähigkeit, auch wenn Ladungsträger vorhanden sind. Erst wenn die Ionen durch das Schmelzen oder das Lösen in Wasser beweglich werden, entsteht elektrische Leitfähigkeit.
- Alternativ kann man sagen, dass Ionenverbindungen spröde sind, da gleiche Ladungen einander gegenüberstehen und das Kristallgitter bricht, wenn zwei Schichten gegeneinander verschoben werden.
3.1
Merkmale des chemischen Gleichgewichts (zwei erforderlich)
- Die Hin- und Rückreaktion laufen gleich schnell ab:
- Die Konzentrationen der beteiligten Stoffe ändern sich nicht mehr:
- Die Lage chemischer Gleichgewichte ist temperaturabhängig.
- Ein Katalysator kann die Lage nicht verändern oder beeinflussen.
3.2
Maßnahmen zur Verringerung des  -Anteils
-Anteils
- Es wird das Prinzip des kleinsten Zwangs angewendet – übt man auf ein chemisches System im Gleichgewicht einen Zwang aus, so reagiert es so, dass die Wirkung des Zwanges minimal wird.
- Durch die Veränderung von z.B. Temperatur, Druck oder Konzentration kann die Lage des Gleichgewichts also beeinflusst werden.
wird bei der endothermen Rückreaktion gebildet.
- Während hohe Temperaturen endotherme Reaktionen fördern, bevorzugen niedrige Temperaturen exotherme Reaktionen.
- Hier kann also durch die Verringerung der Temperatur das Gleichgewicht auf die Seite der Produkte (exotherme Hinreaktion) verschoben werden, wodurch der Kohlenstoffmonooxidanteil sinkt.
- Wird ein an der Reaktion beteiligter Stoff aus dem System entfernt, wird dessen Nachbildung gefördert.
- Wird beispielsweise
entnommen, verlagert sich das chemische Gleichgewicht auf Produktseite – der Anteil an Kohlenstoffmonooxid sinkt.
3.3
Berechnung der Stoffmenge an Wasserstoff
Für die Berechnung werden die Stoffmengen vor der Reaktion  und im Gleichgewicht
und im Gleichgewicht  betrachtet:
Mit der gegebenen Gleichgewichtskonstante folgt:
betrachtet:
Mit der gegebenen Gleichgewichtskonstante folgt:
![\(\begin{array}[t]{rll}
K_c&=& 3 & \\[5pt]
&=& \dfrac{n(CO_2) \cdot n(H_2)}{n(CO) \cdot n(H_2O)} & \\[5pt]
&=& \dfrac{x \cdot x}{(2-x) \cdot (3-x)} & \\[5pt]
&=& \dfrac{x^2}{x^2 - 5x + 6}
\end{array}\)](https://mathjax.schullv.de/07669c7c03318c36a816cdf2c3288fcac37ee1429efbb729360f3eae42073e25?color=5a5a5a) Der Term im Nenner wird nun gleich null gesetzt, wodurch
Der Term im Nenner wird nun gleich null gesetzt, wodurch  und
und  als Lösungen ermittelt werden können:
als Lösungen ermittelt werden können:
Für die Stoffmengen im Gleichgewicht ergibt sich:
Bei der Konvertierung im chemischen Gleichgewicht liegt bei dem gegebenen Stoffmengeneinsatz  Wasserstoff vor.
Wasserstoff vor.
3.4
Reaktionsgleichungen
4.1
Berechnung der molaren Standardreaktionsenthalpie
Für die Berechnung gilt der Satz von HESS:
Im Anhang sind die molaren Standarbildungsenthalpien der Reaktionsprodukte  und der Ausgangsstoffe
und der Ausgangsstoffe  gegeben. Die molaren Standarbildungsenthalpien von Elementen sind Null.
Die molare Standardreaktionsenthalpie für die Reaktion von Ammoniumnitrat zu Wasserdampf, Stickstoff und Sauerstoff beträgt
gegeben. Die molaren Standarbildungsenthalpien von Elementen sind Null.
Die molare Standardreaktionsenthalpie für die Reaktion von Ammoniumnitrat zu Wasserdampf, Stickstoff und Sauerstoff beträgt 
4.2
Berechnung des Volumens der gasförmigen Reaktionsprodukte
Die Reaktionsgleichung zeigt: aus  Ammoniumnitrat ergeben sich
Ammoniumnitrat ergeben sich  Gase.
Gase.
Es wird nun zunächst das Volumen für Ammoniumnitrat berechnet: Basierend auf der Zustandsgleichung idealer Gase ergibt sich:![\(\begin{array}[t]{rll}
V\,\text{(Gase)}&=& n\,\text{(Gase)} \cdot V_m & \\[5pt]
&=& 7\,\text{mol} \cdot 104,45\,\text{L} \cdot \text{mol}^{-1} & \\[5pt]
&=& 731,15 \,\text{L}
\end{array}\)](https://mathjax.schullv.de/b43fdbc5c37629a850811d320d2b1a5044729f47d6168ac9f8240727ee90c0ed?color=5a5a5a) Anwendung des Dreisatzes:
Anwendung des Dreisatzes:

 Das Volumen der gasförmigen Reaktionsprodukte beträgt bei
Das Volumen der gasförmigen Reaktionsprodukte beträgt bei  und
und  Ammoniumnitrat ca.
Ammoniumnitrat ca. 
Es wird nun zunächst das Volumen für Ammoniumnitrat berechnet: Basierend auf der Zustandsgleichung idealer Gase ergibt sich:
5
Nachweis der Ammonium-Ionen
- Ein bisschen Ammoniumnitrat wird in einer kleinen Petrischale mit einigen Tropfen einer verdünnten Lauge, z.B.
, versetzt.
- Es wird direkt der Deckel aufgesetzt, wobei an die Innenseite ein mit Wasser befeuchteter Universalindikatorstreifen befestigt ist.
- Es findet folgende Reaktion statt:
Es wird gasförmiges Ammoniak freigesetzt.
- Das aufsteigende Gas reagiert mit dem angefeuchteten Indikatorpapier:
Hier entstehen Hydroxid-Ionen (basisch) – das Indikatorpapier färbt sich blau.
6.1
Zuordnung von Plus- und Minuspol
- Bei galvanischen Elementen ist der Minuspol die Anode, an der oxidiert wird – der Pluspol ist die Kathode, an der reduziert wird.
- 1: Pluspol
Kathode
- 2: Minuspol
Anode
6.2
Reaktionsgleichungen
6.3
Begründung der Maßnahmen (nur eine erforderlich)
Zugabe von Graphitpulver:
- Durch Zugabe von Graphitpulver wird die elektrische Leitfähigkeit gesteigert.
- Graphit ist eine Form des Kohlenstoffs, die elektrisch leitfähig ist.
- In der Struktur des Graphits sind freie Elektronen zwischen den Kohlenstoff-Ebenen vorhanden, die für die elektrische Leitfähigkeit verantwortlich sind.
- Im Laufe des Batteriebetriebs führt die Oxidation von Zink dazu, dass der Zinkbecher allmählich dünner wird und möglicherweise Risse bekommt.
- Um ein Auslaufen der Batterie zu verhindern, wird heutzutage ein Stahlmantel verwendet.
- Eine weitere Maßnahme zum Schutz vor Auslaufen ist die Verdickung der Elektrolytlösung durch Zugabe von Stärke, die durch Wasser aufquillt.
7.1
Berechnung der Masse an Zink
Als Grundlage für die Berechnung dienen die FARADAY'schen Gesetze:



 Äquivalenzumformung:
Äquivalenzumformung:  Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
m&=& \dfrac{I \cdot t \cdot M}{F \cdot z} & \\[5pt]
&=& \dfrac{2,5\,\text{A} \cdot 24\,\text{h} \cdot 65,4\,\text{g} \cdot \text{mol}^{-1} }{26,8\,\text{Ah} \cdot \text{mol}^{-1} \cdot 2} & \\[5pt]
&=& 73,2 \,\text{g}
\end{array}\)](https://mathjax.schullv.de/2909ba52f5743e84bb0b724966e2d8512340caf508a87a3c8939e87ed27cfafb?color=5a5a5a) Bei einer Stromstärke von
Bei einer Stromstärke von  wird in
wird in  Stunden
Stunden  Zink abgeschieden.
Zink abgeschieden.
7.2
Vergleich der Vorgänge