Teil B – Eisen
1
Eisenverbindungen spielen im Stoffwechsel des Menschen eine wichtige Rolle. Sie sorgen z.B. im roten Blutfarbstoff für den Transport von Sauerstoff.
Medikamente gegen Eisenmangel enthalten u. a. Eisen -sulfat. Während der Einnahme sollte man auf Lebensmittel, die Oxalsäure oder Phosphate enthalten, verzichten. Oxalsäure
-sulfat. Während der Einnahme sollte man auf Lebensmittel, die Oxalsäure oder Phosphate enthalten, verzichten. Oxalsäure  kommt zum Beispiel in Spinat oder Rhabarber und Phosphate (z.B.
kommt zum Beispiel in Spinat oder Rhabarber und Phosphate (z.B.  ) kommen u. a. in Schmelzkäse vor.
) kommen u. a. in Schmelzkäse vor.
Medikamente gegen Eisenmangel enthalten u. a. Eisen
1.1
Gib die Oxidationszahlen für Schwefel und Phosphor im Sulfat- bzw. Phosphat-Ion an.
(02 BE)
1.2
Eisen -sulfatlösung reagiert mit Oxalsäurelösung nach folgender Reaktionsgleichung. Dabei entsteht schwer lösliches Eisen
-sulfatlösung reagiert mit Oxalsäurelösung nach folgender Reaktionsgleichung. Dabei entsteht schwer lösliches Eisen -oxalat.
-oxalat.


 Erkläre die Folgen des Konsums oxalsäurehaltiger Lebensmittel bei Eisenmangel.
Erkläre die Folgen des Konsums oxalsäurehaltiger Lebensmittel bei Eisenmangel.
(02 BE)
1.3
Wird Eisen -oxalat auf über
-oxalat auf über  erhitzt, zerfällt es nach folgender vereinfachter Reaktionsgleichung.
erhitzt, zerfällt es nach folgender vereinfachter Reaktionsgleichung.


 Berechne die molare Standardreaktionsenthalpie.
Berechne die molare Standardreaktionsenthalpie.
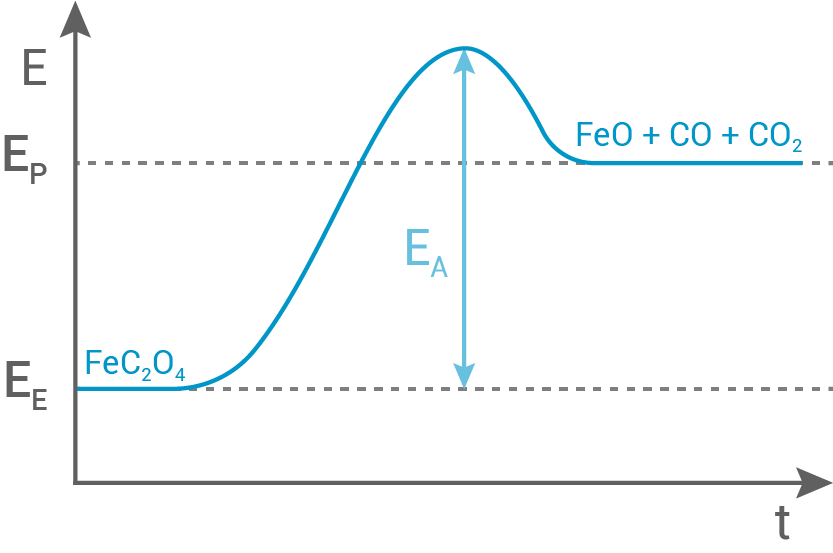
Skizziere und beschrifte den energetischen Verlauf dieser Reaktion in einem Energie-Zeit-Diagramm.
Skizziere und beschrifte den energetischen Verlauf dieser Reaktion in einem Energie-Zeit-Diagramm.
(04 BE)
1.4
Berechne die Masse an Eisen -oxalat, die erhitzt wurde, wenn anschließend bei Standardbedingungen
-oxalat, die erhitzt wurde, wenn anschließend bei Standardbedingungen  vier Liter Gas vorliegen.
vier Liter Gas vorliegen.
(03 BE)
2
Die Herstellung von Eisen -sulfat erfolgt durch Erhitzen von pulverisiertem Eisen in
-sulfat erfolgt durch Erhitzen von pulverisiertem Eisen in  iger Schwefelsäure.
iger Schwefelsäure.
2.1
Entwickle die Reaktionsgleichung.
Gib die Reaktionsart an.
Gib die Reaktionsart an.
(02 BE)
2.2
Lässt man die frisch hergestellte Eisen -Ionenlösung einige Zeit stehen, so bilden sich Eisen
-Ionenlösung einige Zeit stehen, so bilden sich Eisen -Ionen.
-Ionen.
Begründe die Bildung der Eisen -Ionen mithilfe einer Elektronenkonfiguration.
-Ionen mithilfe einer Elektronenkonfiguration.
Begründe die Bildung der Eisen
(03 BE)
2.3
Erläutere den Nachweis der Sulfat-Ionen.
(03 BE)
3
Material
Die Phosphateliminierung mithilfe von Eisensalzen in Kläranlagen ist notwendig, um Gewässer zu schützen.
In Abhängigkeit vom pH-Wert gibt es im Abwasser Phosphat-, Hydrogenphosphat- bzw. Dihydrogenphosphat-Ionen. Häusliches Abwasser besitzt einen pH-Wert  bis
bis  Für den Einsatz von Eisen
Für den Einsatz von Eisen -salzen ergeben sich folgende Reaktionen.
-salzen ergeben sich folgende Reaktionen.
Beim Einsatz von Eisen -salzen erfolgen im Belebtschlammbecken folgende Reaktionen:
-salzen erfolgen im Belebtschlammbecken folgende Reaktionen:
Die Phosphateliminierung mit Eisensalzen kann auch in Teichanlagen eingesetzt werden, wobei man in unbelüfteten Teichen mit Eisen -salzen arbeiten muss.
-salzen arbeiten muss.
3.1
Unterscheide Redoxreaktionen und Protolysen (Säure-Base-Reaktionen) hinsichtlich der übertragenen Teilchen, des Donators und des Akzeptors.
(03 BE)
3.2
Entwickle für die Reaktion von Eisen -Ionen mit Sauerstoff bei
-Ionen mit Sauerstoff bei  die Teilgleichung der Oxidation.
die Teilgleichung der Oxidation.
Gib das Oxidationsmittel an.
Gib das Oxidationsmittel an.
(02 BE)
3.3
Begründe die Verwendung von Eisen -salzen anstelle von Eisen
-salzen anstelle von Eisen -salzen in unbelüfteten Teichanlagen.
-salzen in unbelüfteten Teichanlagen.
(02 BE)
3.4
Begründe die Auswirkung der Phosphateliminierung mit Eisen -Ionen auf den pH-Wert von Abwässern.
-Ionen auf den pH-Wert von Abwässern.
(02 BE)
3.5
Berechne die maximale Stoffmengenkonzentration der Hydronium-Ionen im häuslichen Abwasser.
(02 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Oxidationszahlen
Für Schwefel in  +6
Für Phosphor in
+6
Für Phosphor in  +5
+5
1.2
Folgen des Konsums
Die Reaktionsgleichung zeigt eine Fällungsreaktion bei der schwerlösliches Eisen -oxalat entsteht.
-oxalat entsteht.
Wenn jemand, der an Eisenmangel leidet, oxalsäurehaltige Lebensmittel konsumiert, kann die Oxalsäure Eisen binden und Eisenoxalat bilden, das ebenfalls schwer löslich ist. Dies führt dazu, dass das gebildete Eisenoxalat nicht gut vom Körper aufgenommen werden kann. Als Folge davon kann die ohnehin schon beeinträchtigte Eisenaufnahme bei Menschen mit Eisenmangel weiter reduziert werden, was die Eisenmangelsymptome verstärken kann.
Wenn jemand, der an Eisenmangel leidet, oxalsäurehaltige Lebensmittel konsumiert, kann die Oxalsäure Eisen binden und Eisenoxalat bilden, das ebenfalls schwer löslich ist. Dies führt dazu, dass das gebildete Eisenoxalat nicht gut vom Körper aufgenommen werden kann. Als Folge davon kann die ohnehin schon beeinträchtigte Eisenaufnahme bei Menschen mit Eisenmangel weiter reduziert werden, was die Eisenmangelsymptome verstärken kann.
1.3
Berechnung der molaren Standardreaktionsenthalpie
Für die Berechnung gilt:
Die gegebenen Werte (Anlage) können nun der Reaktionsgleichung folgend eingesetzt werden:
Energetischer Verlauf
Die berechnete molare Standardreaktionsenthalpie zeigt, dass es sich um eine endotherme Reaktion handelt:

1.4
Berechnung der Masse an Eisen -oxalat
Weiterhin gilt mit dem gegebenen Volumen und dem molaren Volumen (Anhang):
-oxalat
Weiterhin gilt mit dem gegebenen Volumen und dem molaren Volumen (Anhang):
![\(\begin{array}[t]{rll}
n (FeC_2O_4\,_\text{(s)}) &=& n\,\text{(Gas)} & \\[5pt]
&=&\dfrac{V}{V_m} & \\[5pt]
&=& \dfrac{2\,\text{L}}{24,5\,\text{L} \cdot \text{mol}^{-1}}
\end{array}\)](https://mathjax.schullv.de/f623095339e1d2ee51dac5d3c5145532c86c1ac8118dc124a1ec39b2e6f2ba92?color=5a5a5a) Daraus folgt:
Daraus folgt:
2.1
Reaktionsgleichung und Reaktionsart


 Es handelt sich um eine Redoxreaktion: Das Eisen gibt seine Elektronen ab und wird oxidiert, Schwefelsäure nimmt die abgebenen Elektronen auf und wird reduziert.
Es handelt sich um eine Redoxreaktion: Das Eisen gibt seine Elektronen ab und wird oxidiert, Schwefelsäure nimmt die abgebenen Elektronen auf und wird reduziert.
2.2
Begründung der Bildung von Eisen -Ionen
Die Elektronenkonfigurationen von Eisen und seinen Ionen lauten:
Wenn
-Ionen
Die Elektronenkonfigurationen von Eisen und seinen Ionen lauten:
Wenn  zu
zu  wird, gibt es ein Elektron ab. Am energetisch günstigsten ist die Abgabe eines 3d-Elektrons.
Wird die frisch hergestellte Eisen
wird, gibt es ein Elektron ab. Am energetisch günstigsten ist die Abgabe eines 3d-Elektrons.
Wird die frisch hergestellte Eisen -Ionenlösung einige Zeit stehen gelassen findet also eine Oxidationsreaktion, eine sogenannte Luftoxidation, statt.
-Ionenlösung einige Zeit stehen gelassen findet also eine Oxidationsreaktion, eine sogenannte Luftoxidation, statt.
2.3
Nachweis der Sulfat-Ionen
Sulfat-Ionen können mit einer Bariumchlorid-Lösung nachgewiesen werden.
Dabei findet folgende Reaktion statt:

 Der positive Nachweis zeigt sich durch die Bildung eines weißen, schwerlöslichen Niederschlags.
Der positive Nachweis zeigt sich durch die Bildung eines weißen, schwerlöslichen Niederschlags.
Dabei findet folgende Reaktion statt:
3.1
Unterscheidung
| Redoxreaktion |
|
|---|---|
| Protolyse |
|
3.2
Reaktion von Eisen -Ionen mit Sauerstoff
Oxidation:
-Ionen mit Sauerstoff
Oxidation: 

 Der Sauerstoff
Der Sauerstoff  ist das Oxidationsmittel, da es die vom Eisen abgegebenen Elektronen aufnimmt und selbst reduziert wird.
ist das Oxidationsmittel, da es die vom Eisen abgegebenen Elektronen aufnimmt und selbst reduziert wird.
3.3
Begründung der Verwendung von Eisen -salzen
-salzen
- Geringere Reaktionsgeschwindigkeit: Bei
oxidieren Eisen
-Salze leichter, wodurch die Umwandlung langsamer wird.
- Vermeidung von Sauerstoffverbrauch: Wenn Eisen
-Salze eingesetzt werden, wird ein zusätzlicher Sauerstoffverbrauch vermieden. In unbelüfteten Teichen ist Sauerstoff oft begrenzt, und der Einsatz von Eisen
-Salzen führt zur Abnahme des bereits knappen Sauerstoffs.
3.4
Auswirkung auf den pH-Wert von Abwässern
Bei der Phosphateliminierung mit Eisen -Ionen kommt es zur Entstehung oder zum Verbrauch von
-Ionen kommt es zur Entstehung oder zum Verbrauch von  -Ionen. Da der pH-Wert durch die
-Ionen. Da der pH-Wert durch die  -Konzentration bestimmt wird, wirkt sich diese Veränderung auf den pH-Wert in Abwässern aus.
-Konzentration bestimmt wird, wirkt sich diese Veränderung auf den pH-Wert in Abwässern aus.
3.5
Berechnung der maximalen Stoffmengenkonzentration der Hydronium-Ionen im häuslichen Abwasser
Für den pH-Wert gilt:
![\(pH= - \log[H_3O^+]\)](https://mathjax.schullv.de/8a8cfec9526c9678e2623a87e8b73b126f5d326f249dcdbce541311f0662c5ec?color=5a5a5a) Durch Umformung ergibt sich:
Durch Umformung ergibt sich:
 Im Material ist für häusliches Abwasser ein pH-Wert von
Im Material ist für häusliches Abwasser ein pH-Wert von  gegeben. Um die maximale Stoffmengenkonzentration der Hydronium-Ionen zu berechnen, wird der niedrigste Wert im angegebenen Bereich eingesetzt:
gegeben. Um die maximale Stoffmengenkonzentration der Hydronium-Ionen zu berechnen, wird der niedrigste Wert im angegebenen Bereich eingesetzt:
![\(\begin{array}[t]{rll}
c(H_3O^+) &=& 10^{-6} &\\[5pt]
&=& 0,000001\,\text{mol}\cdot \text{L}^{-1}
\end{array}\)](https://mathjax.schullv.de/fbd7594ffe01e8163688961a7489395ab837fe941f1b268de174b6b36f8b8bea?color=5a5a5a) Die maximale Stoffmengenkonzentration der Hydronium-Ionen im häuslichen Abwasser beträgt
Die maximale Stoffmengenkonzentration der Hydronium-Ionen im häuslichen Abwasser beträgt 