Teil B – Magnesium, Chlorwasserstoff
1
Magnesium-Akkus sind die neuen Hoffnungsträger unter den Stromspeichern. Sie gelten als sicher und versprechen deutlich höhere Leistungen als derzeit gebräuchliche Akkumulatoren. Als Anode wird Magnesium verwendet. Materialforscher untersuchen u.a. Schwefel und organische Polymere als Kathodenmaterial.
Magnesium wird hauptsächlich durch Elektrolyse von geschmolzenem Magnesiumchlorid gewonnen.
Magnesium wird hauptsächlich durch Elektrolyse von geschmolzenem Magnesiumchlorid gewonnen.
1.1
Erläutere die Vorgänge an der Magnesium-Elektrode beim Entladevorgang im Akkumulator.
(03 BE)
1.2
Berechne die Standardzellspannung einer Magnesium-Schwefel-Batterie.
(02 BE)
1.3
Nenne je einen Vor- und Nachteil der Verwendung von Magnesium als Anodenmaterial.
(02 BE)
2
Magnesium zählt zu den Leichtmetallen mit hoher Reaktionsfreudigkeit. Daher könnenn Magnesiumbrände weder mit Wasser noch mit Kohlenstoffdioxid gelöscht werden.
2.1
Begründe die vorliegende Bindungsart im Kohlenstoffdioxid-Molekül.
(02 BE)
2.2
Erläutere einen Nachweis für Kohlenstoffdioxid.
(03 BE)
2.3
Entwickle die Reaktionsgleichung für die Reaktion von Magnesium mit Wasser unter Bildung von Magnesiumhydroxid und Wasserstoff.
Begründe die vorliegende Reaktionsart.
Begründe die vorliegende Reaktionsart.
(03 BE)
2.4
Bei der Reaktion von Magnesium mit Kohlenstoffdioxid läuft die folgende Reaktion ab.
Berechne das Volumen an Kohlenstoffdioxid unter Standardbedingungen bei der Reaktion von Magnesium.
Magnesium.
a 
 b
b 
 c
c 
 d
d 
Entwickle die vollständige Reaktionsgleichung.
Berechne das Volumen an Kohlenstoffdioxid unter Standardbedingungen bei der Reaktion von
(03 BE)
3
Chlorwasserstoff kann durch eine exotherm ablaufende Gleichgewichtsreaktion aus den Elementen gebildet werden. Diese Reaktion besitzt bei Standardbedingungen eine Gleichgewichtskonstante von 
Leitet man Chlorwasserstoff in Wasser ein, so bildet sich Chlorwasserstoffsäure (Salzsäure). Salpetersäure hingegen wird industriell durch katalytische Oxidation von Ammoniak nach dem OSTWALD-Verfahren hergestellt.
Leitet man Chlorwasserstoff in Wasser ein, so bildet sich Chlorwasserstoffsäure (Salzsäure). Salpetersäure hingegen wird industriell durch katalytische Oxidation von Ammoniak nach dem OSTWALD-Verfahren hergestellt.
3.1
Entwickle die Reaktionsgleichung für die Bildung von Chlorwasserstoff.
(01 BE)
3.2
Leite aus der gegebenen Gleichgewichtskonstante  eine Aussage zur Lage des chemischen Gleichgewichts ab.
eine Aussage zur Lage des chemischen Gleichgewichts ab.
Erkläre die Veränderung von bei hohen Temperaturen im Vergleich zu den Standardbedingungen.
bei hohen Temperaturen im Vergleich zu den Standardbedingungen.
Erkläre die Veränderung von
3.3
Erläutere anhand der Reaktion von Chlorwasserstoff mit Wasser die Säure-Base-Theorie nach BRØNSTED.
(03 BE)
3.4
Salpetersäure reagiert mit Kupfer nach folgender Reaktionsgleichung.


 Berechne die molare Standardreaktionsenthalpie.
Berechne die molare Standardreaktionsenthalpie.
(02 BE)
3.5
Salpetersäure dient zur Herstellung von Ammoniumnitrat, welches u.a. als Düngemittel genutzt wird.
Erläutere den Einfluss des gelösten Ammoniumnitrats auf den pH-Wert des Bodens.
(03 BE)
(30 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Vorgänge an der Magnesium-Elektrode
- Die Reaktionsgleichung für das Entladen im Akkumulator lautet:
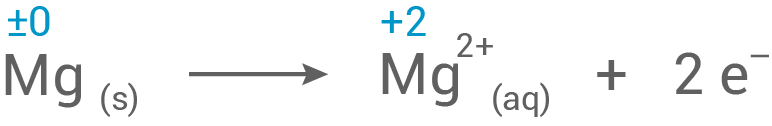
- An der Anode wird Magnesium oxidiert und die Metallatome in Kationen überführt.
- Diese Kationen werden im Elektrolyten gelöst, wobei die angegebenen Elektronen zu einem Überschuss an negativer Ladung an der Anode führen.
- An der Kathode findet die Reduktion statt – erst bei Verbindung der beiden Halbzellen fließen Elektronen und somit ein elektrischer Strom
1.2
Berechnung der Standardzellspannung einer Magnesium-Schwefel-Batterie
Für die Reaktion in einer Magnesium-Schwefel-Batterie gilt:



![\(\begin{array}[t]{rll}
E^0\,\text{(Anode)}&=& E^0 (Mg /Mg^{2+}) & \\[5pt]
&=& -2,36\,\text{V} & \\[5pt]
E^0\,\text{(Kathode)}&=& E^0(S^{2-}/ S) & \\[5pt]
&=& -0,48 \,\text{V}&
\end{array}\)](https://mathjax.schullv.de/e42d84f987be24d3038c19fb550bf408984c6fc888d9b34658320475d13ccc47?color=5a5a5a) Die Standardzellspannung der Batterie folgt aus der Differenz der gegebenen Standardpotenziale:
Die Standardzellspannung der Batterie folgt aus der Differenz der gegebenen Standardpotenziale:
![\(\begin{array}[t]{rll}
U^0 &=& E^0\,\text{(Kathode)} - E^0\,\text{(Anode)} & \\[5pt]
&=& E^0(S^{2-}/ S) - E^0 (Mg /Mg^{2+}) & \\[5pt]
&=& -0,48 \,\text{V} - (-2,36\,\text{V}) & \\[5pt]
&=& 1,88 \,\text{V}
\end{array}\)](https://mathjax.schullv.de/4e95b3a84c603486d1fba31bfdd5f8e09b0d283a95da8902007bf4086152744d?color=5a5a5a) Eine Magnesium-Schwefel-Batterie hat also eine Standardzellspannung von
Eine Magnesium-Schwefel-Batterie hat also eine Standardzellspannung von 
1.3
Magnesium als Anodenmaterial
|
+
|
sehr niedriges Standardelektrodenpotenzial |
|---|---|
|
-
|
Elektrolyse für die Magnesium-Gewinnung |
2.1
Bindungsart in Kohlenstoffdioxid
- Da chemische Bindungen auf der gemeinsamen Nutzung von Valenzelektronen beruht, werden die Elektronegativitäten der Atome betrachtet:
- Chemische Bindungen können je nach Elektronegativitätsdifferenz
homoatomar (unpolar) oder heteroatomar (schwach polar oder polar) sein:
- Für
gilt:
- In Kohlenstoffdioxid liegt daher eine polare Bindung mit
vor.
2.2
Nachweis für  (nur einer erforderlich)
(nur einer erforderlich)
- Mit Bariumhydroxidlösung:
Beim Einleiten von gasförmigem
in Barytwasser
bildet sich ein weißer Niederschlag (Trübung bei klarer Lösung).
- Mit Calciumhydroxidlösung:
Beim Einleiten von gasförmigem
in Kalkwasser
bildet sich ein weißer Niederschlag (Trübung bei klarer Lösung).
2.3
Reaktionsgleichung und Reaktionsart


- Bei der Reaktion von Magnesium mit Wasser findet ein Elektronenübergang statt.
- An den Oxidationszahlen ist eine Redoxreaktion erkennbar – Magnesium wird oxidiert, gleichzeitig wird Wasser reduziert.
- Es entstehen Magnesiumhydroxid und gasförmiger Wasserstoff.
2.4
Reaktionsgleichung


 Berechnung des
Berechnung des  -Volumens
Für die Berechnung gilt:
-Volumens
Für die Berechnung gilt:



 und
und 


 Daraus folgt:
Daraus folgt:
![\(\begin{array}[t]{rll}
\dfrac{V_{\text{CO}_2}}{m_{\text{Mg}}}&=& \dfrac{n_{\text{CO}_2} \cdot V_m}{n_{\text{Mg}} \cdot M_{\text{Mg}}} & \\[5pt]
V_{\text{CO}_2} &=& \dfrac{n_{\text{CO}_2} \cdot V_m \cdot m_{\text{Mg}} }{n_{\text{Mg}} \cdot M_{\text{Mg}}} & \\[5pt]
&=& \dfrac{1\,\text{mol} \cdot 24,5\,\text{L} \cdot \text{mol}^{-1} \cdot 10\,\text{g}}{2\,\text{mol} \cdot 24\,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&=& 5,1 \,\text{L} \approx 5 \,\text{L}
\end{array}\)](https://mathjax.schullv.de/e72e0e3f30d7b1a498d21bb0b79df30d1c336a86da5a26ae16d54e46f17c80fc?color=5a5a5a) Bei der Reaktion von
Bei der Reaktion von  Magnesium unter Standardbedingungen, beträgt das Volumen von
Magnesium unter Standardbedingungen, beträgt das Volumen von  ca.
ca. 
3.1
Reaktionsgleichung für die Bildung von Chlorwasserstoff



3.2
Lage des chemischen Gleichgewichts

- Um die Lage des chemischen Gleichgewichts zu beurteilen, wird das Massenwirkungsgesetz (MWG) betrachtet:
- Hierbei gilt:
Gleichgewicht auf Eduktseite
Gleichgewicht auf Produktseite
- Das MWG für diese Reaktion zeigt, dass
größer als
ist – das Gleichgewicht liegt auf Produktseite.
- Es werden mehr Produkte gebildet als zerfallen.
- Temperaturerhöhungen bewirken, dass bei sich im Gleichgewicht befindlichen Reaktionen die endotherme, also energieverbrauchende Reaktion, gefördert wird – andersrum werden bei niedrigen Temperaturen die exotherme Reaktion bevorzugt.
- Der Aufgabenstellung ist zu entnehmen, dass die Bildung von Chlorwasserstoff (Hinreaktion) exotherm ist.
- Bei hohen Temperaturen wird also die endotherme Rückreaktion bevorzugt, wodurch weniger Produkte gebildet werden.
- Der
-Wert ist demnach bei hohen Temperaturen kleiner als unter Standardbedingungen.
3.3
Säure-Base-Theorie nach BRØNSTED
- Die BRØNSTED-Theorie betrachtet die Übertragung der Protonen:
- Bei dieser Säure-Base-Reaktion fungiert Chlorwasserstoff
als Protonendonator und stellt somit die Säure dar.
- Wasser ist hier der Protonenakzeptor und ist folglich nach BRØNSTED die Base.
3.4
Berechnung der molaren Standardreaktionsenthalpie
Folgende Reaktion ist gegeben:


 Für die Berechnung gilt der Satz von HESS:
Im Anhang sind die molaren Standarbildungsenthalpien der Edukte und Produkte gegeben. Die molaren Standarbildungsenthalpien von Elementen sind Null.
Die molare Standardreaktionsenthalpie für die Reaktion von Salpetersäure mit Kupfer beträgt
Für die Berechnung gilt der Satz von HESS:
Im Anhang sind die molaren Standarbildungsenthalpien der Edukte und Produkte gegeben. Die molaren Standarbildungsenthalpien von Elementen sind Null.
Die molare Standardreaktionsenthalpie für die Reaktion von Salpetersäure mit Kupfer beträgt 
3.5
Einfluss auf den pH-Wert
- Um zu beschreiben, welchen Einfluss gelöstes Ammoniumnitrat hat, werden die Reaktionsgleichungen betrachtet:
- In Wasser, also beim Lösen, dissoziiert das Ammoniumnitrat in Ammonium- und Nitrat-Ionen.
- Dabei nimmt das Wasser Protonen der Ammonium-Ionen auf und es entsteht ein Überschuss an Hydronium-Ionen
im Bodenwasser.
- Durch den Einsatz so eines Düngemittels sinkt der pH-Wert im Boden – Ammoniumnitrat reagiert also sauer.