Teil A – Fragen zu allen Bereichen
1
Kreuze in den Aufgaben 1.1 bis 1.5 die jeweils richtige Antwort an.
1.1
Die größte Oxidationszahl besitzt das Element Stickstoff in
1.2
Die größte molare Masse hat
1.3
Ein Dipol-Molekül ist
1.4
Die FEHLING-Probe verläuft positiv mit
| Ethen |
|
| Ethansäure |
|
| Ethanol |
|
| Ethanal |
1.5
Bei der Reaktion von Calcium mit Ethansäure entsteht neben Calciumacetat
| Wasserstoff | |
| Kohlenstoffdioxid | |
| Sauerstoff | |
| Ethan |
(05 BE)
2
Reaktionen können vollständig oder unvollständig ablaufen. Eine typische Reaktion mit unvollständigem Stoffumsatz ist die Esterbildung.
2.1
Entwickle die Reaktionsgleichung für die Bildung von Ethansäureethylester unter Verwendung von Strukturformeln.
Benenne die bei der Veresterung vorliegende organische Reaktionsart.
Benenne die bei der Veresterung vorliegende organische Reaktionsart.
(02 BE)
2.2
Zeichne für diese Reaktion ein beschriftetes Konzentrations-Zeit-Diagramm.
(02 BE)
3
Im Hochofen werden in der Reduktionszone Eisenoxide mithilfe von Kohlenstoffmonooxid zu elementarem Eisen umgesetzt.
3.1
Entwickle die Reaktionsgleichung unter Verwendung von Eisen -oxid.
-oxid.
Kennzeichne das Oxidationsmittel.
Kennzeichne das Oxidationsmittel.
(02 BE)
3.2
Begründe anhand der Elektronenkonfiguration des Eisen-Atoms die Stellung des Elements im Periodensystem.
(04 BE)
(15 BE)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
Größte Oxidationszahl
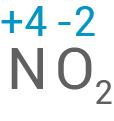 Das Element Stickstoff in Stickstoffdioxid besitzt hier die größte Oxidationszahl.
Das Element Stickstoff in Stickstoffdioxid besitzt hier die größte Oxidationszahl.
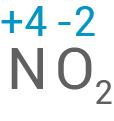
1.2
Größte molare Masse
 Die molare Masse ergibt sich aus der Summer aller Atome und ist hier für Stickstoffdioxid am größten.
Die molare Masse ergibt sich aus der Summer aller Atome und ist hier für Stickstoffdioxid am größten.
1.3
Dipol-Molekül
 Ammoniak ist hier ein Dipolmolekül, da die polaren Atombindungen asymmetrisch verteilt sind und die Atome Partialladungen besitzen.
Ammoniak ist hier ein Dipolmolekül, da die polaren Atombindungen asymmetrisch verteilt sind und die Atome Partialladungen besitzen.

1.4
| Ethen |
|
| Ethansäure |
|
| Ethanol |
|
| Ethanal |
Positive FEHLING-Probe
Mit einer FEHLING-Probe werden Aldehyde und reduzierende Zucker nachgewiesen. Hier ist dieser nur für Ethanal (Aldehyd) positiv.
1.5
| Wasserstoff | |
| Kohlenstoffdioxid | |
| Sauerstoff | |
| Ethan |
Produkt von Calcium und Ethansäure

 Reagiert ein unedles Metall mit einer verdünnten Säure, entstehen Wasserstoff und eine Salzlösung, hier Calciumacetat.
Reagiert ein unedles Metall mit einer verdünnten Säure, entstehen Wasserstoff und eine Salzlösung, hier Calciumacetat.
2.1
Reaktionsgleichung und Reaktionsart
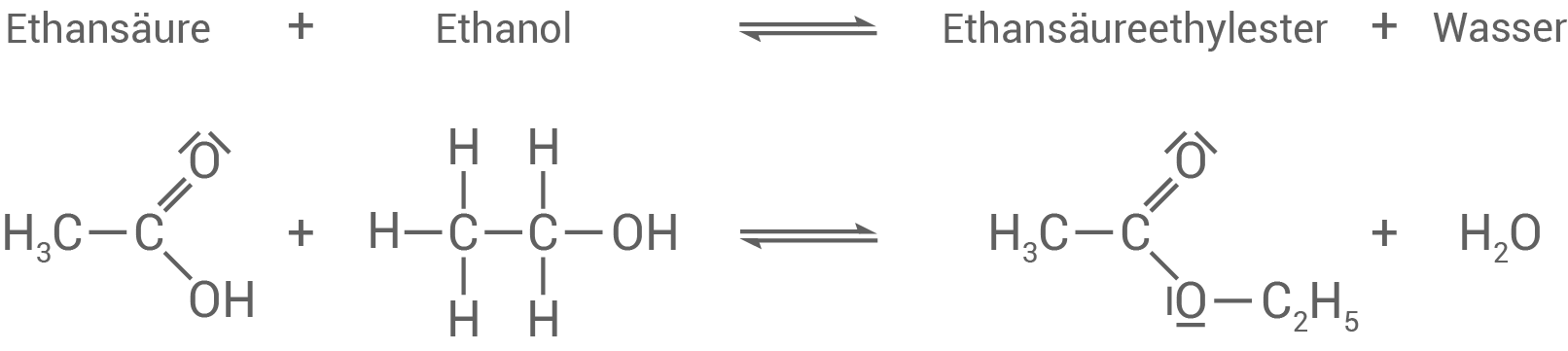 Bei dieser Veresterung handelt es sich um eine Kondensationsreaktion (Substitution).
Bei dieser Veresterung handelt es sich um eine Kondensationsreaktion (Substitution).

2.2
Konzentrations-Zeit-Diagramm
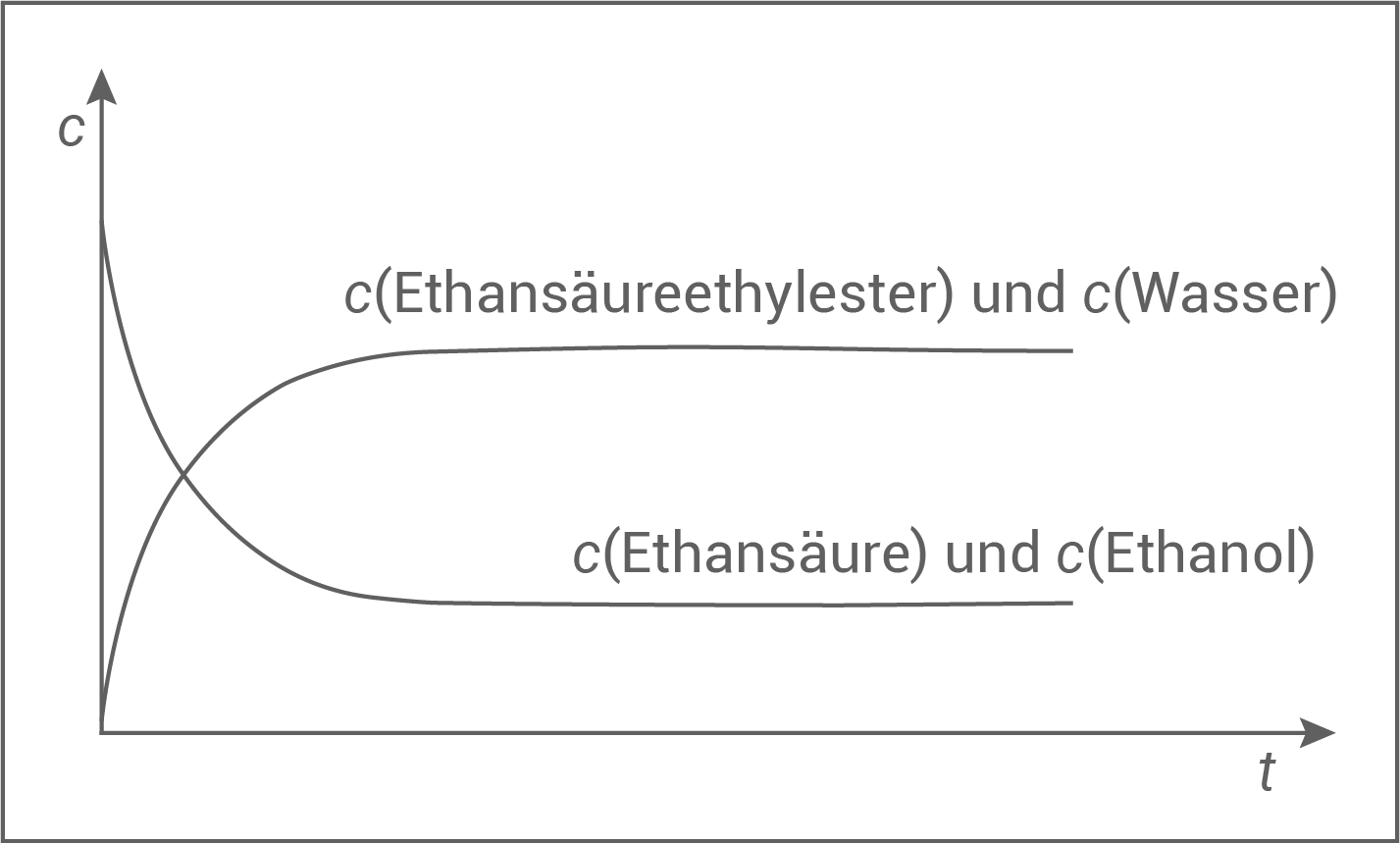

- typische Gleichgewichtsreaktion
- nach einer bestimmter Einstellzeit keine Konzentrationsveränderungen mehr
- Edukt- und Produktkurve verlaufen parallel
3.1
Reaktionsgleichung und Oxidationsmittel
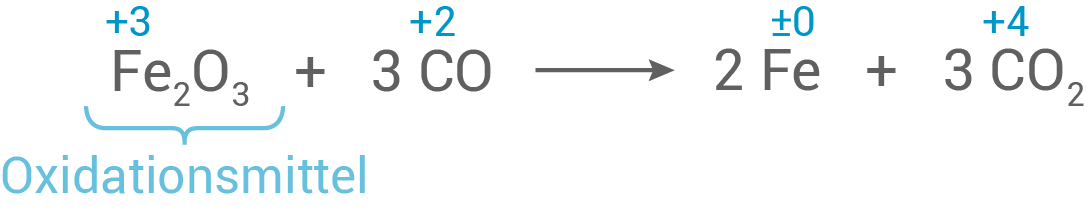
 Das Oxidationsmittel, also hier Eisen
Das Oxidationsmittel, also hier Eisen -oxid, oxidiert seinen Reaktionspartner und wird selbst reduziert.
-oxid, oxidiert seinen Reaktionspartner und wird selbst reduziert.
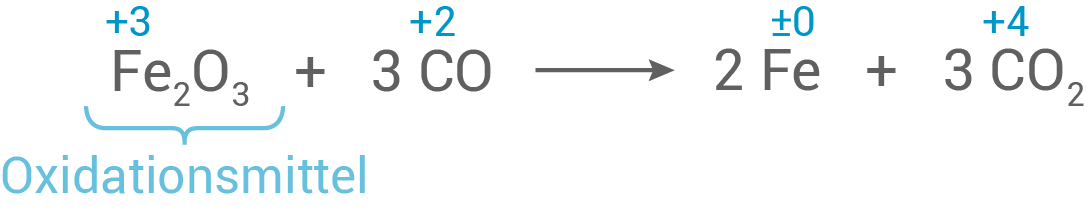
3.2
Stellung des Elements im Periodensystem
Elektronenkonfiguration:
![\(\begin{array}[t]{rll}
_{26}Fe &:& [Ar] & 4s^2& 3d^6& \\[5pt]
\end{array}\)](https://mathjax.schullv.de/78ac09eb719265c913421f2612029d54211137dd73c910c03daf54ed6ce5b900?color=5a5a5a)
| Stellung des Elements im PSE | Atombau auf Teilchenebende |
|---|---|
| Ordnungszahl |
|
| 4. Periode | Die Elektronen besetzen vier Hauptenergieniveaus |
| Nebengruppenelement | Die Valenzelektronen befinden sich in den |
| Eisen besitzt |