Vorschlag A – Karies
Karies ist eine der bekanntesten Erkrankungen der Zähne. Sie entsteht, wenn Bakterien, die im Zahnbelag enthalten sind, über einen längeren Zeitraum Zucker aus der Nahrung in Säure umwandeln. Die Säure greift den Zahnschmelz an und zerstört den Zahn allmählich, wenn er nicht gereinigt oder behandelt wird.
Für das Entstehen von Karies spielt es eine große Rolle, welche Art von Zucker den Bakterien vorliegt. Isomaltulose wird als zahnfreundlich eingestuft, da dieser Zucker nicht wesentlich von den Bakterien der Mundflora genutzt wird. Neben Zucker können auch sogenannte saure Lebensmittel für den Erhalt der Zahnsubstanz ein Problem darstellen.
Durch den Einsatz von fluoridhaltigen Zahnpflegemitteln kann Abhilfe geschaffen werden, da einer Kariesanfälligkeit der Zähne entgegengewirkt und eine lokale Schutzwirkung erreicht wird.
Ist ein Zahn von Karies betroffen, so können die kariösen Stellen vom Zahnarzt mechanisch abgetragen werden. Um die dadurch entstandenen „Löcher“ bzw. die fehlenden Stellen auszubessern, verwendet man zum Beispiel sogenannte Kompositfüllungswerkstoffe, die umgangssprachlich kurz als „Füllung“ bezeichnet werden.
Kompositfüllungswerkstoffe sind Materialien, die vorwiegend aus zwei Komponenten bestehen: einer organischen Phase und einer anorganischen Phase. Um diese Phasen dauerhaft zu verbinden, werden in Kompositfüllungswerkstoffen zusätzlich noch Haftvermittler eingesetzt. Einer der bekanntesten Haftvermittler ist das sogenannte 3-Methacryloxypropyltrimethoxysilan.
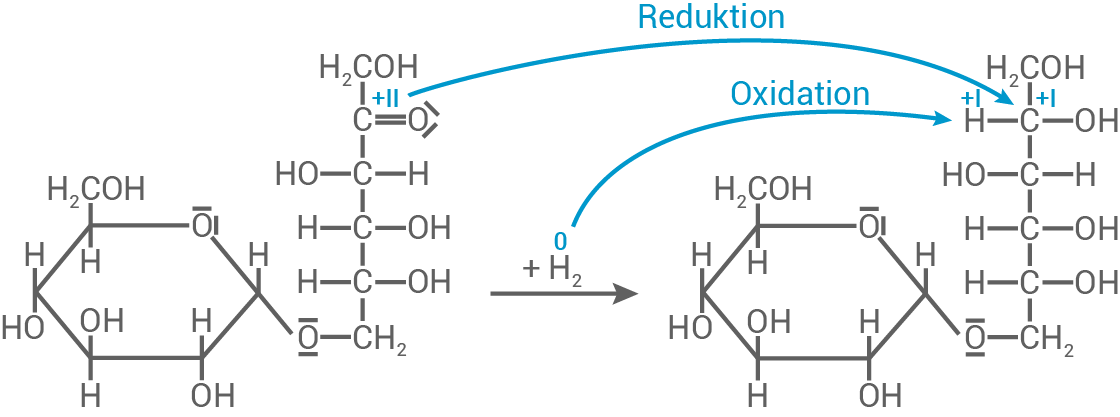
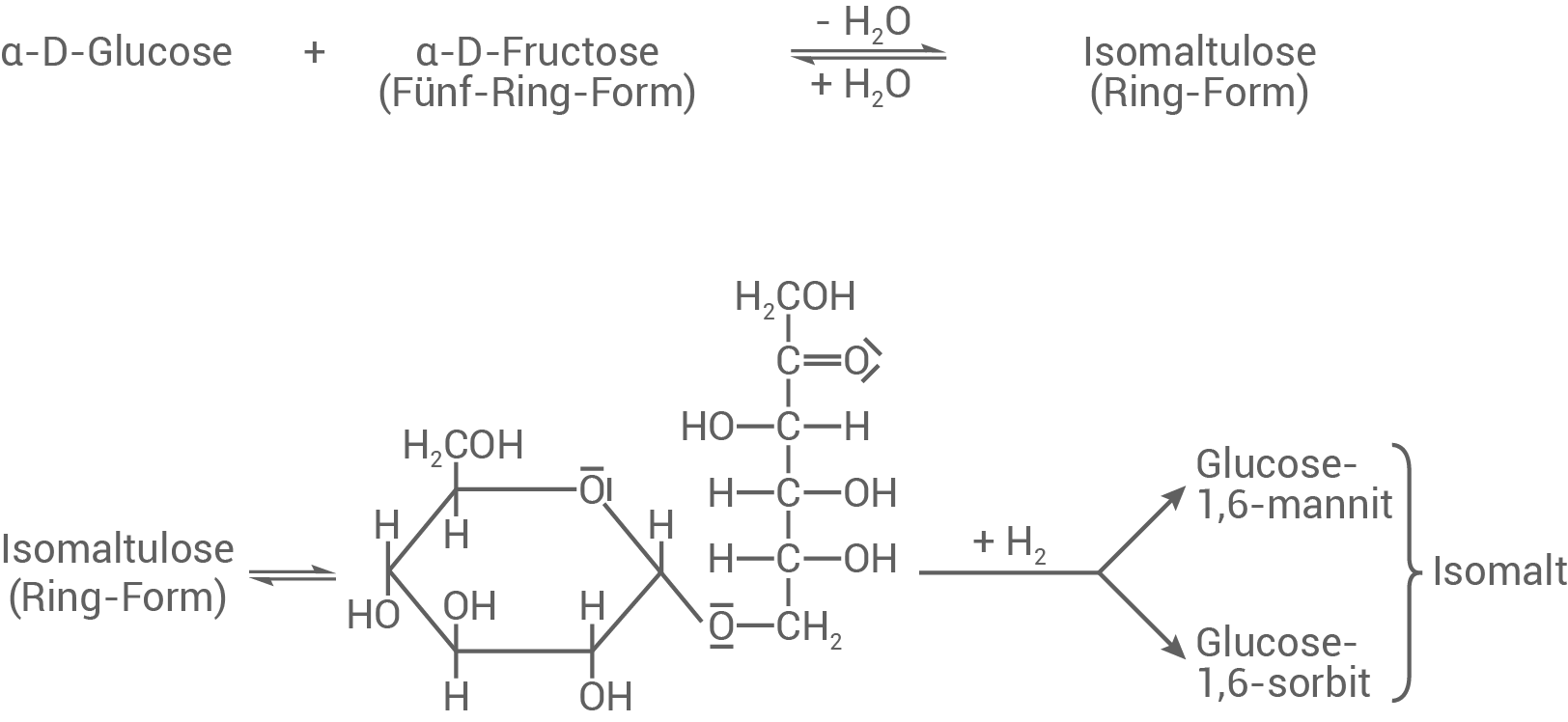 Isomalt ist ein Gemisch, das zu gleichen Teilen aus zwei Verbindungen besteht: Glucose-1,6-mannit und Glucose-1,6-sorbit. Diese beiden zueinander stereoisomeren Verbindungen entstehen, indem die Carbonyl-Gruppe der Isomaltulose (Kettenform) im Rahmen einer katalytischen Hydrierung reagiert und an dem betroffenen Kohlenstoff-Atom eine Hydroxy-Gruppe entsteht.
Isomalt ist ein Gemisch, das zu gleichen Teilen aus zwei Verbindungen besteht: Glucose-1,6-mannit und Glucose-1,6-sorbit. Diese beiden zueinander stereoisomeren Verbindungen entstehen, indem die Carbonyl-Gruppe der Isomaltulose (Kettenform) im Rahmen einer katalytischen Hydrierung reagiert und an dem betroffenen Kohlenstoff-Atom eine Hydroxy-Gruppe entsteht.
 aus dem Mineral Hydroxylapatit,
aus dem Mineral Hydroxylapatit,  das dieser Schicht seine besondere Härte verleiht. Durch den in der Mundhöhle enthaltenen Speichel kommt es an der Oberfläche des Zahnschmelzes zu einem ständigen Abbau (Demineralisation) und Aufbau (Mineralisation) von Hydroxylapatit, was durch das folgende Gleichgewicht beschrieben werden kann:
das dieser Schicht seine besondere Härte verleiht. Durch den in der Mundhöhle enthaltenen Speichel kommt es an der Oberfläche des Zahnschmelzes zu einem ständigen Abbau (Demineralisation) und Aufbau (Mineralisation) von Hydroxylapatit, was durch das folgende Gleichgewicht beschrieben werden kann:


 Aufgrund der Ionenzusammensetzung des Speichels kommt es üblicherweise nicht zu einem Auflösen der harten Schmelzschicht und das Gleichgewicht liegt auf der linken Seite.
Nach dem Konsum von säurehaltigen Getränken bzw. Nahrungsmitteln kann es im Speichel, der üblicherweise pH-Werte im neutralen bis schwach sauren Bereich aufweist, zu einem Absenken des pH-Werts kommen.
Aufgrund der Ionenzusammensetzung des Speichels kommt es üblicherweise nicht zu einem Auflösen der harten Schmelzschicht und das Gleichgewicht liegt auf der linken Seite.
Nach dem Konsum von säurehaltigen Getränken bzw. Nahrungsmitteln kann es im Speichel, der üblicherweise pH-Werte im neutralen bis schwach sauren Bereich aufweist, zu einem Absenken des pH-Werts kommen.
Die zusätzlichen -Ionen setzen in der Regel eine Auflösung des Hydroxylapatits in der äußeren Zahnschmelzschicht in Gang, indem sie mit dem Hydroxylapatit reagieren. In dieser Gleichgewichtsreaktion werden Calcium-Ionen freigesetzt und es entstehen Hydrogenphosphat-Ionen und Wasser.
-Ionen setzen in der Regel eine Auflösung des Hydroxylapatits in der äußeren Zahnschmelzschicht in Gang, indem sie mit dem Hydroxylapatit reagieren. In dieser Gleichgewichtsreaktion werden Calcium-Ionen freigesetzt und es entstehen Hydrogenphosphat-Ionen und Wasser.
Sinkt der pH-Wert nach Verzehr eines sauren Lebensmittels unter den für dieses Lebensmittel typischen kritischen pH-Wert so erfolgt eine Auflösung des oberflächlichen Zahnschmelzes.
so erfolgt eine Auflösung des oberflächlichen Zahnschmelzes.
Die Einheit  steht für Millimol, d.h.
steht für Millimol, d.h. 
 Die von den Fluorid-Verbindungen frei gesetzten Fluorid-Ionen bilden zusammen mit im Speichel enthaltenen Calcium- und Phosphat-Ionen das Mineral Fluorapatit,
Die von den Fluorid-Verbindungen frei gesetzten Fluorid-Ionen bilden zusammen mit im Speichel enthaltenen Calcium- und Phosphat-Ionen das Mineral Fluorapatit,  dessen Anwesenheit nach jüngeren Erkenntnissen wiederum die Mineralisation von Hydroxylapatit im Zahnschmelz beschleunigt.
dessen Anwesenheit nach jüngeren Erkenntnissen wiederum die Mineralisation von Hydroxylapatit im Zahnschmelz beschleunigt.
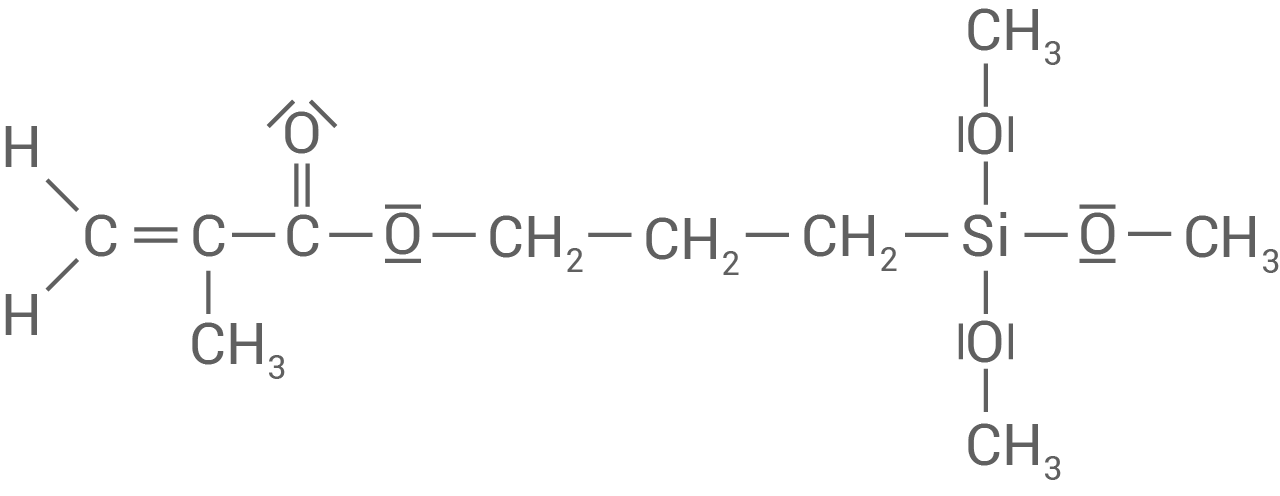 Hinweis
Hinweis
Die Gruppe wird als Methoxy-Gruppe bezeichnet.
wird als Methoxy-Gruppe bezeichnet.
In Analogie zur homologen Reihe der Alkane bezeichnet man unverzweigte oder verzweigte Silicium-Wasserstoff-Verbindungen als Silane. Einfachster Vertreter der Silane ist das Monosilan Monosilan
Monosilan  wird unter Katalysatoreinfluss mit Methanol umgesetzt, wobei Trimethoxysilan und ein weiterer Stoff entstehen.
Silanole:
wird unter Katalysatoreinfluss mit Methanol umgesetzt, wobei Trimethoxysilan und ein weiterer Stoff entstehen.
Silanole:
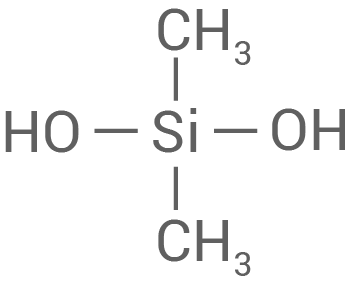
In Analogie zur homologen Reihe der Alkanole bezeichnet man Silicium-Verbindungen, die Hydroxy-Gruppen am Silicium-Atom gebunden haben, als Silanole. Silikon-Polymere:
Silanole mit zwei Hydroxy-Gruppen am Silicium-Atom wie z. B. das Dimethylsilanol neigen zu Polykondensationen, wobei Silikon-Polymere entstehen.
Im Grundgerüst der Silikon-Polymere wechseln sich Silicium-Sauerstoff-Bindungen ab.
Häufig werden Moleküle verwendet, die gemäß folgendem Schema aufgebaut sind:
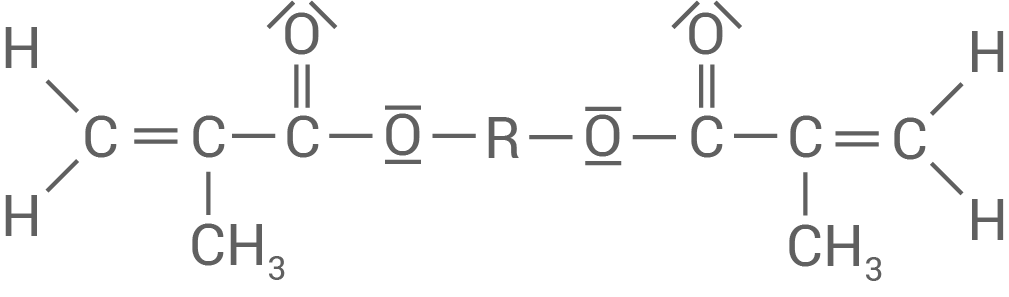 Die Monomere dieser Phase werden mithilfe eines Starters, z. B. eines Peroxids, unter Einwirkung von UV-Licht zur Reaktion gebracht.
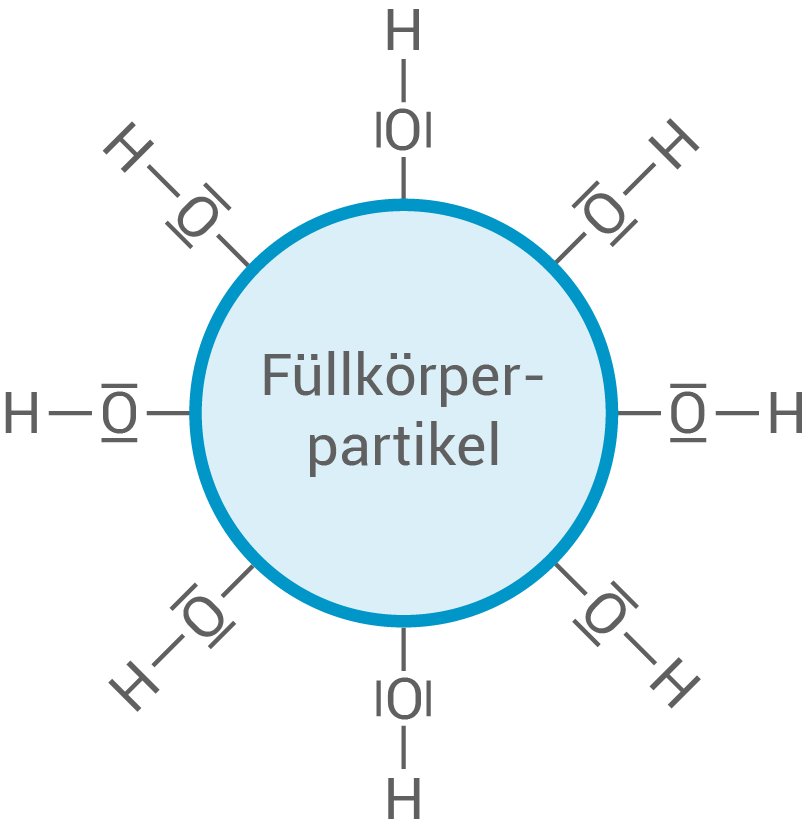
Die anorganische Phase wird auch als Füllkörper bezeichnet und besteht aus vielen Partikeln, die die Füllung widerstandsfähiger machen. Die Partikel bestehen in den meisten Fällen aus Quarz und sind hinsichtlich der Oberflächenstruktur im Folgenden vereinfacht dargestellt:
Die Monomere dieser Phase werden mithilfe eines Starters, z. B. eines Peroxids, unter Einwirkung von UV-Licht zur Reaktion gebracht.
Die anorganische Phase wird auch als Füllkörper bezeichnet und besteht aus vielen Partikeln, die die Füllung widerstandsfähiger machen. Die Partikel bestehen in den meisten Fällen aus Quarz und sind hinsichtlich der Oberflächenstruktur im Folgenden vereinfacht dargestellt:
1.1
Isomaltulose (Material 1) ist ein Disaccharid, in dem je ein Molekül  -D-Glucose und ein Molekül D-Fructose (in der Fünf-Ring-Struktur) über eine
-D-Glucose und ein Molekül D-Fructose (in der Fünf-Ring-Struktur) über eine  -1,6-glycosidische Bindung verknüpft sind.
Zeichne die
-1,6-glycosidische Bindung verknüpft sind.
Zeichne die  -D-Fructose in der Haworth-Projektion (Fünf-Ring-Struktur).
Entwickle die Haworth-Projektion für die Ringform des Disaccharids Isomaltulose.
Erläutere die Bildung des Halbacetals anhand des Ringschlusses der Glucose sowie die Bildung des Acetals durch die Reaktion von
-D-Fructose in der Haworth-Projektion (Fünf-Ring-Struktur).
Entwickle die Haworth-Projektion für die Ringform des Disaccharids Isomaltulose.
Erläutere die Bildung des Halbacetals anhand des Ringschlusses der Glucose sowie die Bildung des Acetals durch die Reaktion von  -D-Glucose mit
-D-Glucose mit  -D-Fructose und benenne den Reaktionsmechanismus, der zur Bildung des Halbacetals führt.
-D-Fructose und benenne den Reaktionsmechanismus, der zur Bildung des Halbacetals führt.
(11 BE)
1.2
Aus der Isomaltulose wird der Zuckeraustauschstoff Isomalt (Material 1) hergestellt.
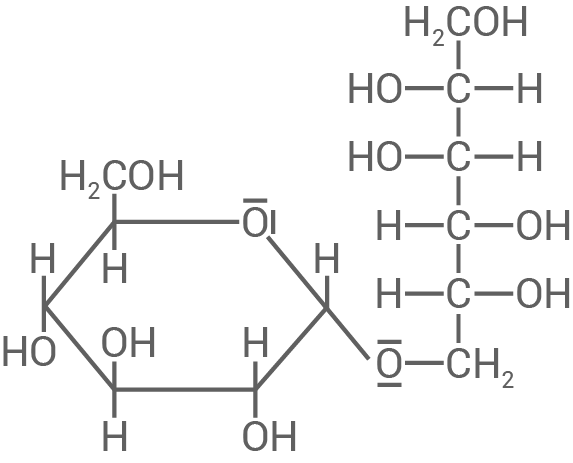
Formuliere – ohne namentliche Zuordnung – jeweils die Strukturformel für die beiden Stereoisomere Glucose-1,6-mannit und Glucose-1,6-sorbit.
Erläutere die Bildung sowie den Unterschied in den Strukturen dieser beiden Produkte und deren stereochemische Beziehung.
Zeige für einen dieser Stoffe anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich bei dessen Bildung um eine Redoxreaktion handelt.
(13 BE)
1.3
Material 2 beschreibt den Aufbau des Zahnschmelzes sowie dessen Beeinflussung durch saure Lebensmittel.
Gib jeweils eine Definition für die Begriffe chemisches Gleichgewicht und pH-Wert an.
Formuliere die Reaktionsgleichung für die vollständige Reaktion von Hydroxylapatit mit  -Ionen aus sauren Lebensmitteln mit Angabe des jeweiligen (Aggregat-)Zustands.
Analysiere die unterschiedliche Toleranz des Zahnschmelzes bezüglich der in Material 3 dargestellten Lebensmittel und erklären Sie diese auch mithilfe von Material 2.
-Ionen aus sauren Lebensmitteln mit Angabe des jeweiligen (Aggregat-)Zustands.
Analysiere die unterschiedliche Toleranz des Zahnschmelzes bezüglich der in Material 3 dargestellten Lebensmittel und erklären Sie diese auch mithilfe von Material 2.
(11 BE)
1.4
Eine bestimmte handelsübliche Zahnpasta für Erwachsene weist einen Fluorid-Ionen-Anteil von  pro
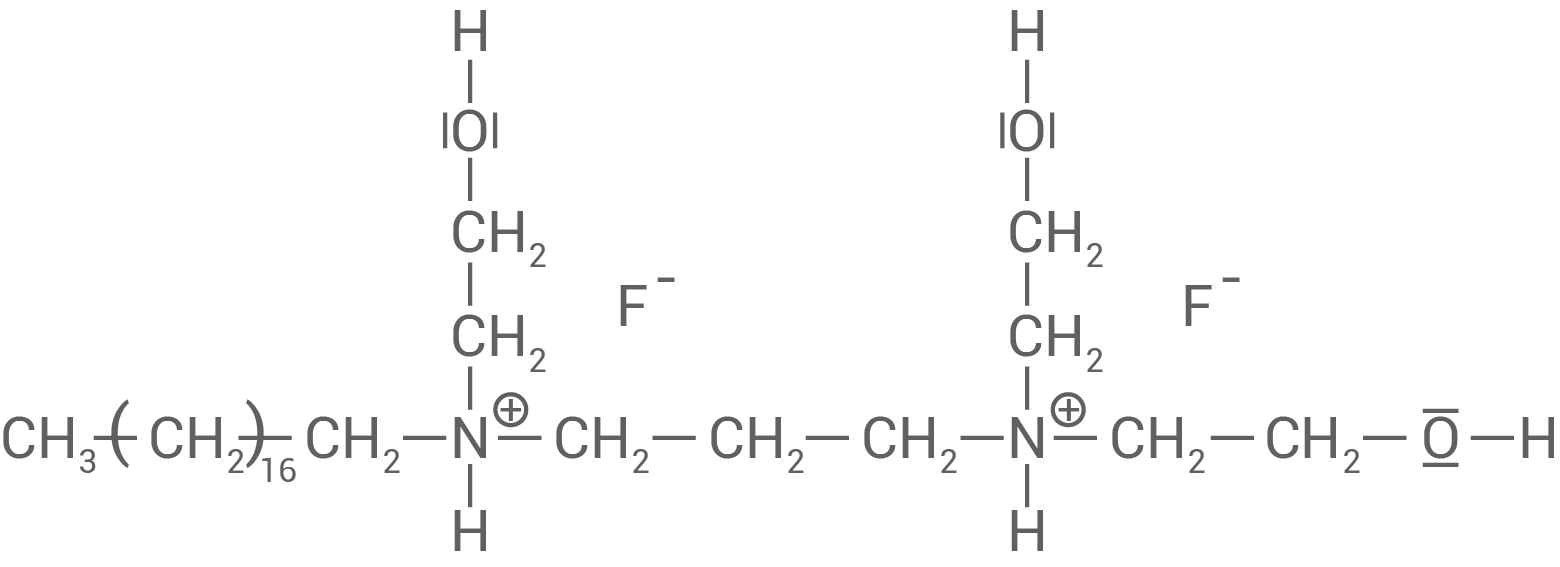
pro  Zahnpasta auf. Die Fluorid-Ionen liegen in Olaflur (Material 4) gebunden vor. Zum Zähneputzen soll eine erbsengroße Menge auf die Zahnbürste aufgetragen werden.
Berechne mithilfe von Material 4 die Stoffmenge an Olaflur, die in einem erbsengroßen Stück Zahnpasta
Zahnpasta auf. Die Fluorid-Ionen liegen in Olaflur (Material 4) gebunden vor. Zum Zähneputzen soll eine erbsengroße Menge auf die Zahnbürste aufgetragen werden.
Berechne mithilfe von Material 4 die Stoffmenge an Olaflur, die in einem erbsengroßen Stück Zahnpasta  entspricht einer Masse von
entspricht einer Masse von  enthalten ist.
enthalten ist.
(4 BE)
1.5
Material 5 zeigt die Strukturformel des Haftvermittlers (3-Methacryloxypropyltrimethoxysilan) im Kompositfüllungswerkstoff. Dieses Molekül enthält als Besonderheit ein Silicium-Atom, das Bindungen ähnlich wie Kohlenstoff-Atome eingehen kann. Ein Strukturelement des Haftvermittlers ist die Silicium-Verbindung Trimethoxysilan.
Material 6 gibt Informationen zu organischen Silicium-Verbindungen und beschreibt einen möglichen Herstellungsprozess für Trimethoxysilan. Formuliere für die Reaktion bei der Herstellung von Trimethoxysilan die Reaktionsgleichung in Strukturformeln und benenne den Reaktionstyp. Beschreibe allgemein das Prinzip einer Polykondensation und formuliere einen möglichen Strukturformelausschnitt aus einem Silikon-Polymer, das aus Dimethylsilanol hergestellt wird.
Material 6 gibt Informationen zu organischen Silicium-Verbindungen und beschreibt einen möglichen Herstellungsprozess für Trimethoxysilan. Formuliere für die Reaktion bei der Herstellung von Trimethoxysilan die Reaktionsgleichung in Strukturformeln und benenne den Reaktionstyp. Beschreibe allgemein das Prinzip einer Polykondensation und formuliere einen möglichen Strukturformelausschnitt aus einem Silikon-Polymer, das aus Dimethylsilanol hergestellt wird.
(5 BE)
1.6
Der Haftvermittler (3-Methacryloxypropyltrimethoxysilan, Material 5) ist in der Lage, die einzelnen Phasen des Kompositfüllungswerkstoffes (Material 7) dauerhaft miteinander zu verbinden. Um seine Wirkung entfalten zu können, wird der Haftvermittler zunächst hydrolysiert, d.h. mit Wasser umgesetzt. Dabei werden im Molekül die Methoxy-Gruppen gegen Hydroxy-Gruppen ausgetauscht, wodurch die chemisch aktive Form des Haftvermittlers entsteht.
Formuliere die Strukturformel der chemisch aktiven Form des Haftvermittlers und erkläre die Wirkung dieser Struktur als Haftvermittler unter Einbeziehung ihrer funktionellen Gruppen und Mehrfachbindungen.
(6 BE)
Material 1
Herstellung von Isomaltulose und Isomalt

Material 2
Hydroxylapatit-Gleichgewicht im Zahnschmelz
Der Zahnschmelz bildet die äußere Schicht der Zähne und besteht zu etwaDie zusätzlichen
Material 3
Einfluss verschiedener saurer Lebensmittel auf die Oberfläche des Zahnschmelzes
Der negative Einfluss auf das Hydroxylapatit in der Oberfläche des Zahnschmelzes ist nicht allein vom pH-Wert des konsumierten Lebensmittels abhängig. Manche sauren Lebensmittel werden je nach ihrer Zusammensetzung unterschiedlich gut vom Zahnschmelz „toleriert“.Sinkt der pH-Wert nach Verzehr eines sauren Lebensmittels unter den für dieses Lebensmittel typischen kritischen pH-Wert
| Cola | Eistee | Joghurt | |
Material 4
Fluorid-Verbindungen zum Erhalt des Zahnschmelzes
Zur Kariesprophylaxe werden einer Zahnpasta unter anderem Fluorid-Verbindungen zugesetzt. Diese Stoffe setzen unter den im Mund herrschenden Bedingungen ihre Fluorid-Ionen frei. Neben Natriumfluorid zeigt besonders auch das seit 1966 eingesetzte Olaflur besondere Wirksamkeit.
Olaflur
Material 5
Strukturformel des Haftvermittlers (3-Methacryloxypropyltrimethoxysilan)
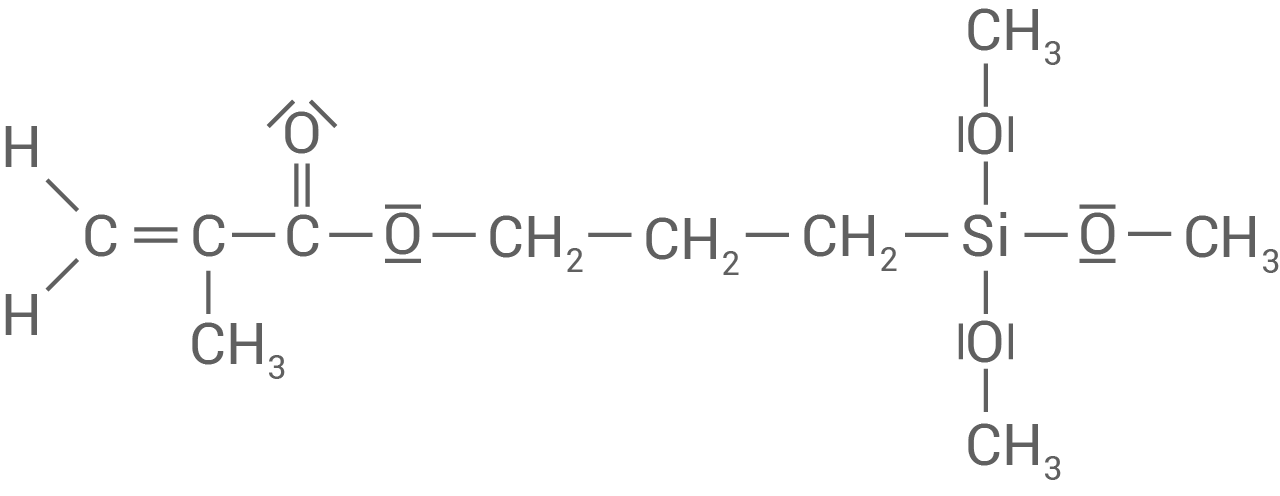
Die Gruppe
Material 6
Organische Silicium-Verbindungen
Silane:In Analogie zur homologen Reihe der Alkane bezeichnet man unverzweigte oder verzweigte Silicium-Wasserstoff-Verbindungen als Silane. Einfachster Vertreter der Silane ist das Monosilan
In Analogie zur homologen Reihe der Alkanole bezeichnet man Silicium-Verbindungen, die Hydroxy-Gruppen am Silicium-Atom gebunden haben, als Silanole. Silikon-Polymere:
Silanole mit zwei Hydroxy-Gruppen am Silicium-Atom wie z. B. das Dimethylsilanol neigen zu Polykondensationen, wobei Silikon-Polymere entstehen.
Im Grundgerüst der Silikon-Polymere wechseln sich Silicium-Sauerstoff-Bindungen ab.

Dimethylsilanol
Material 7
Kompositfüllungswerkstoffe
Kompositfüllungswerkstoffe bestehen mindestens aus zwei Komponenten. Die organische Phase enthält Monomere zur Herstellung eines Kunststoffs.Häufig werden Moleküle verwendet, die gemäß folgendem Schema aufgebaut sind:
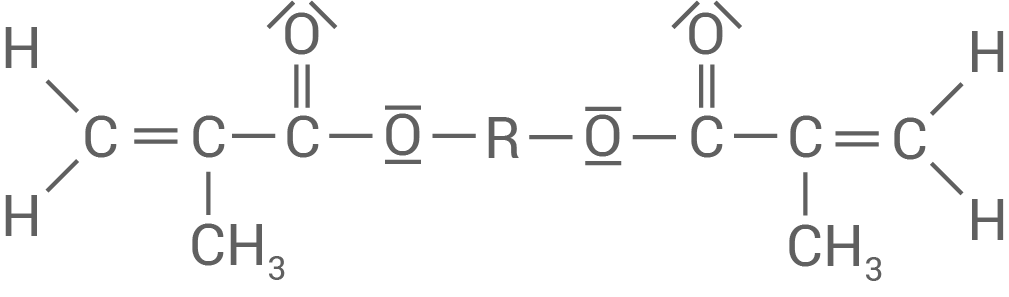
„R“ steht in der Moleküldarstellung für ein organisches Verbindungsstück.

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
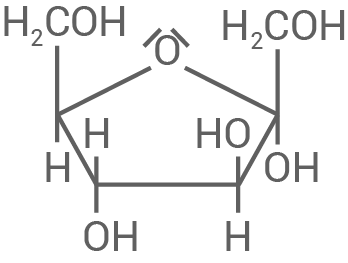
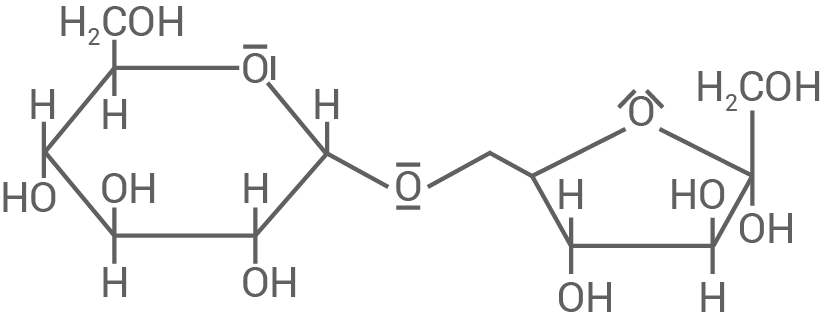
- intramolekulare Gleichgewichtsreaktion
- Bindung vom freien Elektronenpaars des Sauerstoff-Atoms der
-Gruppe von
an
Entstehung eines sechsgliedrigen Rings
- gleichzeitig Umlagerung des Protons an die Carbonyl-Gruppe
- Entstehung der Halbacetal-Gruppe:
-Atom mit Hydroxygruppe ist über ein weiteres O-Atom an eine
-Kette gebunden
- Halbacetal: ringförmiges Glucose-Molekül
Es handelt sich um eine intramolekulare nucleophile Addition. Bildung des Acetals durch die Reaktion von
- Die Hydroxygruppe der
-D-Glucose reagiert mit der Hydroxygruppe an
der
-D-Fructose.
- Es entsteht ein Halbacetal und Aldehydgruppe der
-D-Glucose wird reduziert.
- Acetalbildung:
- Das Oxyanion-Intermediat attackiert die Aldehydgruppe der
-D-Glucose – es entsteht eine neue Bindung zwischen
der
-D-Glucose und dem Sauerstoffatom der
-Gruppe am
der
-D-Fructose.
- Die Aldehydgruppen beider Monosaccharide werden zu Alkoholgruppen reduziert, und es bildet sich ein Acetal.
1.2
Formulierung der Strukturformeln
Bildung und Unterschiede
|
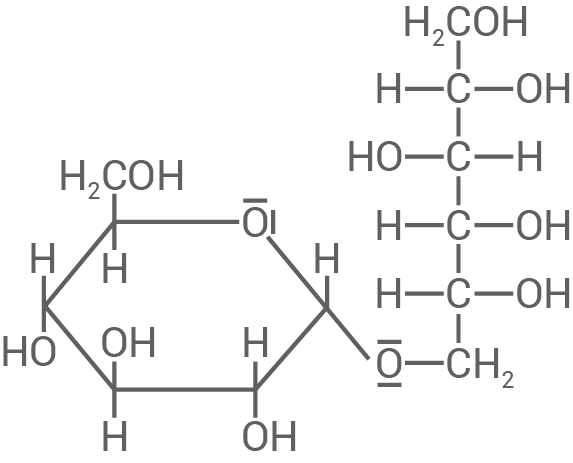
|
- In Isomaltulose wird
hydriert, also reagiert mit Wasserstoff.
- Dieses Kohlenstoffatom ist mit der Carbonylgruppe des Fructosebausteins verbunden und reagiert dabei an der Stelle zu einer Hydroxygruppe.
- Das Kohlenstoffatom, welches zuvor die Carbonyl-Gruppe trug, wird zu einem asymmetrischen (chiralen)
-Atom.
- Die neu gebildete Hydroxygruppe am zweiten Kohlenstoffatom kann entweder auf der rechten oder der linken Seite der Kohlenstoffkette in der Fischer-Projektion platziert werden.
- Dadurch entstehen zwei stereoisomere Produkte, nämlich Glucose-1,6-mannit und Glucose-1,6-sorbit.
- Glucose-1,6-mannitol und Glucose-1,6-sorbit besitzen beide die gleiche molekulare Formel und sind Derivate der Glucose, bei denen die Hydroxygruppe an Position 1 der Glucose mit einer anderen Verbindung verbunden ist: entweder Mannitol oder Sorbit.
- Sie unterscheiden sich folglich in der räumlichen Anordnung der Hydroxygruppen am
-Kohlenstoffatom.
- Beim Glucose-1,6-mannit ist die Hydroxygruppe axial orientiert, während sie beim Glucose-1,6-sorbit äquatorial orientiert ist.
- Da sie sich aber nicht wie Bild und Spiegelbild (Enantiomere) zueinander verhalten, handelt es sich um Diastereomere.
- Oxidation: Die beiden Wasserstoff-Atome geben zwei Elektronen ab und werden oxidiert
0+I
- Reduktion: In der Isomaltulose nimmt das
-Atom der Carbonyl-Gruppe zwei Elektronen auf und wird reduziert
+II0

1.3
Definitionen



 Analyse der unterschiedlichen Toleranz
Alle drei in Material 2 aufgeführten Lebensmittel haben aufgrund ihrer sauren Eigenschaften einen negativen Einfluss auf den pH-Wert im Mund. Dennoch wirken sie sich unterschiedlich auf den Zahnschmelz aus:
Analyse der unterschiedlichen Toleranz
Alle drei in Material 2 aufgeführten Lebensmittel haben aufgrund ihrer sauren Eigenschaften einen negativen Einfluss auf den pH-Wert im Mund. Dennoch wirken sie sich unterschiedlich auf den Zahnschmelz aus:
- Chemisches Gleichgewicht:
Das chemische Gleichgewicht beschreibt den Zustand in einer Reaktion, bei dem die Vorwärts- und Rückwärtsreaktionen die gleiche Geschwindigkeit aufweisen. Dabei bleiben die Stoffkonzentrationen stabil, obwohl die Reaktionen weiterlaufen.
Dieses Konzept basiert auf dem Prinzip von LE CHATELIER und BRAUN bzw. dem Prinzip des kleinsten Zwangs: Wenn externe Bedingungen wie Temperatur, Druck oder Konzentration der Ausgangsstoffe verändert werden, verschiebt sich das Gleichgewicht, um die Veränderung auszugleichen und wiederherzustellen. - pH-Wert:
Der pH-Wert ist ein Maß für die Konzentration der Wasserstoffionenin einer wässrigen Lösung und drückt den sauren oder basischen Charakter dieser Lösung aus.
Es gilt:
- Joghurt beeinträchtigt den Hydroxylapatit im Zahnschmelz erst dann negativ, wenn der pH-Wert unter
liegt.
- Im Gegensatz dazu lösen Cola und Eistee den oberflächlichen Zahnschmelz bereits bei pH-Werten von
bzw.
auf.
- Dieser Unterschied ist auf die verschiedenen Konzentrationen von Ionen in diesen Lebensmitteln zurückzuführen – je höher die Calcium- und Phosphat-Ionen-Konzentration, desto mehr Hydroxylapatit wird aufgebaut, um dem sauren Abbau des Zahnschmelzes entgegenzuwirken.
- In Cola und Eistee ist die Konzentration dieser Ionen besonders gering, weshalb die aufbauende Wirkung deutlich geringer ist.
- Der oberflächliche Zahnschmelz wird bereits bei höheren pH-Werten angegriffen.
1.4
Berechnung der Stoffmenge von Olaflur
Zunächst wird die Masse an Fluorid-Ionen in  Zahnpasta berechnet:
Zahnpasta berechnet:
![\(\begin{array}[t]{rll}
m\,\text{(Fluorid-Ionen)} &=& 0,25\,\text{g} \cdot \dfrac{1,4\,\text{g}}{1\,000\,\text{g}} & \\[5pt]
&=& 3,5 \cdot 10^{-4} \,\text{g}
\end{array}\)](https://mathjax.schullv.de/ec9b12e6d37900d7c69aeed76d338e1ab39baca4ea5ead0f03e5fb94b9674a43?color=5a5a5a) Daraus ergibt sich:
Daraus ergibt sich:
![\(\begin{array}[t]{rll}
n &=& \dfrac{m}{M} & \\[5pt]
n(F^-) &=& \dfrac{3,5 \cdot 10^{-4} \,\text{g}}{19\,\text{g} \cdot \text{mol}^{-1} }& \\[5pt]
& \approx & 1,84 \cdot 10^{-5}\,\text{mol} & \\[10pt]
n\,\text{(Olaflur)} &=& \dfrac{1}{2} \cdot n(F^-)& \\[5pt]
& \approx & 9,2 \cdot 10^{-6} \,\text{mol}
\end{array}\)](https://mathjax.schullv.de/8cd8f3875b125a6b34b4c736131d9279da40bc9a508af6c77a6961112798f7c2?color=5a5a5a) In einem erbsengroßen Stück Zahnpasta sind etwa
In einem erbsengroßen Stück Zahnpasta sind etwa  Olaflur enthalten.
Olaflur enthalten.
1.5
Reaktionsgleichung für die Herstellung von Trimethoxysilan
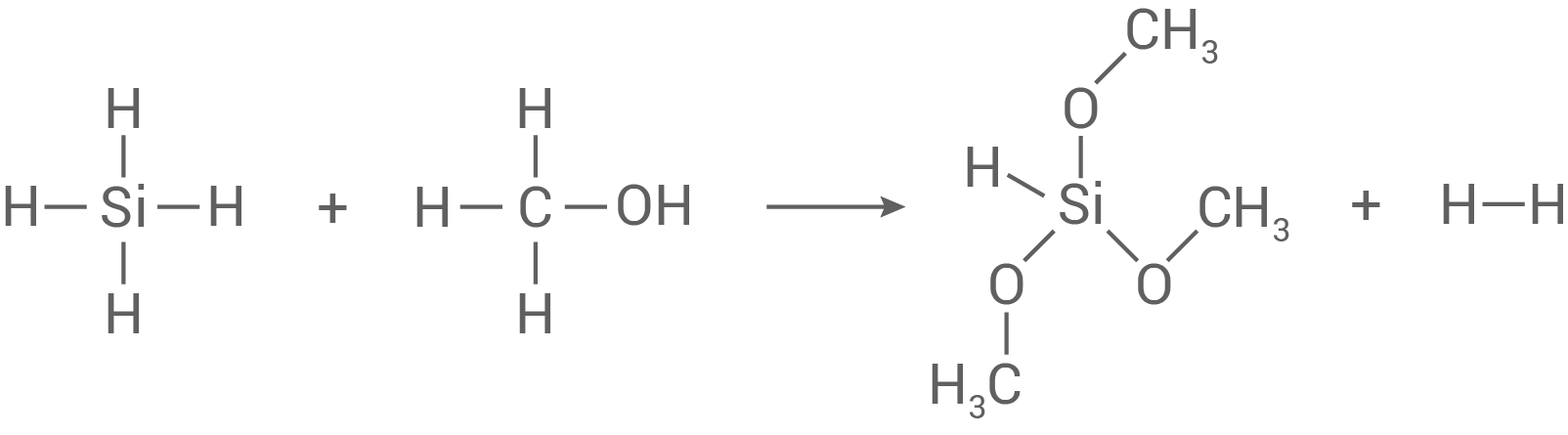 stöchiometrisch ausgeglichene Reaktionsgleichung:
stöchiometrisch ausgeglichene Reaktionsgleichung:


 Reaktionstyp
Es handelt sich um eine nucleophile Substitutionsreaktion. Hierbei wird das Sauerstoffatom aus dem Methanolmolekül in das Silanmolekül eingefügt, wobei Wasserstoffatome ersetzt werden. Diese Reaktion wird als Alkoholyse oder Methanolysis bezeichnet.
Prinzip einer Polykondensation
Reaktionstyp
Es handelt sich um eine nucleophile Substitutionsreaktion. Hierbei wird das Sauerstoffatom aus dem Methanolmolekül in das Silanmolekül eingefügt, wobei Wasserstoffatome ersetzt werden. Diese Reaktion wird als Alkoholyse oder Methanolysis bezeichnet.
Prinzip einer Polykondensation
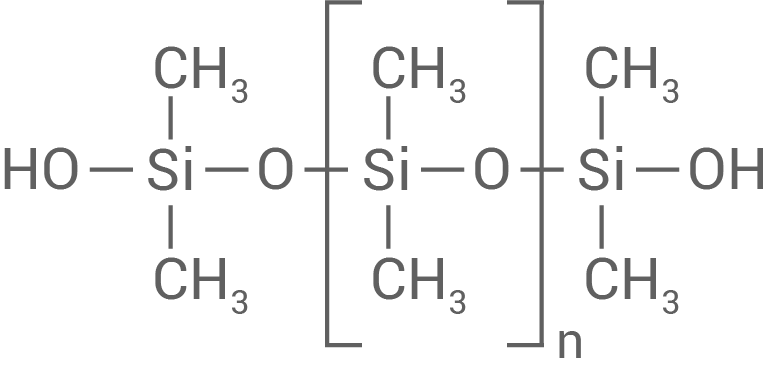

(stöchiometrisch nicht genau)
- Bei einer Polykondensationsreaktion reagieren zwei Monomere miteinander, wobei eines üblicherweise zwei funktionelle Gruppen wie Carbonsäure- oder Carbonsäurechloridgruppen aufweist und das andere zwei Hydroxygruppen.
- Die funktionellen Gruppen der Monomere reagieren miteinander, wobei kovalente Bindungen zwischen den Monomeren entstehen. Gleichzeitig wird ein kleines Molekül (meist Wasser) abgespalten.
- Die Reaktion setzt sich fort, wodurch die Polymerkette wächst, da immer mehr Monomere miteinander verknüpft werden.
- Die Polykondensation ist auch als Polymerisation bekannt.

1.6
Strukturformel der chemisch aktiven Form
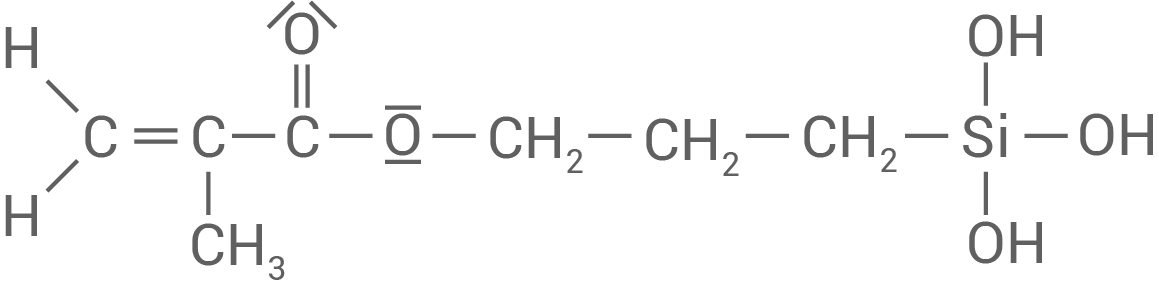 Wirkung der Struktur als Haftvermittler
Wirkung der Struktur als Haftvermittler
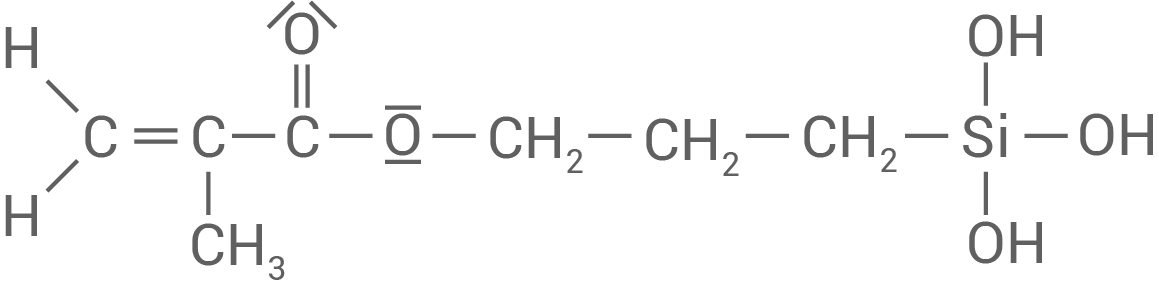
- Funktionelle Gruppen: Hydroxygruppen
Siloxangruppe
Estergruppe
Die funktionellen Gruppen können mit der Oberfläche des Substrat oder mit dem Material reagieren. Durch intermolekulare Wechselwirkungen wie Van-der-Waals-Kräfte, Wasserstoffbrückenbindungen und ionische Wechselwirkungen wird die Haftung verbessert.
- Hydroxygruppen: Es können Wasserstoffbrücken zwischen dem aktiven Haftvermittler und dem Füllkörper ausgebildet werden.
- Mehrfachbindungen: Doppelbindung Die Doppelbindungen können mit Monomer-Bausteinen des organischen Kunststoffs radikalisch polymerisieren.