Vorschlag C – Chemische Synthesen
Methan ist der einfachste Kohlenwasserstoff und dient als Grundstoff für verschiedene organische Synthesen. So kann z.B. Methanol daraus hergestellt werden.
Zur Herstellung von Methan kann Kohlenstoffdioxid mit Wasserstoff in einer zweischrittigen Gleichgewichtsreaktion zu Methangas und Wasserdampf umgesetzt werden. Diese Reaktion wird nach ihrem Entdecker als Sabatier-Reaktion bezeichnet.
Aus Methan lässt sich Methanol herstellen, das seinerseits mit Methanal reagieren kann.
Wird Methanal mit Ethanal umgesetzt, so entsteht ein Molekül, das sowohl eine Carbonyl-Gruppe als auch eine Hydroxy-Gruppe beinhaltet und daher zu einer Stoffgruppe zählt, die auch als „Aldole“ bezeichnet wird.
Die zugehörige Reaktionsgleichung für die Gesamtreaktion lautet: 
 bei
bei  Gleichgewichtskonzentrationen:
Gleichgewichtskonzentrationen:
In der amerikanischen Weltraumbehörde NASA wird aktuell daran geforscht, inwieweit die Sabatier-Reaktion zusammen mit der Zersetzung von Methan in die Elemente (Pyrolyse) zur Lösung der Versorgungsprobleme bei Weltraummissionen beitragen könnte.
Die entscheidenden Reaktionsgleichungen sind im Folgenden dargestellt:
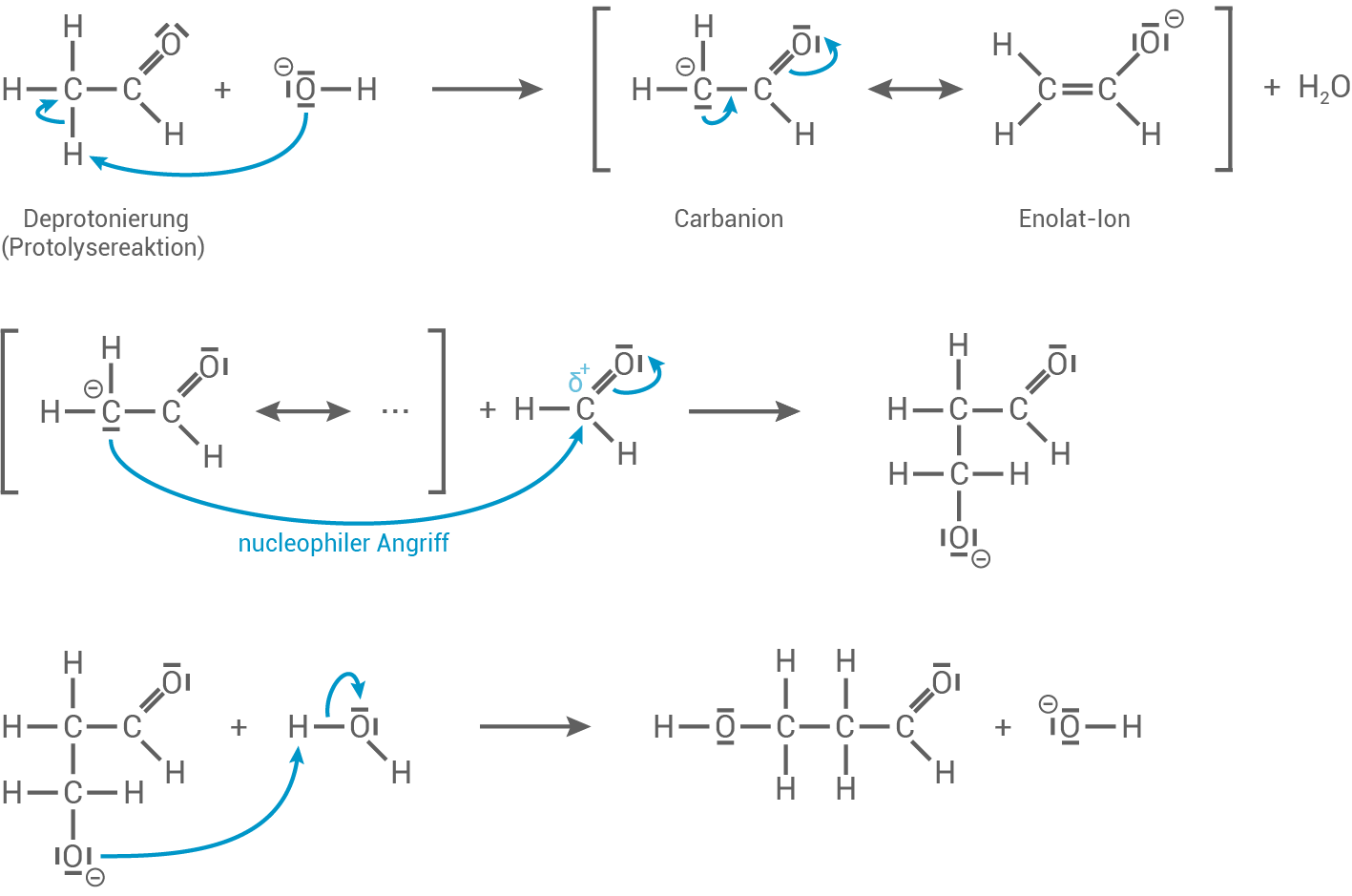
 -Atom eine der drei C-H-Bindungen heterolytisch gespalten wird. Dabei bildet sich ein Ion aus, für das sich mesomere Grenzstrukturen formulieren lassen. Eine dieser mesomeren Grenzstrukturen entspricht einem Carbanion, das am
-Atom eine der drei C-H-Bindungen heterolytisch gespalten wird. Dabei bildet sich ein Ion aus, für das sich mesomere Grenzstrukturen formulieren lassen. Eine dieser mesomeren Grenzstrukturen entspricht einem Carbanion, das am  -Atom eine negative Ladung trägt. Die zweite mesomere Grenzstruktur entspricht einem Enolat-Ion, das eine C-C-Doppelbindung und eine negative Ladung am Sauerstoff-Atom beinhaltet. Außerdem wird bei diesem Reaktionsschritt Wasser freigesetzt.
Anschließend greifen die in der Enolat-Struktur zwischen den beiden Kohlenstoff-Atomen dargestellten
-Atom eine negative Ladung trägt. Die zweite mesomere Grenzstruktur entspricht einem Enolat-Ion, das eine C-C-Doppelbindung und eine negative Ladung am Sauerstoff-Atom beinhaltet. Außerdem wird bei diesem Reaktionsschritt Wasser freigesetzt.
Anschließend greifen die in der Enolat-Struktur zwischen den beiden Kohlenstoff-Atomen dargestellten  -Elektronen die Carbonylgruppe des Methanal-Moleküls nucleophil an. Dadurch entsteht eine Struktur, die an einem Ende ein negativ geladenes Sauerstoff-Atom und am anderen Ende eine Aldehyd-Gruppe beinhaltet.
Im letzten Reaktionsschritt reagiert diese Struktur mit Wasser, wobei sich die Aldol-Struktur ausbildet und zugleich der Katalysator zurückgewonnen wird. Die Aldol-Struktur beinhaltet neben der Aldehyd-Gruppe auch eine Hydroxy-Gruppe.
-Elektronen die Carbonylgruppe des Methanal-Moleküls nucleophil an. Dadurch entsteht eine Struktur, die an einem Ende ein negativ geladenes Sauerstoff-Atom und am anderen Ende eine Aldehyd-Gruppe beinhaltet.
Im letzten Reaktionsschritt reagiert diese Struktur mit Wasser, wobei sich die Aldol-Struktur ausbildet und zugleich der Katalysator zurückgewonnen wird. Die Aldol-Struktur beinhaltet neben der Aldehyd-Gruppe auch eine Hydroxy-Gruppe.
Zur Herstellung von Methan kann Kohlenstoffdioxid mit Wasserstoff in einer zweischrittigen Gleichgewichtsreaktion zu Methangas und Wasserdampf umgesetzt werden. Diese Reaktion wird nach ihrem Entdecker als Sabatier-Reaktion bezeichnet.
Aus Methan lässt sich Methanol herstellen, das seinerseits mit Methanal reagieren kann.
Wird Methanal mit Ethanal umgesetzt, so entsteht ein Molekül, das sowohl eine Carbonyl-Gruppe als auch eine Hydroxy-Gruppe beinhaltet und daher zu einer Stoffgruppe zählt, die auch als „Aldole“ bezeichnet wird.
3.1
Formuliere zu den beiden Schritten der Sabatier-Reaktion jeweils die Reaktionsgleichung (Material 1).
Zeige anhand der wesentlichen Oxidationszahlen und der Elektronenübergänge, dass es sich beim zweiten Reaktionsschritt um eine Redoxreaktion handelt.
Ermittle mit Hilfe der Reaktionsgleichung für die Gesamtreaktion (Material 1), wie sich über die Regulierung des Drucks im Reaktionsgefäß die Sabatier-Reaktion so beeinflussen lässt, dass insgesamt möglichst viel Methan entsteht.
Begründe in Bezug auf die Gesamtreaktion, weshalb man in der technischen Umsetzung die Steigerung der Reaktionsgeschwindigkeit nicht durch eine sehr hohe Reaktionstemperatur herbeiführt und weshalb diese Steigerung durch den Einsatz eines Katalysators erzielt werden kann.
(12 BE)
3.2
Formuliere das Massenwirkungsgesetz für Schritt 2 der Sabatier-Reaktion und beschreibe mit Hilfe von Material 2 die Lage des entsprechenden Gleichgewichts.
Berechne mit Hilfe von Material 2 die Konzentration an Methan im chemischen Gleichgewicht.
(5 BE)
3.3
In Material 3 wird die Anwendung der Sabatier-Reaktion im Rahmen von Weltraummissionen beschrieben.
Beurteile den Forschungsansatz der NASA (Material 3) unter Einbezug der dargestellten Reaktionsgleichungen.
(8 BE)
3.4
Aus Methan ist durch zwei aufeinander folgende Reaktionen Methanol herstellbar (Material 4).
Formuliere für Reaktion 1 (Material 4) die Reaktionsgleichung und benenne den Reaktionsmechanismus.
Formuliere für Reaktion 2 den Reaktionsmechanismus und begründe, weshalb die Reaktion nach diesem Mechanismus abläuft.
(10 BE)
3.5
Methanol kann mit Methanal oder mit Ethanal zur Reaktion gebracht werden.
Formuliere für die Reaktion von Methanol mit Methanal unter Säurekatalyse den Reaktionsmechanismus und benenne den Reaktionsmechanismus sowie die Stoffklasse des Reaktionsprodukts.
Entscheide, ob das Reaktionsprodukt der Reaktion von Methanol mit Methanal sowie das Reaktionsprodukt der entsprechenden Reaktion von Methanol mit Ethanal jeweils optisch aktiv ist oder nicht.
(9 BE)
3.6
Methanal kann mit Ethanal zu einem sogenannten Aldol reagieren.
Entwickle mit Hilfe von Material 5 einen Reaktionsmechanismus für die basenkatalysierte Aldolbildung.
(6 BE)
(50 BE)
Material 1
Reaktionsschritte der Sabatier-Reaktion
Die Sabatier-Reaktion kann als Abfolge von zwei Schritten betrachtet werden: Schritt 1: Kohlenstoffdioxid reagiert mit Wasserstoff zu Kohlenstoffmonooxid und Wasser. Schritt 2: Das entstandene Kohlenstoffmonooxid reagiert mit Wasserstoff zu Methan und Wasser. Für die beiden Schritte lassen sich unter Standardbedingungen folgende Reaktionsenthalpien messen:| Schritt 1 | |
|---|---|
| Schritt 2 |
Material 2
Daten zur Gleichgewichtsreaktion in Schritt 2 der Sabatier-Reaktion
Material 3
Die Sabatier-Reaktion in der Weltraumforschung
Bei längeren Aufenthalten von Menschen im Weltraum, wie etwa auf der internationalen Raumstation ISS, muss die Versorgung dieser Astronauten mit allen notwendigen Stoffen gewährleistet werden. So wird regelmäßig unter großem finanziellen und technischen Aufwand Wasser von der Erde zur ISS transportiert. Ein großer Teil dieses Wassers wird mit Hilfe von ausreichend vorhandenem Solarstrom elektrolysiert, wodurch die Elemente Sauerstoff und Wasserstoff entstehen. So lässt sich Sauerstoff für die Astronauten gewinnen. Der ebenfalls entstehende Wasserstoff wird teilweise als Abfall ins All abgegeben, genauso wie das von den Astronauten ausgeatmete Kohlenstoffdioxid.In der amerikanischen Weltraumbehörde NASA wird aktuell daran geforscht, inwieweit die Sabatier-Reaktion zusammen mit der Zersetzung von Methan in die Elemente (Pyrolyse) zur Lösung der Versorgungsprobleme bei Weltraummissionen beitragen könnte.
Die entscheidenden Reaktionsgleichungen sind im Folgenden dargestellt:
Material 4
Herstellung von Methanol aus Methan
Reaktion 1:
Methan reagiert unter Lichteinfluss mit Chlor zu Monochlormethan.
Reaktion 2:
Monochlormethan reagiert mit Natronlauge, wobei als organisches Reaktionsprodukt Methanol entsteht.
Material 5
Mechanismus der basenkatalysierten Aldol-Bildung durch Reaktion von Ethanal mit Methanal
Durch Einwirkung eines Hydroxid-Ions wird das Ethanal-Molekül deprotoniert, indem amWeiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
3.1
Reaktionsgleichungen
Schritt 1:
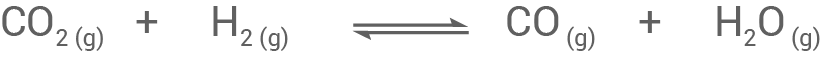 Schritt 2:
Schritt 2:
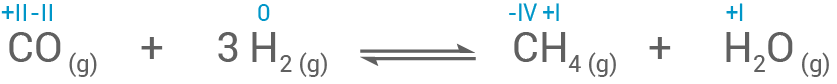
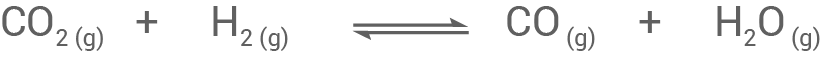

- Die Oxidationszahlen der Reaktionsgleichung von Schritt 2 zeigen eine Redoxreaktion.
- Der Wasserstoff gibt zwei Elektronen ab und wird damit oxidiert: +/- 0
+ I
- Der Kohlenstoff hingegen nimmt sechs Elektronen auf und wird reduziert: + II
- IV
- Insgesamt werden sechs Elektronen übertragen.
- Die gegebene Gesamtgleichung befindet sich im Gleichgewicht und es lässt sich dadurch das Prinzip von LE CHATELIER und BRAUN, also das Prinzip des kleinsten Zwangs, anwenden.
- Ein äußerer Zwang, der auf ein im Gleichgewicht befindliches System ausgeübt wird, verschiebt demnach das Gleichgewicht so, dass dieser ausgeglichen wird.
- Bei einer Druckerhöhung verschiebt sich das Gleichgewicht somit auf die Seite mit dem kleineren Volumen, also die Seite mit weniger gasförmigen Teilchen.
- Die Reaktionsgleichung zeigt auf der Eduktseite
gasförmige Teilchen und auf der Produktseite
- Wird der Druck also möglichst hoch gewählt, verschiebt sich das Gleichgewicht auf die Produktseite und die Methanausbeute wird erhöht.
- Die Reaktionsgeschwindigkeit lässt sich nicht durch Temperaturerhöhung herbeiführen, da auch hier das Prinzip von LE CHATELIER und BRAUN wirkt.
- Nach dem Prinzip wird bei einer höheren Temperatur, die endotherme Reaktion bevorzugt.
- Bei dieser Gesamtreaktion handelt es sich jedoch um eine exotherme Reaktion
- Die RGT-Regel sagt zwar voraus, dass durch die Erhöhung der Temperatur die Reaktionsgeschwindigkeit gesteigert werden kann, allerdings würde dann die Rückreaktion bevorzugt werden.
- Um also eine hohe Methanausbeute zu erzielen, ist es wichtig eine niedrige Temperatur zu wählen.
- Damit eine zu niedrige Reaktion aber nicht zu einer Abnahme der Reaktionsgeschwindigkeit führt, ist der Einsatz eines Katalysators erforderlich.
- Durch einen Katalysator wird die Aktivierungsenergie herabgesetzt und die Reaktion kann bei niedrigen Temperaturen mit einer angemessenen Reaktionsgeschwindigkeit ablaufen.
3.2
Massenwirkungsgesetz für den 2. Schritt
 Gegeben ist
Gegeben ist  daher leigt das Gleichgewicht auf der Seite der Produkte.
Berechnung der Konzentration an Methan
Durch Umstellung des Massenwirkungsgesetzes gilt:
Im chemischen Gleichgewicht beträgt die Konzentration von Methan ca.
daher leigt das Gleichgewicht auf der Seite der Produkte.
Berechnung der Konzentration an Methan
Durch Umstellung des Massenwirkungsgesetzes gilt:
Im chemischen Gleichgewicht beträgt die Konzentration von Methan ca. 
3.3
Beurteilung des Forschungsansatzes der NASA
- Wie in Material 3 beschrieben, muss auf einer Raumstation die Versorgung der Astronauten mit allen notwendigen Stoffen (Sauerstoff, Wasser) gewährleistet werden.
- Eine Herausforderung ist daher, dass diese Versorgung dauerhaft ist.
- Das durch Elektrolyse gewonnene Wasser wird bislang von der Erde zur Raumstation transportiert, was mit hohem technischen und vor allem finanziellen Aufwand verbunden ist.
- Am besten wäre also eine von der Erde unabhängige Versorgung.
- Die gegebenen Reaktionsgleichungen stellen einen möglichen Kreislaufprozess dar, wodurch der verbrauchte Sauerstoff und das Wasser wiedergewonnen werden können:
Elektrolyse von Wasser
SABATIER-Reaktion
Protolysereaktion
- Zuerst liefert die Elektrolyse von Wasser mit Solarstrom Wasserstoff und Sauerstoff
- Die Wiedergewinnung des verbrauchten Wassers geschieht durch die Reaktion von Wasserstoff mit
aus der Atemluft. Dabei wird zusätzlich Methan frei
- Darauffolgend wird das entstandene Methan durch Protolyse in Wasserstoff und Kohlenstoff zersetzt
- So wird Wasserstoff wiedergewonnen, der als erneutes Edukt in die SABATIER-Reaktion
eingeleitet wird.
- Dieser Forschungsansatz zielt darauf ab, Wasser zurückzugewinnen und dieses zurück in den Kreislaufprozess zu führen. Somit wird nichts in das All abgegeben und verschwendet.
- Die Gesamtreaktion zeigt, dass
aus der Atemluft hier eine indirekte Sauerstoffquelle sein könnte.
- Der nebenbei entstehende Kohlenstoff kann zwar nicht genutzt werden, ist aber ungiftig und leicht zu lagern.
- Der in Material 3 dargestellte Kreisprozess zeigt eine dauerhafte Möglichkeit, die Astronauten der Raumstation kostengünstig zu versorgen.
3.4
Reaktionsgleichung und Mechanismus für Reaktion 1


 Der Mechanismus ist eine radikalische Substitution.
Reaktionsmechanismus für Reaktion 2
Der Mechanismus ist eine radikalische Substitution.
Reaktionsmechanismus für Reaktion 2
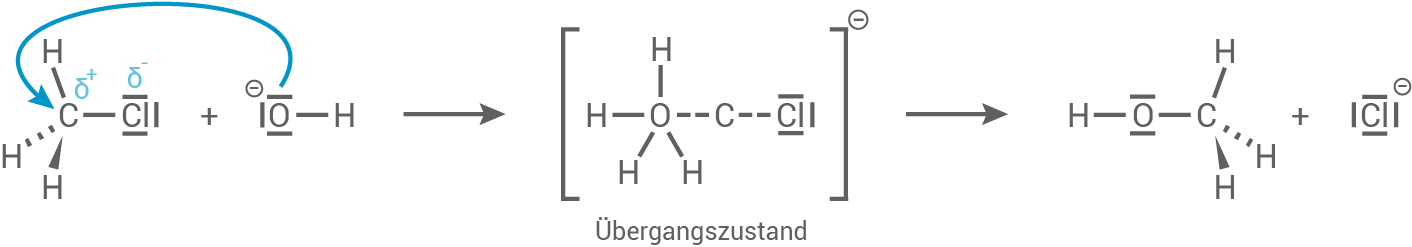

- Es handelt sich um eine nucleophile Substitution.
- Das Hydroxid-Ion ist ein starkes Nucleophil und greift das positiv polarisierte
-Atom an. Dieser Angriff geschieht bevor
(Abgangsgruppe) abgespalten wird, wie der Übergangszustand darstellt.
- Da das Edukt ein primäres
-Atom ist und somit nicht sterisch gehindert ist, handelt es sich hierbei um einen
-Mechanismus.
- Bei einem
-Mechanismus hingegen würde sich nach Abgang des Chlorid-Ions ein Carbokation mit schlechter Stabilisierung bilden.
3.5
Säurekatalysierter Reaktionsmechanismus
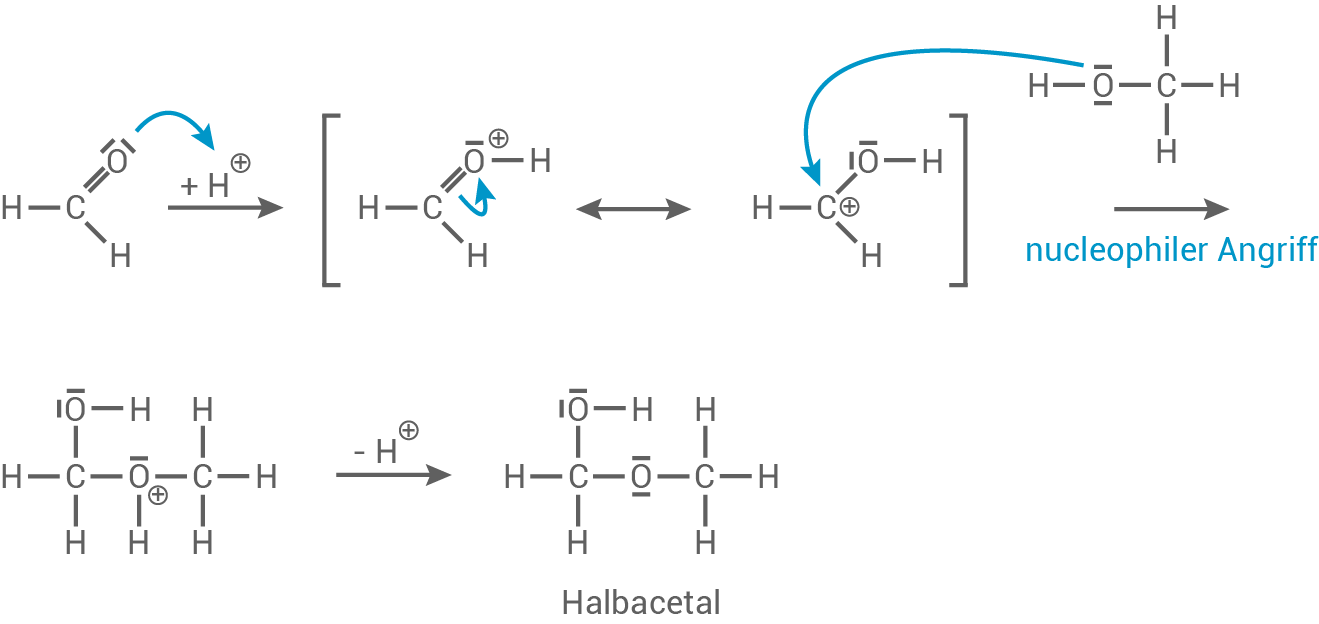 Die Reaktion von Methanol mit Methanal verläuft nach dem Mechanismus einer nucleophilen Addition. Als Reaktionsprodukt entsteht ein Halbacetal.
Optische Aktivität
Ein Molekül ist optisch aktiv, wenn mind. ein Kohlenstoffatom vier verschiedene Substituenten aufweist und es dadurch in der Lage ist, linear polarisiertes Licht in dessen Schwingungsebene zu drehen.
Die Reaktion von Methanol mit Methanal verläuft nach dem Mechanismus einer nucleophilen Addition. Als Reaktionsprodukt entsteht ein Halbacetal.
Optische Aktivität
Ein Molekül ist optisch aktiv, wenn mind. ein Kohlenstoffatom vier verschiedene Substituenten aufweist und es dadurch in der Lage ist, linear polarisiertes Licht in dessen Schwingungsebene zu drehen.

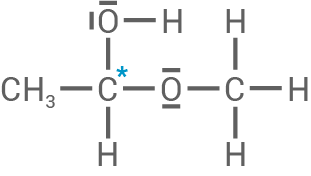
- Das Reaktionsprodukt von Methanol und Methanal zeigt ein Halbacetal, bei dem keines der
-Atome vier verschiedene Substituenten hat. Damit ist es nicht optisch aktiv.
- Das Reaktionsprodukt von Methanol und Ethanal hingegen besitzt ein Kohlenstoffatom mehr:
3.6
Reaktionsmechanismus für die basenkatalysierte Aldolbildung