Vorschlag A – Chloramphenicol
Chloramphenicol ist ein Breitbandantibiotikum, das zur Behandlung bakterieller Infektionskrankheiten eingesetzt wird. Außer in Form von Tabletten kann es auch in Form von Salben oder Tropfen eingesetzt werden, zum Beispiel zur Behandlung von Augeninfektionen.
Tabletten und Salben enthalten neben dem Wirkstoff noch zahlreiche weitere Bestandteile. Beispielsweise werden als Füllmittel bei Tabletten Stärke oder Saccharose verwendet.
Wie viele andere Arzneistoffe weist auch Chloramphenicol einen bitteren Geschmack auf, den viele Patienten als unangenehm empfinden. Um den bitteren Geschmack zu umgehen, kann Chloramphenicol mit einer langkettigen Carbonsäure verestert werden.
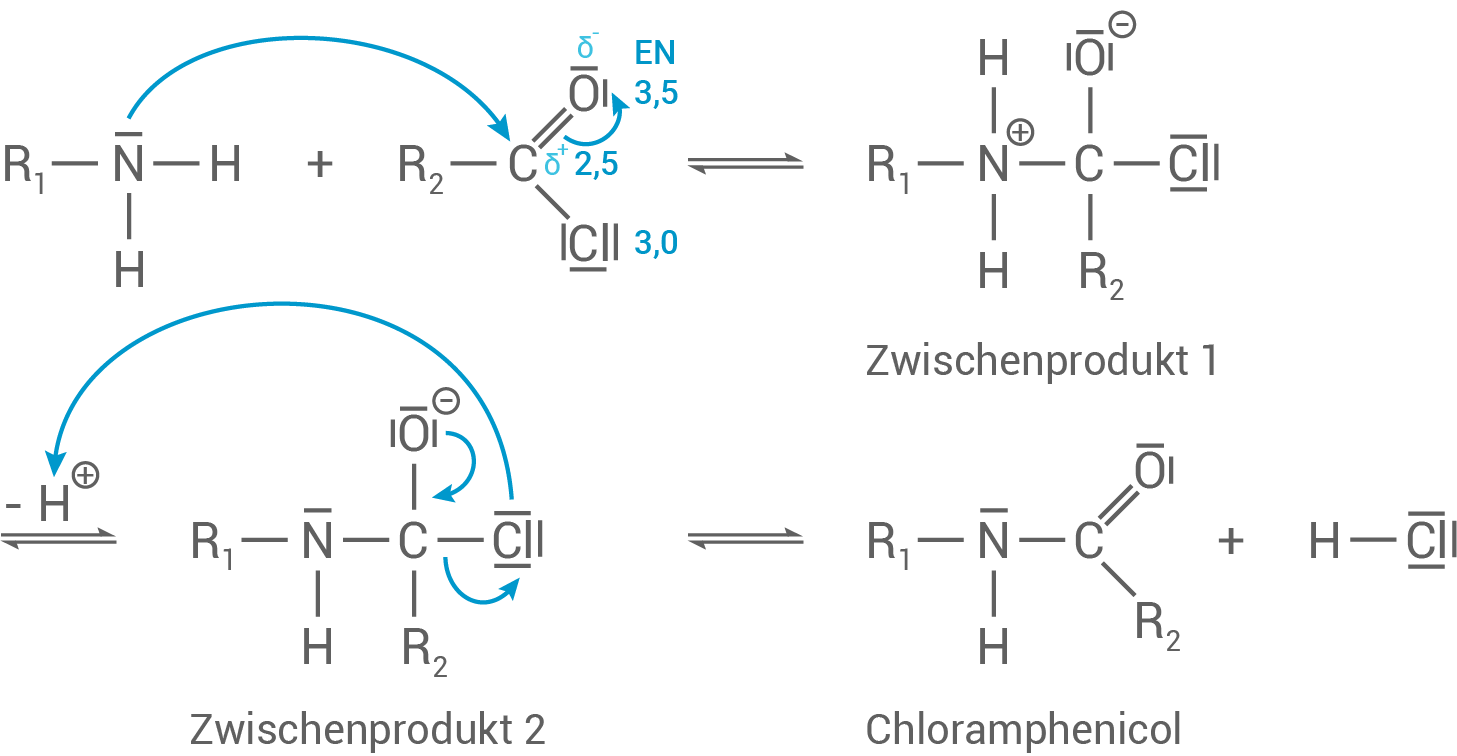
 Schritt 1: Die Verbindung aus Material 1 reagiert mit Dichlorethansäurechlorid zum Zwischenprodukt 1. Hierbei greift die mit „B“ bezeichnete funktionelle Gruppe der Verbindung aus dem Material 1 nucleophil am Kohlenstoff-Atom der funktionellen Gruppe des Dichlorethansäurechlorids an. Das Zwischenprodukt 1 enthält eine positive Ladung am Stickstoff-Atom und eine negative Ladung am Sauerstoff-Atom.
Schritt 2: Aus Zwischenprodukt 1 wird vom Stickstoff-Atom ein Proton abgespalten. Es entsteht Zwischenprodukt 2, das ein Anion ist.
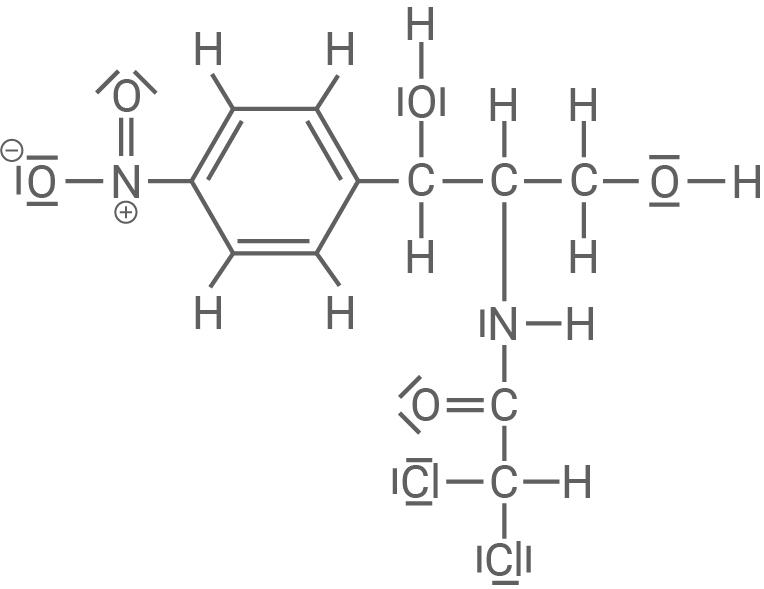
Schritt 3: Das negativ geladene Zwischenprodukt 2 spaltet ein Chlorid-Ion ab. Es entsteht das Produkt Chloramphenicol.
Schritt 1: Die Verbindung aus Material 1 reagiert mit Dichlorethansäurechlorid zum Zwischenprodukt 1. Hierbei greift die mit „B“ bezeichnete funktionelle Gruppe der Verbindung aus dem Material 1 nucleophil am Kohlenstoff-Atom der funktionellen Gruppe des Dichlorethansäurechlorids an. Das Zwischenprodukt 1 enthält eine positive Ladung am Stickstoff-Atom und eine negative Ladung am Sauerstoff-Atom.
Schritt 2: Aus Zwischenprodukt 1 wird vom Stickstoff-Atom ein Proton abgespalten. Es entsteht Zwischenprodukt 2, das ein Anion ist.
Schritt 3: Das negativ geladene Zwischenprodukt 2 spaltet ein Chlorid-Ion ab. Es entsteht das Produkt Chloramphenicol.
1.1
Benenne für Saccharose und für lösliche Stärke (Amylose) jeweils die Monosaccharid-Bausteine und ihre Verknüpfungsart.
Zeichne einen Strukturformelausschnitt aus einem Amylose-Molekül mit drei Monosaccharid-Einheiten.
Erläutere eine Nachweisreaktion, mit der sich Stärke und Saccharose voneinander unterscheiden lassen.
(10 BE)
1.2
Ein Zwischenprodukt bei der Synthese von Chloramphenicol ist Dichlorethansäure.
Dichlorethansäure und Ethansäure sind zwei Carbonsäuren, die sich in ihren Strukturen ähneln. Beide Säuren sind jedoch unterschiedlich stark. Die -Werte betragen
-Werte betragen  und
und  Zeichne jeweils die Strukturformel von Dichlorethansäure und Ethansäure mit allen bindenden und nichtbindenden Elektronenpaaren.
Formuliere die Reaktionsgleichung für die Reaktion von Dichlorethansäure mit Wasser sowie den Formelausdruck für die Berechnung des
Zeichne jeweils die Strukturformel von Dichlorethansäure und Ethansäure mit allen bindenden und nichtbindenden Elektronenpaaren.
Formuliere die Reaktionsgleichung für die Reaktion von Dichlorethansäure mit Wasser sowie den Formelausdruck für die Berechnung des  -Werts.
Ordne die oben genannten
-Werts.
Ordne die oben genannten  -Werte der Dichlorethansäure sowie der Ethansäure zu und erläutere deine Zuordnung anhand der Strukturformeln.
-Werte der Dichlorethansäure sowie der Ethansäure zu und erläutere deine Zuordnung anhand der Strukturformeln.
Dichlorethansäure und Ethansäure sind zwei Carbonsäuren, die sich in ihren Strukturen ähneln. Beide Säuren sind jedoch unterschiedlich stark. Die
(11 BE)
1.3
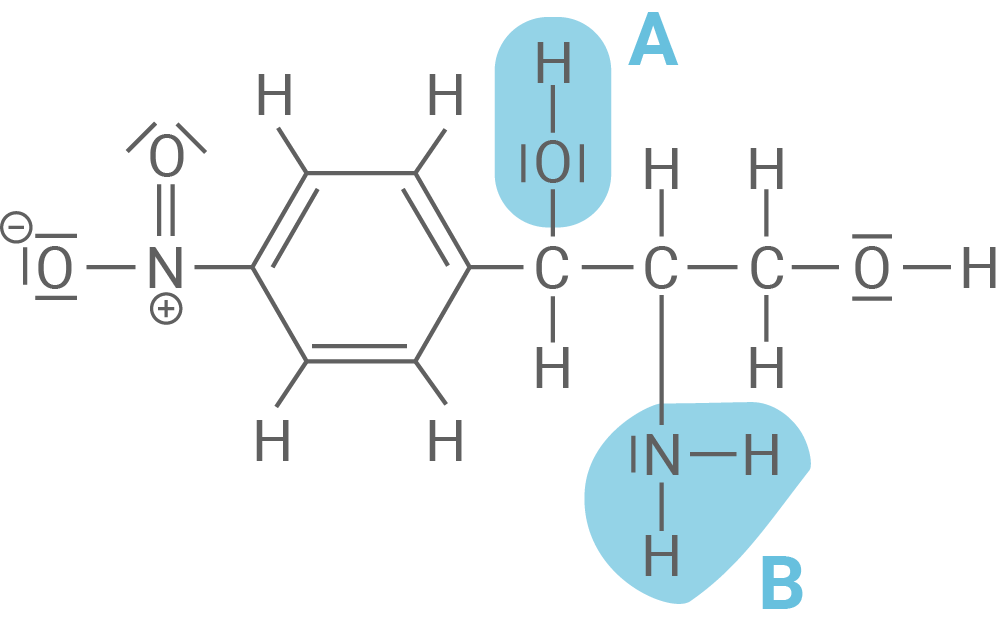
Die in Material 1 angegebene Verbindung ist ein Ausgangsstoff zur Herstellung von Chloramphenicol und besitzt zwei asymmetrische Kohlenstoff-Atome.
Benenne jeweils die beiden in Material 1 mit „A“ und „B“ bezeichneten funktionellen Gruppen.
Gib eine Definition für den Begriff „asymmetrisches Kohlenstoff-Atom“ an und beschrifte die beiden asymmetrischen Kohlenstoff-Atome in der in Material 1 angegebenen Strukturformel.
(5 BE)
1.4
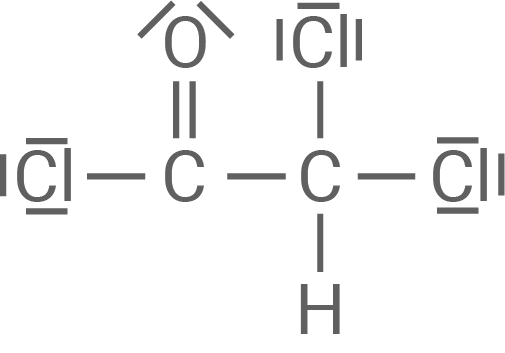
In Material 2 findest du eine Beschreibung des Mechanismus der Synthese von Chloramphenicol. In einer Kondensationsreaktion reagiert dabei die Verbindung aus Material 1 mit Dichlorethansäurechlorid aus Material 2.
Entwickle mithilfe von Material 1 und 2 einen Reaktionsmechanismus.
Hinweis
Für den Reaktionsmechanismus nicht relevante Molekülteile aus Material 1 können mit „R" abgekürzt werden.
Für den Reaktionsmechanismus nicht relevante Molekülteile aus Material 1 können mit „R" abgekürzt werden.
(7 BE)
1.5
In  Augentropfen sind
Augentropfen sind  Chloramphenicol (Material 2) enthalten.
Berechne die Stoffmengen-Konzentration
Chloramphenicol (Material 2) enthalten.
Berechne die Stoffmengen-Konzentration  von Chloramphenicol in diesen Augentropfen.
von Chloramphenicol in diesen Augentropfen.
(5 BE)
1.6
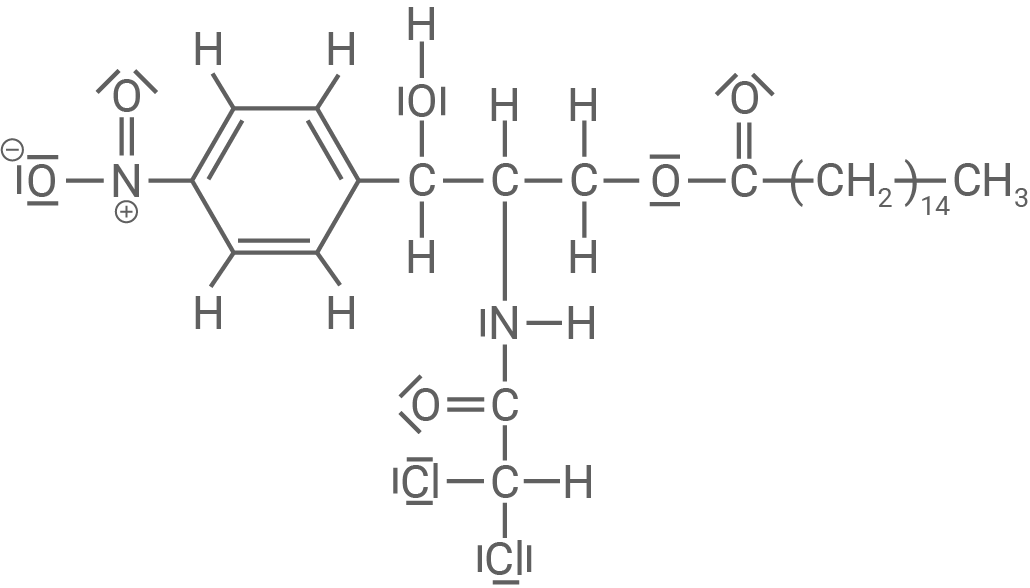
Zur Herstellung eines besser schmeckenden Wirkstoffes wird Chloramphenicol (Material 2) mit Palmitinsäure (Hexadecansäure,  ) verestert. Dabei entstehen das sogenannte Chloramphenicol-Palmitat (Material 3) und Wasser.
Bei dieser Veresterung sind außer Chloramphenicol-Palmitat (Material 3) zwei weitere Reaktionsprodukte denkbar.
) verestert. Dabei entstehen das sogenannte Chloramphenicol-Palmitat (Material 3) und Wasser.
Bei dieser Veresterung sind außer Chloramphenicol-Palmitat (Material 3) zwei weitere Reaktionsprodukte denkbar.
Formuliere den Reaktionsmechanismus für die säurekatalysierte Veresterung von Chloramphenicol mit Palmitinsäure (Hexadecansäure) und erläutere die einzelnen Reaktionsschritte. Begründe die Bildung der beiden weiteren prinzipiell denkbaren Reaktionsprodukte. Hinweis
Für den Reaktionsmechanismus nicht relevante Molekülteile können mit „ “, „
“, „ “ usw. abgekürzt werden.
“ usw. abgekürzt werden.
Formuliere den Reaktionsmechanismus für die säurekatalysierte Veresterung von Chloramphenicol mit Palmitinsäure (Hexadecansäure) und erläutere die einzelnen Reaktionsschritte. Begründe die Bildung der beiden weiteren prinzipiell denkbaren Reaktionsprodukte. Hinweis
Für den Reaktionsmechanismus nicht relevante Molekülteile können mit „
(12 BE)
(50 BE)
Material 1
Verbindung zur Herstellung von Chloramphenicol

Material 2
Synthese von Chloramphenicol

Dichlorethansäurechlorid

Chloramphenicol (Summenformel:  )
)
Material 3
Chloramphenicol-Palmitat

Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?
1.1
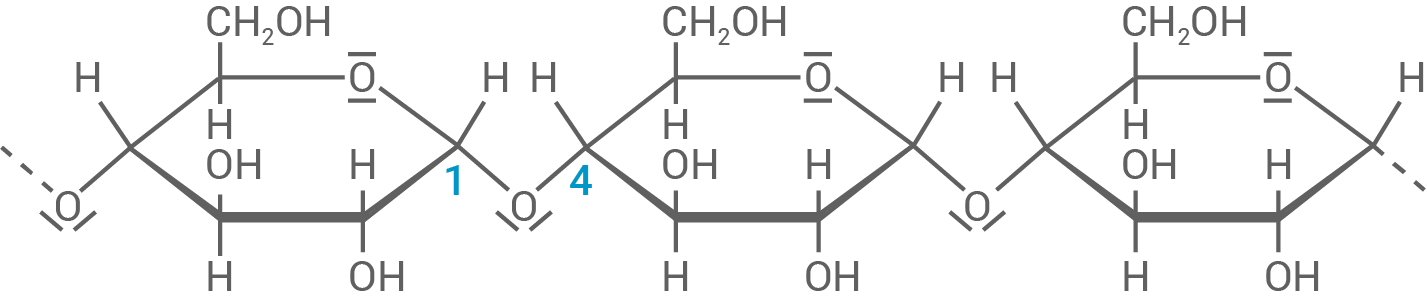
Benennung der Monosaccharid-Bausteine und die jeweilige Verknüpfungsart
 Nachweisreaktion
Nachweisreaktion
- Saccharose ist ein Disaccharid aus
-D-Glucose ist
-D-Fruchtose, welche über eine
-
-1,2-glycosidische Bindung miteinander verbunden sind.
- Amylose (die lösliche Form von Stärke) ist ein Polysaccharid und besteht aus
-D-Glucoseeinheiten, welche
-1,4-glycosidisch miteinander verbunden sind.

- Stärke und Saccharose lassen sich durch die Iod-Stärke Probe voneinander unterscheiden.
- Hierbei werden die jeweiligen Stoffe in Wasser gelöst und mit einer Iod-Kaliumiodid-Lösung, die sogenannte LUGOL'sche Lösung, versetzt.
- Die Stärke bzw. Amylose-Lösung zeigt daraufhin eine tiefblaue Färbung, während die Saccharose-Lösung farblich nicht ändert.
- Die Unterscheidung durch eine Blaufärbung ist auf die helikale Struktur der Amylose zurückzuführen, die die Iod-Moleküle der zugegebenen Iod-Kaliumiodid-Lösung einbindet.
1.2
Strukturformeln
 Reaktionsgleichung
Reaktionsgleichung
 Formelausdruck für die Berechnung des
Formelausdruck für die Berechnung des  -Werts
Zuordnung der
-Werts
Zuordnung der  -Werte
-Werte

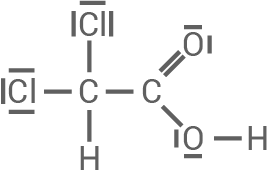
Dichlorethansäure

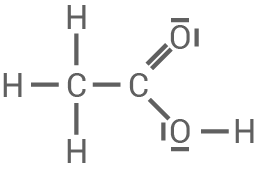
Ethansäure

Protolysereaktion von Dichlorethansäure mit Wasser
- Ethansäure (Essigsäure) lässt sich als schwache Säure mit
charakterisieren.
Es gilt:
Isthandelt es sich um eine schwache Säure.
- Dichlorethansäure hingegen ist eine starke Säure mit
Hier gilt:
Isthandelt es sich um eine starke Säure.
- Wie stark eine Säure, also wie hoch der
-Wert, ist, hängt von den jeweiligen Nachbaratomen der Reste ab und welche Effekte sie ausüben.
- Diese beeinflussen folglich die Polarität der jeweiligen Carboxyl-Gruppe und die Stärke der
-Bindung.
- Nachbaratome mit hoher Elektronegativität, wie hier die Chloratome mit
üben negative induktive Effekte (
-Effekte) auf die Carboxyl-Gruppe aus. Diese wirken elektronenziehend, vergrößern die positive Partialladung des
-Atoms der Carboxylgruppe und folglich die Polarität. Die
-Bindung wird dadurch schwächer und das Proton
kann leichter abgespalten werden. Dichlorethansäure ist dadurch also stärker.
- Die Ethansäure hingegen besitzt nur
-Reste. Diese üben positive induktive Effekte (
-Effekte) aus, wirken also elektronenschiebend. Folglich ist die
-Gruppe weniger stark polarisiert, die
-Bindung stärker und das Proton lässt sich schwerer abspalten. Ethansäure ist damit eine schwächere Säure.
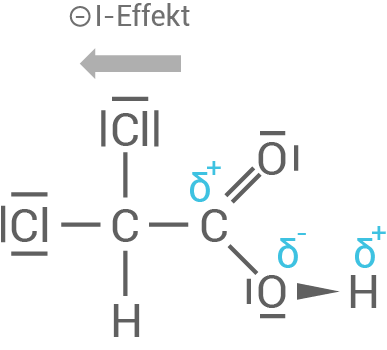
stärker polarisierte Bindung

 kann leichter abgespalten werden, da dieses schwächer gebunden ist.
kann leichter abgespalten werden, da dieses schwächer gebunden ist.
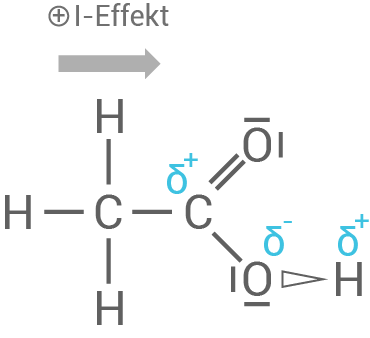
weniger stark polarisierte Bindung

 ist stärker gebunden und kann deshalb schwerer abgegeben werden.
ist stärker gebunden und kann deshalb schwerer abgegeben werden.
1.3
Benennung der funktionellen Gruppen
 -Atom besitzt vier verschiedene Substituenten.
-Atom besitzt vier verschiedene Substituenten.
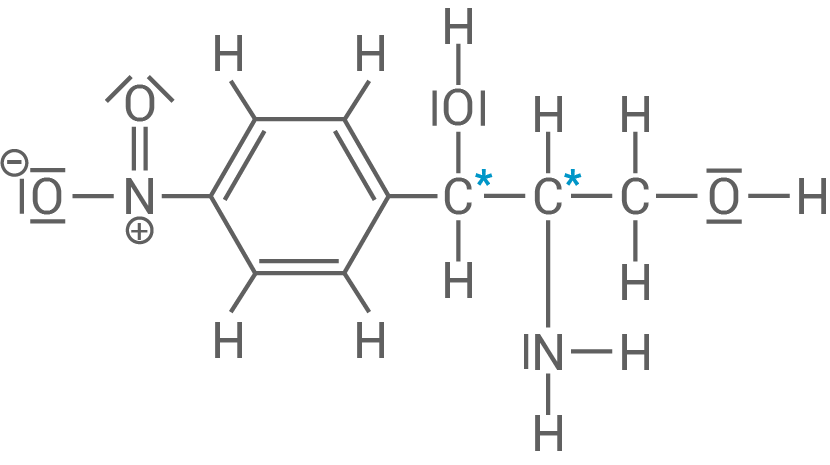
- A: Hydroxy-Gruppe
- B: Amino-Gruppe

* asymmetrische  -Atome
-Atome
1.4
Reaktionsmechanismus

1.5
Berechnung der Stoffmengenkonzentration
Mit der gegebenen Summenformeln von Chloramphenicol lässt sich zunächst die molare Masse  berechnen:
berechnen:
 Weiterhin gilt für die Berechnung:
Weiterhin gilt für die Berechnung:
![\(\begin{array}[t]{rll}
m&=& \dfrac{m}{M} & \\[5pt]
&=& \dfrac{0,025\,\text{g}}{323 \,\text{g} \cdot \text{mol}^{-1}} & \\[5pt]
&\approx& 7,74 \cdot 10^{-5} \,\text{mol}
\end{array}\)](https://mathjax.schullv.de/d42aec7e6bb91b31c2abf0730aef72a15940b26b44b1467b9b7b28e71d365dc1?color=5a5a5a) Es folgt:
Es folgt:
![\(\begin{array}[t]{rll}
c&=& \dfrac{n}{V} & \\[5pt]
&=& \dfrac{7,74 \cdot 10^{-5} \,\text{mol}}{0,015 \,\text{L}} & \\[5pt]
&\approx& 0,015 \,\text{mol} \cdot \text{L}^{-1}
\end{array}\)](https://mathjax.schullv.de/b712927ec3ae3e4555674904e99a933593e1d715e739a7b10310259e119e14a2?color=5a5a5a) Die Stoffmengenkonzentration von Chloramphenicol in diesen Augentropfen beträgt ca.
Die Stoffmengenkonzentration von Chloramphenicol in diesen Augentropfen beträgt ca. 
1.6
Reaktionsmechanismus für die säurekatalysierte Veresterung
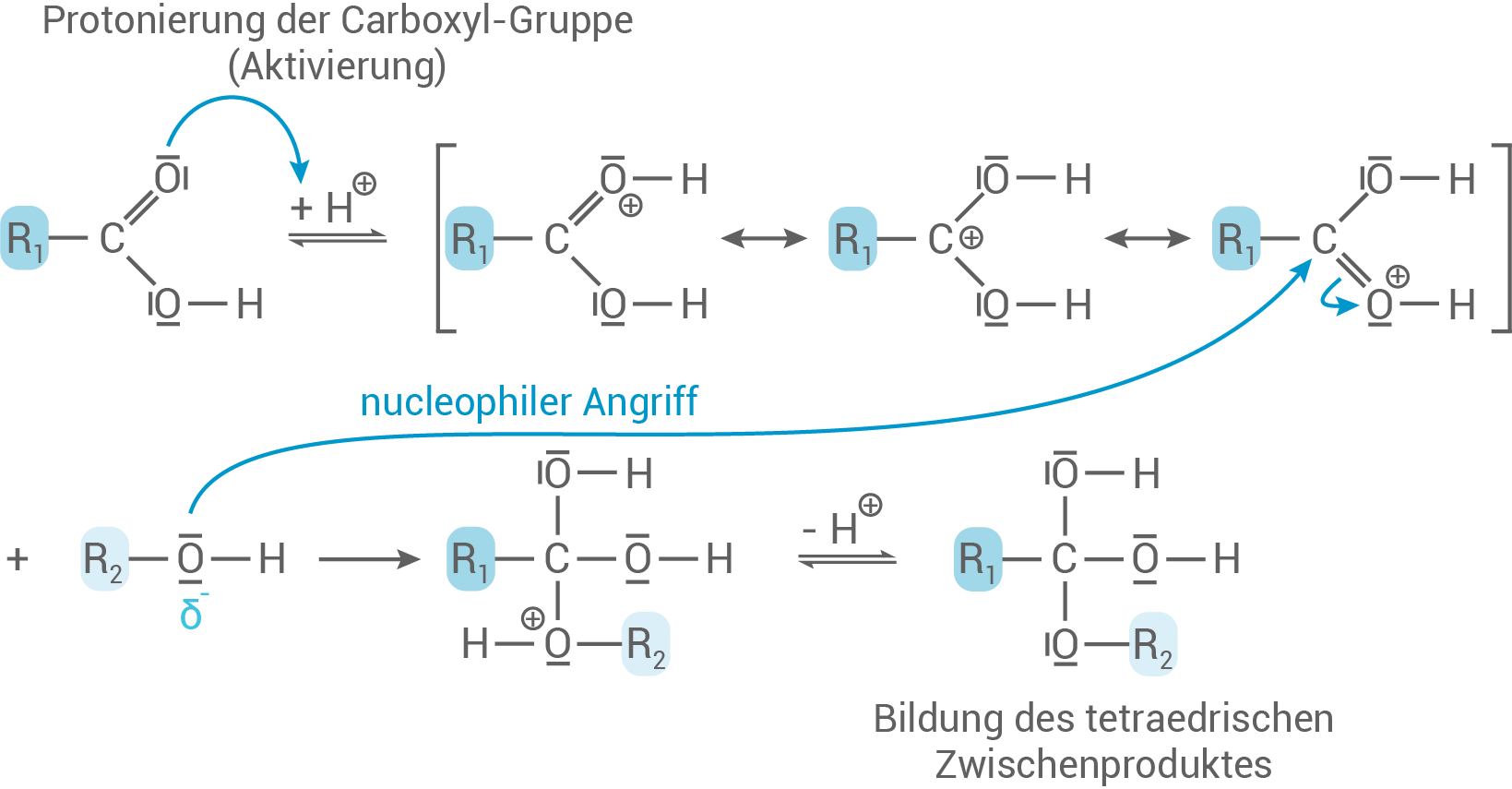
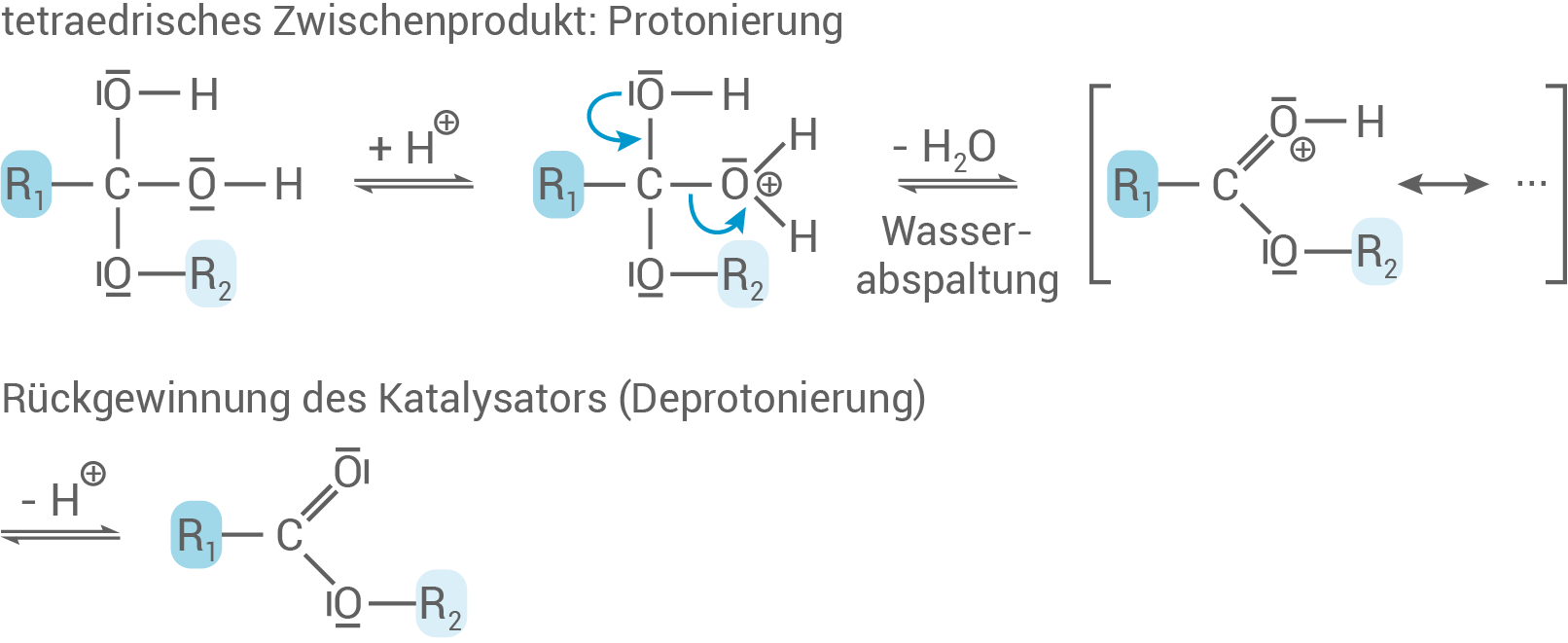

- Zunächst wird die Carboxyl-Gruppe protoniert
z.B. durch Zugabe von
Hierbei greift das Carbonyl-Sauerstoffatom nucleophil
an.
- Es entsteht ein kationisches Zwischenprodukt, welches mesomeriestabilisiert ist.
- Diese erste katalytische Reaktion, durch Säurezugabe, ist wichtig, um die folgende Reaktion zu erleichtern.
- Der Alkohol besitzt eine Hydroxy-Gruppe, die das positiv polarisierte Carbonyl-Kohlenstoffatom nun nucleophil angreift.
- Es wird das tetraedrische Zwischenprodukt gebildet.

- Durch erneute Protonierung bildet das tetraedrisches Zwischenprodukt eine gute Abgangsgruppe, nämlich
- Wasser wird abgespalten und anschließend kommt es zur Deprotonierung des Kations.
- Der Katalysator wird zurückgewonnen und es bildet sich ein Ester.
- Bei der Veresterung können noch weitere Produkte entstehen. Beispielsweise besitzt Chloramphenicol zwei Hydroxy-Gruppen, welche durch Reaktion mit Palmitinsäure (Hexadecansäure) zwei verschiedene Ester bilden können.
- Weiterhin könnten beide Gruppen auch mit je einer Palmitinsäure verestert werden.