Kugelteilchenmodell
Einführung
Nach einer Sporteinheit ist man durstig und trinkt Wasser, um den Durst zu löschen. Bei heißen Tagen sehnt man sich nach einem kühlen Getränk und gibt Eiswürfel hinzu. Um Spaghetti zu kochen, braucht man kochendes Wasser, das dabei verdampft. Bei allen drei Alltagssituationen geht es immer um denselben Stoff: Wasser. Der Unterschied liegt daran, dass das Wasser in unterschiedlichen Formen vorkommt. Hast du das bemerkt?Aggregatzustände
Wasser kennen wir nämlich in allen drei natürlich vorkommenden Zuständen: fest, flüssig und gasförmig. Wenn sich das Wasser in fester Form befindet, spricht man von Eis. Wenn das Wasser kocht, entsteht dabei Wasserdampf. Die verschiedenen Formen nennt man in der Fachsprache Aggregatzustände. Wenn das Eis aus der Tiefkühltruhe herausgenommen wird, fängt es bei Raumtemperatur an zu schmelzen. Andersherum erstarrt das Wasser zu Eis, wenn man es wieder ins Tiefkühlfach legt. Wenn das Wasser erhitzt wird, dann fängt es an zu kochen und verdampft zu Wasserdampf. Wenn der Wasserdampf wieder abkühlt, dann kondesiert es wieder zu flüssigem Wasser. Kann es passieren, dass Eis direkt zu Wasserdampf umwandelt wird? Auf jeden Fall! Wenn du bei Frost deine nasse Wäsche draußen aufhängst, so wird diese natürlich erstmal hart, weil die nasse Wäsche erstmal gefriert. Nach einer Weile wirst du aber feststellen, dass die Wäsche getrocknet ist. Das gefrorene Wasser ist somit direkt zu Wasserdampf sublimiert. Auch Wasserdampf kann direkt zu Eis resublimieren. Das passiert ebenfalls bei sehr kaltem Wetter, wenn sich auf Blättern und Zweigen Eiskristalle bilden.
Abb. 1: Das Wasser kann von fest zu flüssig oder auch direkt zu gasförmig übergehen. Umgekehrt ist es auch möglich.
Teilchenmodell
Wir wollen den Übergang von einem Aggregatzustand zum anderen mit Hilfe des Kugelteilchenmodells besser verstehen. Hierfür gelten folgende Annahmen:- Jeder Stoff besteht aus sehr vielen kleinen Teilchen, die für uns unsichtbar sind.
- Die Teilchen befinden sich in ständiger Bewegung.
- Zwischen den Teilchen herrschen Anziehungskräfte.
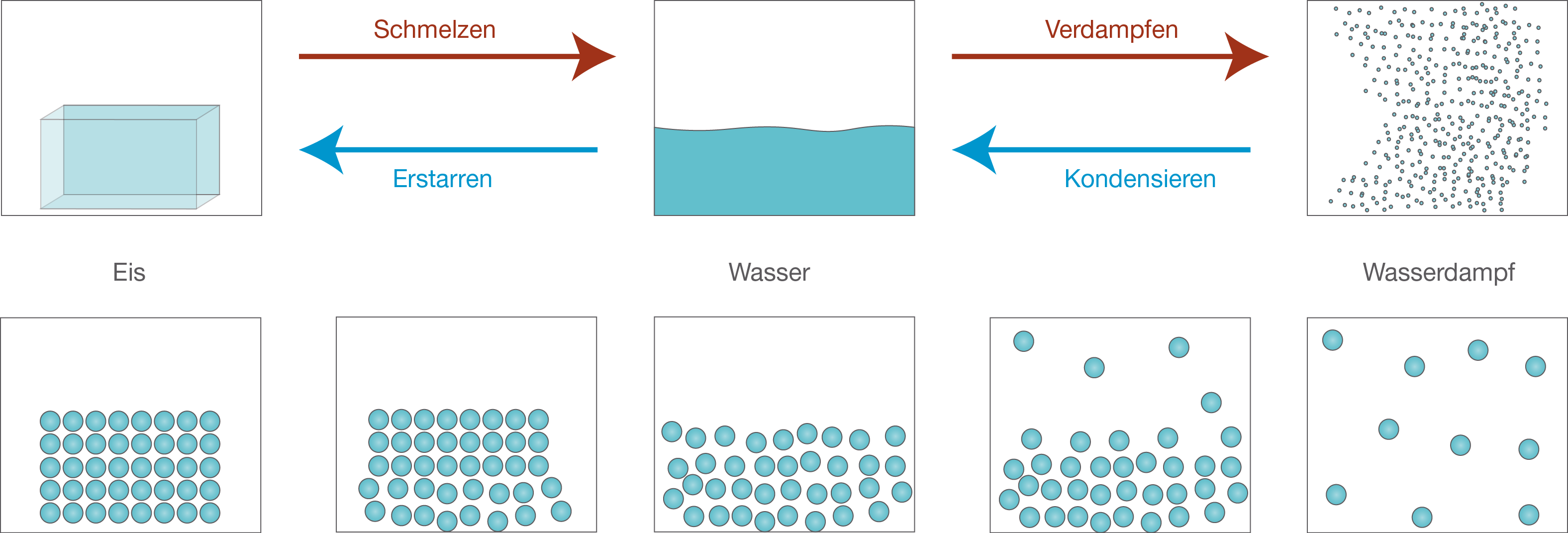
Abb. 2: Anhand des Kugelteilchenmodells kannst du sehen, wie Wasser in die unterschiedliche Aggregatzustände übergeht.
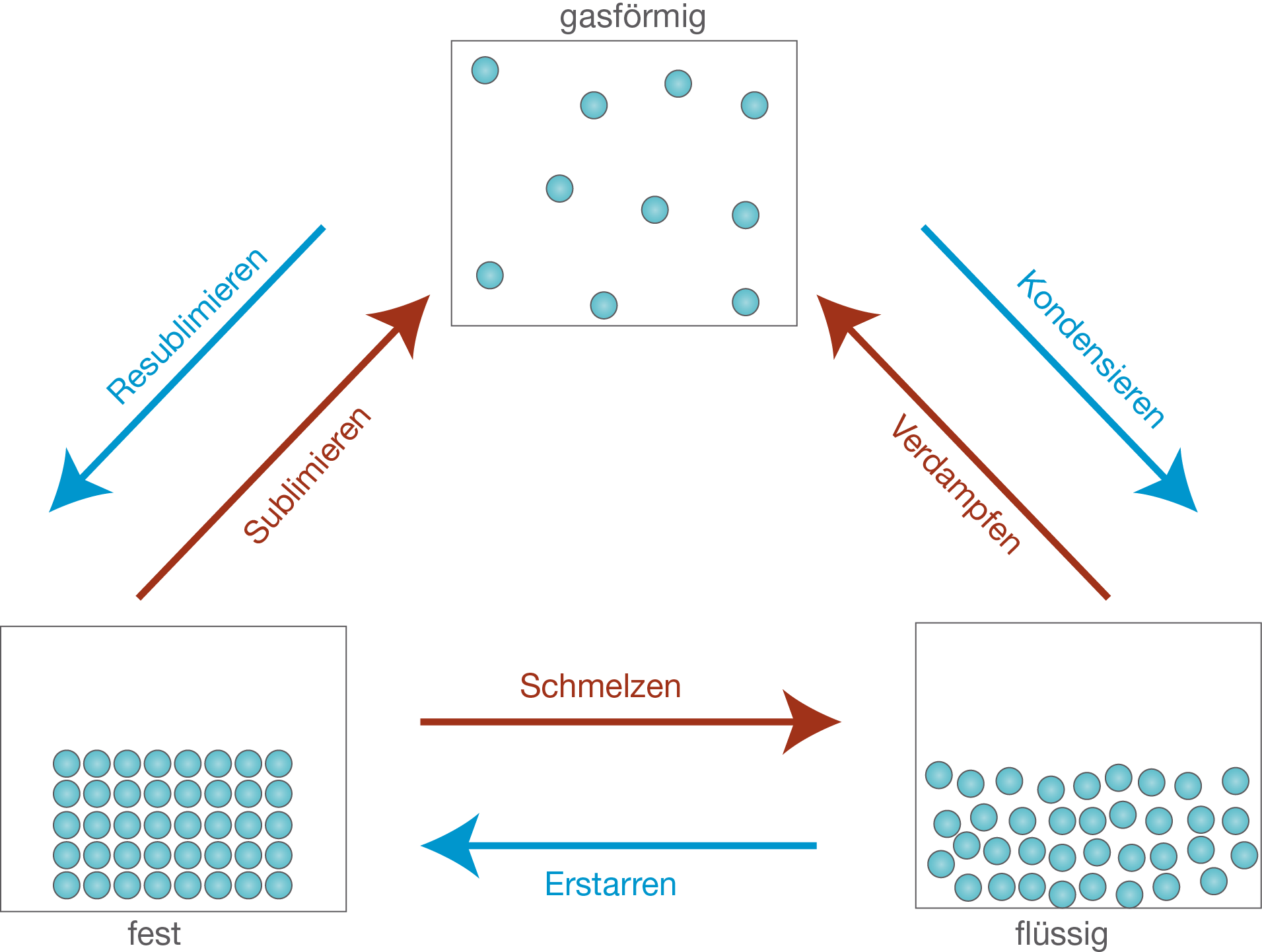
Abb. 3: Alle Stoffe können alle drei Aggregatzustände einnehmen unter bestimmten Bedingungen.
Schmelz- und Siedetemperatur
Wärme ist eine Form von Energie. Wenn also Wärme hinzugegeben wird, erhalten die Teilchen zusätzliche Energie, die sie zur schnelleren Bewegung leiten. Bei Wasser fängt das Eis bei
Bildnachweise [nach oben]
https://goo.gl/ktIlsj - Ice cubes openphoto, Darren Hester CC BY-SA 2.5
https://goo.gl/Iqexpm - 2006-02-13 Drop-impact, Roger McLassus CC-BY-SA
Fotolia.com - © weseetheworld.
© 2016 - SchulLV
© 2016 - SchulLV