Redoxreaktion
Einführung
Sicher hast du schon einmal beobachtet, wie Metalle rosten. Dabei reagieren die Metalle zusammen mit Sauerstoff zu einem Oxid. Diese Reaktion nennt man Oxidation. Verläuft die Reaktion in die andere Richtung, so wird das Oxid wieder in das Metall gespalten. Es findet eine Reduktion statt. Laufen eine Oxidation und eine Reduktion gleichzeitig ab, so spricht man von einer Redoxreaktion. Nun bist du vielleicht verwirrt von den vielen neuen Begriffen und fragst dich wie so eine Redoxreaktion abläuft. In diesem Skript geben wir dir einen Überblick über die wichtigsten Begriffe und zeigen dir, wann eine Oxidation und eine Reduktion gleichzeitig abläuft. Abb. 1: Rost- ein bekanntes Übel. Gibt es auch eine Möglichkeit den Rost zu entfernen?
Abb. 1: Rost- ein bekanntes Übel. Gibt es auch eine Möglichkeit den Rost zu entfernen?
Oxidation und Reduktion
Bei einer Oxidation reagiert ein Stoff mit Sauerstoff zu einem Oxid. Meistens handelt es sich bei dem Stoff um ein Metall. Bei der Reaktion wird Energie frei, die Reaktion verläuft also exotherm. Sicher kennst du schon die ein oder andere Oxidationsreaktion. Ein Beispiel ist die Reaktion von Magnesium und Sauerstoff zu Magnesiumoxid oder die Reaktion von Eisen mit Sauerstoff. Beispiele einer Oxidation:- Oxidation: Aufnahme von Sauerstoff
- Reduktion: Abgabe von Sauerstoff
Redoxreaktion
Manche Oxide lassen sich jedoch nicht wie beim Silberoxid durch einfaches Erhitzen spalten. Damit die Oxide den Sauerstoff bei der Reaktion abspalten, müssen sie mit einem weiteren Stoff reagieren. Dieser Stoff ist nicht zwangsläufig ein Metall. So kann beispielsweise Kupferoxid mit Wasserstoff, Kohlenstoff oder Eisen zu Kupfer umgesetzt werden. Je nach Reaktionspartner entstehen dabei verschiedene Produkte. Diese Stoffe helfen dabei das Oxid zu reduzieren, daher werden sie Reduktionsmittel genannt. Reduktionsmittel können besonders gut mit Sauerstoff reagieren. Oxide bzw. Stoffe die Sauerstoff abgeben heißen Oxidationsmittel. Bei einer Redoxreaktion laufen sowohl eine Oxidation, als auch eine Reduktion ab. In der Reaktionsgleichung kennzeichnest du die Oxidation und Reduktion mit Pfeilen. Außerdem schreibst du unter die Summenformel welcher Stoff ein Oxidations- bzw. Reduktionsmittel ist. Wie das genau gemacht wird, siehst du in Abbildung 2.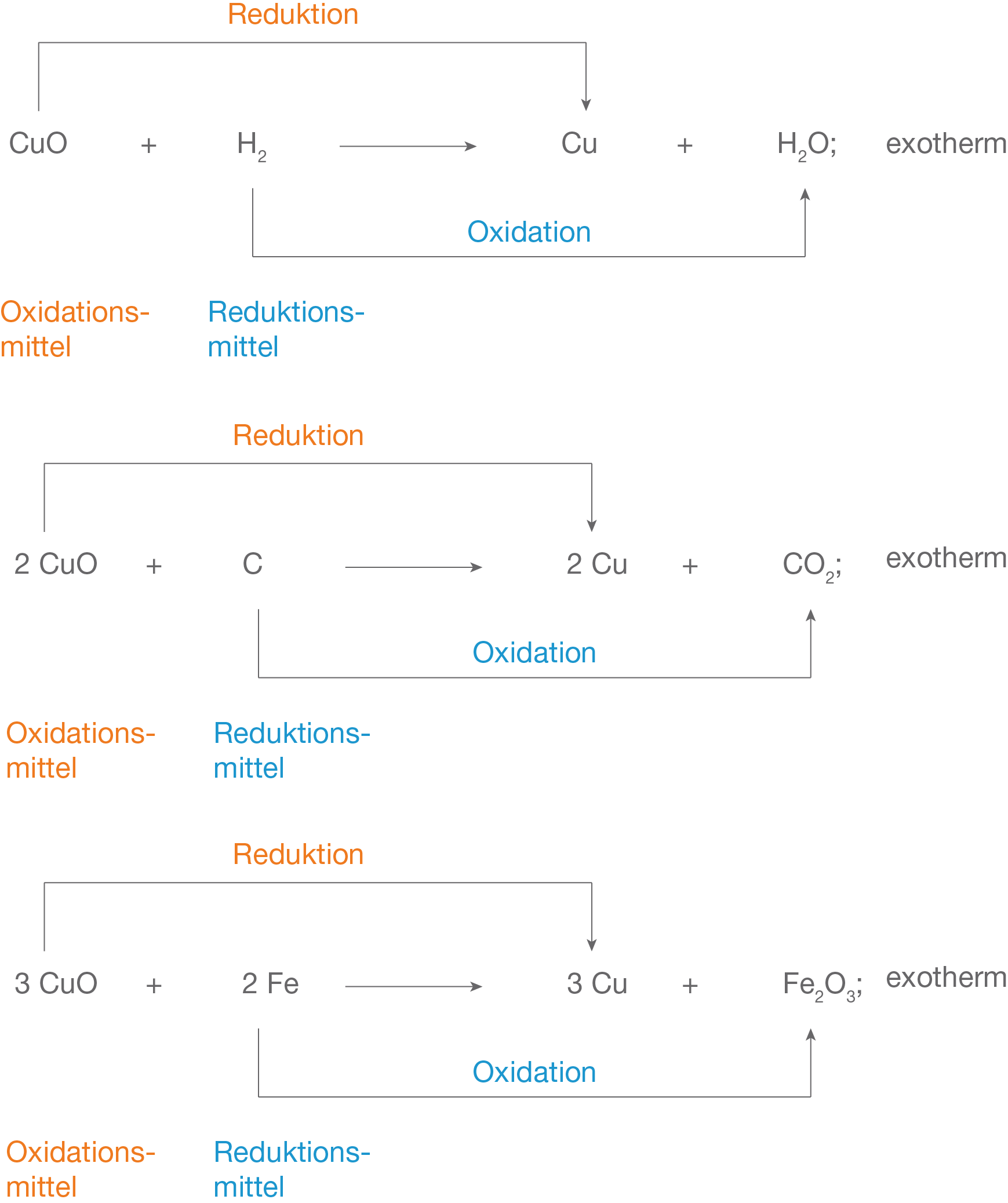 Abb. 2: Verschiedene Reduktionsmittel ergeben unterschiedliche Produkte.
Abb. 2: Verschiedene Reduktionsmittel ergeben unterschiedliche Produkte.
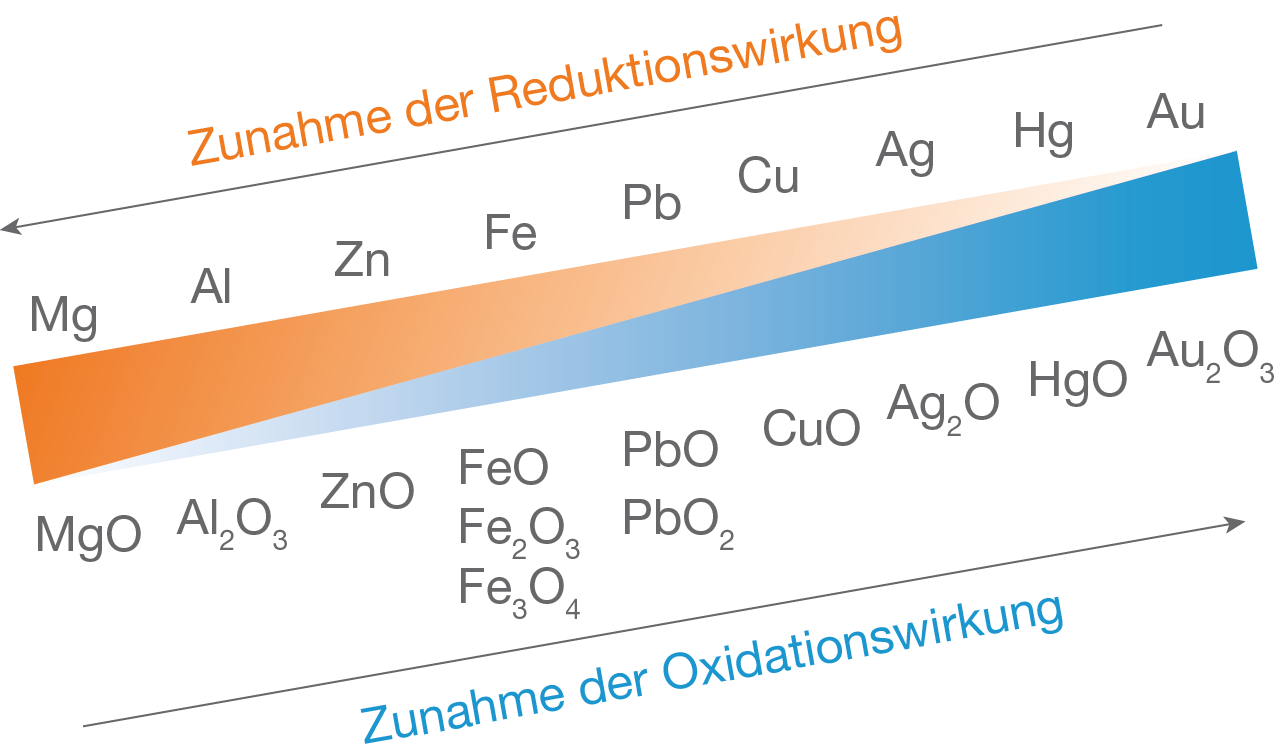 Abb. 3: Mit Hilfe der Redoxreihe siehst du, dass Eisenoxid mit Hilfe von Zink reduziert werden kann.
Abb. 3: Mit Hilfe der Redoxreihe siehst du, dass Eisenoxid mit Hilfe von Zink reduziert werden kann.
Alles auf einen Blick
- Bei einer Redoxreaktion läuft eine Oxidation und eine Reduktion ab.
- Dabei wird das Oxidationsmittel reduziert und das Reduktionsmittel oxidiert.
- Die Reduktionswirkung und Oxidationswirkung von Metallen wird in einer Redoxreihe dargstellt:
- Je edler das Metall, desto schwächer ist die Reduktionswirkung und desto stärker die Oxidationswirkung.
- Unedle Metalle haben eine starke Reduktionswirkung und eine schwache Oxidationswirkung.