Massenerhaltungsgesetz
Die Chemie messen
In der Chemie interessiert man sich nicht nur dafür was mit was reagiert, sondern man will verstehen auch wie viel Stoff in die Reaktion eingehen. Man betrachtet die Chemie also nicht nur qualitativ, sondern auch quantitativ. Man will also die Chemie messen. Geht das überhaupt?Gesetz der Massenerhaltung
Na klar geht das! Bereits im 18. Jahrhundert kam der französische Chemiker Antoine Laurent Lavoisier auf die Idee die Chemie quantitativ zu betrachten. Du fragst dich wie das ging? Ganz einfach mit einer Waage. Lavoisier wollte eine Gesetzmäßigkeit in der Chemie entdecken, indem er die Stoffe vor und nach der Reaktion wog. Dabei führte er die Reaktionen in einem geschlossenen Raum durch, sodass auf gar keinen Fall die reagierenden Stoffe (z.B. Gase) entweichen können. So wird beispielsweise Magnesium in einem geschlossenen Reagenzglas gewogen. Daraufhin wird es mit einem Bunsenbrenner erhitzt. Dabei entsteht durch die Reaktion des Magnesiums und Sauerstoffs (aus der Luft) Magnesiumoxid. Anschließend wird das Magnesiumoxid im Reagenzglas wieder gewogen. Tatsächlich verändert sich die Masse nicht. Dies gilt für alle Reaktionen. Die Masse der Edukte und Produkte bleiben also unterm Strich konstant. Man spricht auch vom Massenerhaltungsgesetz. In einer Reaktion geht somit also kein Stoff ins Nichts verloren und er kommt auch kein Stoff aus de Nichts dazu.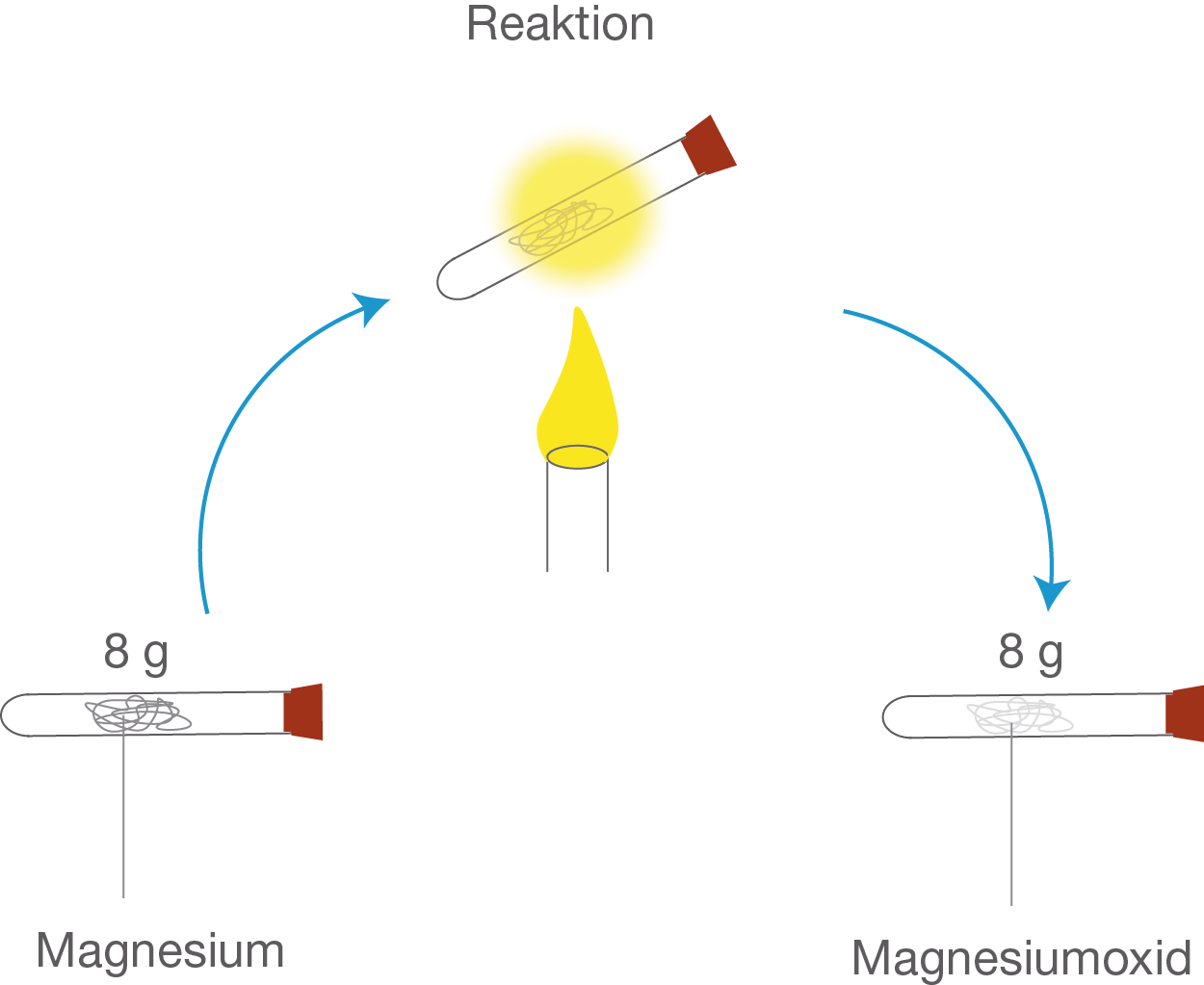 Abb. 1: Die Masse bleibt vor und nach der Reaktion konstant.
Abb. 1: Die Masse bleibt vor und nach der Reaktion konstant.
Gesetz von der Erhaltung der Masse
Bei chemischen Reaktionen ist die Masse der Endstoffe (Produkte) gleich der Masse der Ausgangsstoffe (Edukte).
Ein Gedankenexperiment
Wir führen einen Versuch gedanklich durch (im Schullabor kannst du den Versuch in Absprache mit deinem Lehrer ebenfalls durchführen!). Wir lassen Kupfer mit Schwefel unter Hitzezufuhr in einem geschlossenen Reagenzglas reagieren und wir erhalten Kupfersulfid. Aus dem gelben Stoff (Schwefel) und dem roten Metall (Kupfer) entsteht ein neuer Stoff, der eine blauschwarze Farbe besitzt (Kupfersulfid). Dies wäre nun eine qualitative Auswertung. In der quantitativen Betrachtungsweise interessiert uns nun wie viel von dem Schwefel und dem Kupfer miteinander zu Kupfersulfid reagieren.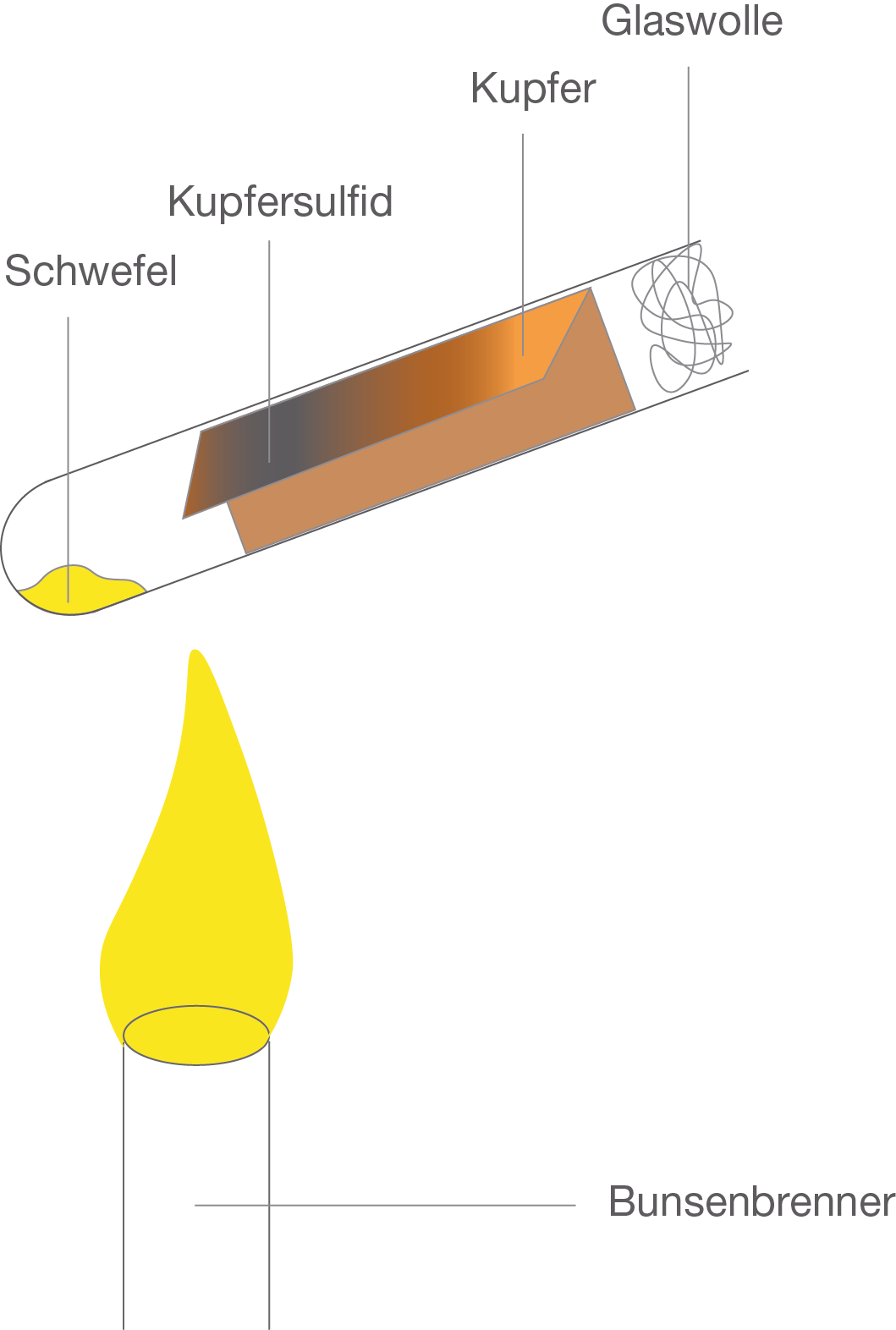 Abb. 2: Schwefel und Kupfer reagieren miteinander zu Kupfersulfid.
Abb. 2: Schwefel und Kupfer reagieren miteinander zu Kupfersulfid.
Gesetz der konstanten Massenverhältnisse
Bei der Reaktion beider Ausgangsstoffe wirst du erkennen, dass einer der beiden Stoffe nicht vollständig abreagiert, weil dieser im Überfluss vorhanden ist. Damit das genaue Reaktionsverhältnis von Kupfer und Schwefel ermittelt wird, sodass keiner der beiden Stoffe am Ende der Reaktion übrig bleibt, wird das Kupfer vor der Reaktion gewogen (
m(Kupfer) + m(Schwefel) = m(Kupfersulfid)
Sprich also: Die Summe der Masse von Kupfer und der Masse von Schwefel ist gleich der Masse vom Kupfersulfid. Die Masse der Kupfers ist durch das Wiegen vor der Reaktion bekannt und die Masse der Kupfersulfids durch das Wiegen nach der Reaktion. Durch einfaches Umstellen nach der Masse des Schwefels erhältst du:
m(Kupfersulfid) - m(Kupfer) = m(Schwefel)
Die gemessenen Zahlen werden eingesetzt und wir erhalten:
Gesetz der konstanten Massenverhältnisse
Eine chemische Verbindung bildet sich aus Elementen in einem ganz bestimmten und konstanten Massenverhältnis.