Das Haber-Bosch-Verfahren
Ein außergewöhnlich wichtiges Beispiel, welches das komplette Themengebiet des chemischen Gleichgewichts wie es im Abitur verlangt wird aufgreift, ist das weltbeühmte Verfahren zur Ammoniaksynthese, welches durch Fritz Haber und Carl Bosch entwickelt wurde und diesen beiden Herren auch seinen Namen zu verdanken hat.
Nachdem wir im Rahmen der letzten Kapitel die Grundlagen des chemischen Gleichgewichts erarbeitet haben und uns auch mit weiterführenden Themen zur Reaktionsgeschwindigkeit und zur Katalyse beschäftigt haben, wollen wir das abschließende Kapitel ganz der Praxis widmen: dem Haber-Bosch Verfahren. Zunächst werden wir uns mit der geschichtlichen Relevanz dieser Entwicklung beschäftigen. Anschließend werfen wir einen Blick auf die Chemie hinter dem Haber-Bosch-Vefahren, welche insbesondere auch die Inhalte des Themengebiets Das chemische Gleichgewicht zusammenbringt.
Geschichtliche Entwicklung
Vor der Zeit der technischen Ammoniaksynthese, die eine industrielle Düngerproduktion ermöglichte, waren die Menschen darauf angewiesen beim Ackerbau insbesondere stickstoffreichen Tiermist als Dünger zu verwenden, da Stickstoff einen essentiellen Nährstoff für das Pflanzenwachstum darstellt. Obwohl die Erdatmosphäre zu ungefähr 78 % aus gasförmigem Stickstoff besteht, sind nur sehr wenige Pflanzen in der Lage dieses inerte Gas direkt aus der Luft für ihr Wachstum zu nutzen. Dies geschieht dann auch nur indirekt durch sogenannte Knöllchenbakterien (Rhizobien), die in Symbiose mit den Pflanzen leben. Das Problem liegt in der chemischen Struktur von elementarem Stickstoff begründet: Zwischen den beiden N-Atomen liegt eine sehr stabile Dreifachbindung vor, die sehr schwer aufzubrechen ist. Dieses Problem war für den Menschen also nur so zu lösen, indem es möglich wurde elementaren Stickstoff chemisch zu binden und später zu stickstoffreichen Verbindungen weiter zu verarbeiten, wie bspw. Nitrat oder Harnstoff. Dieses würde seine Anwendung dann in Form von Dünger finden.
Anfang des 20. Jahrhunderts schaffte es der deutsche Chemiker Fritz Haber in kleinem Maßstab Ammoniak aus den Elementen Stickstoff und Wasserstoff zu synthetisieren. Dieses Experiment führte er bei erhöhter Temperatur und erhöhtem Druck, sowie unter der Verwendung unspezifischer Katalysatoren durch. Durch eine Anstellung bei der Badischen Anilin und Sodafabrik BASF entwickelte er dieses Verfahren zusammen mit Carl Bosch weiter, um die Ammoniaksynthese später auch im großtechnischen Maße durchführen zu können. Dieses wurde schlussendlich nach ihren beiden Entwicklern benannt und bereits 1910 zum Patent angemeldet. Sowohl Fritz Haber als auch Carl Bosch erhielten einige Jahre später den Nobelpreis für Chemie für ihre bahnbrechenden Arbeiten auf diesem Gebiet. Neben der Düngemittelproduktion wurden insbesondere auch Grundchemikalien für die Sprengstoffproduktion wie bspw. Ammoniumnitrat hergestellt.
Das Gefahrenpotential, welches mit der Produktion und Lagerung von Düngemitteln einherging, wird anhand der Explosion des Oppauer Stickstoffwerks der BASF deutlich. Dabei explodierte am 21.09.1921 aus ungeklärten Gründen ein Lager für Düngemittel in Oppau (Rheinland-Pfalz) wobei über 2500 Menschen getötet oder verletzt wurden. Weiterhin wurden viele Gebäude in Oppau sowie im nahen Mannheim und Ludwigshafen beschädigt bzw. zerstört. Dieses Unglück ging als die schwerste Industriekatastrophe Deutschlands in die Geschichte ein.
Mechanistische Betrachtung
Nun wollen wir uns die Reaktionen und Prozesse anschauen, die beim Haber-Bosch-Verfahren ablaufen.
AmmoniaksyntheseAmmoniak ist ein stark stechend riechendes und giftiges Gas, das beim Einatmen erstickend wirkt und die Augen reizt. Die Edukte werden auf unterschiedliche Weise gewonnen. Während der Stickstoff noch relativ einfach durch die Verflüssigung von Luft zugänglich gemacht werden kann, ist die Gewinnung von elementarem Wasserstoff deutlich aufwendiger und energieintensiver.
Druck und TemperaturZunächst werfen wir einen Blick auf den Druck. Das Haber-Bosch-Verfahren wird gewöhnlich bei Drücken von 250 bis 350 bar durchgeführt. Nach Le Chateliers Prinzip des kleinsten Zwangs ist das sinnvoll, da hier einerseits nur gasförmige Reaktanden vorliegen und das Gleichgewicht damit andererseits auf die Seite der Reaktion verschoben wird, auf der die geringere Menge an Reaktanden vorliegt, die Produktseite.
Die Reaktionstemperatur ist ein wenig schwieriger zu verstehen. Der Temperaturbereich, der im Fall des Haber-Bosch-Verfahrens zur Anwendung kommt liegt zwischen 450 und 550. Dies scheint zunächst etwas unverständlich, da wir im Falle der Ammoniaksynthese eine exotherme Reaktion vorliegen haben, wohingegen eine Temperaturerhöhung nach Le Chatelier die endotherme Reaktionsrichtung bevorzugt, was die Edukte bevorzugt. Ein Problem dabei ist jedoch die Reaktionsgeschwindigkeit. Obwohl Katalysatoren zur Anwendung kommen, muss die Reaktionstemperatur immer noch relativ hoch sein, damit eine angemessene Reaktionsgeschwindigkeit gewährleistet ist. Dies führt nach dem Prinzip von Le Chatelier zu konkurrierenden Einflussgrößen bei der Verschiebung des Gleichgewichts auf die Produktseite. Dennoch führt dieses Verfahren dazu, dass ein Volumenanteil von ca. 17 % an Ammoniakgas gewonnen wird. Die nicht umgesetzte Menge an N
und H
wird dem Reaktor wieder in ständigem Kreislauf zugeführt, so dass praktisch kein Verlust auftritt.
Hier siehst du, dass zwei unterschiedliche Reaktionsparameter ein Gleichgewicht auch gegenläufig beeinflussen können und somit sehr bewusst ausgesucht werden müssen.
Der beim Haber-Bosch-Verfahren verwendete Katalysator besteht aus Ferrit (auch als -Eisen bezeichnet. Dabei handelt es sich um eine kristallographische Konfiguration des Eisens, die bei Raumbedingungen stabil ist. Ferrit unterscheidet sich durch eine spezifische Anordnung der Eisenatome im Kristallgitter von anderen Eisenkonfigurationen.
Dieser Katalysator wird jedoch erst im Zuge der eigentlichen Reaktion durch eine Nebenreaktion gewonnen. Bei dieser wird das -Eisen durch die Reduktion von
mit
und einigen anderen Verbindungen gewonnen. In
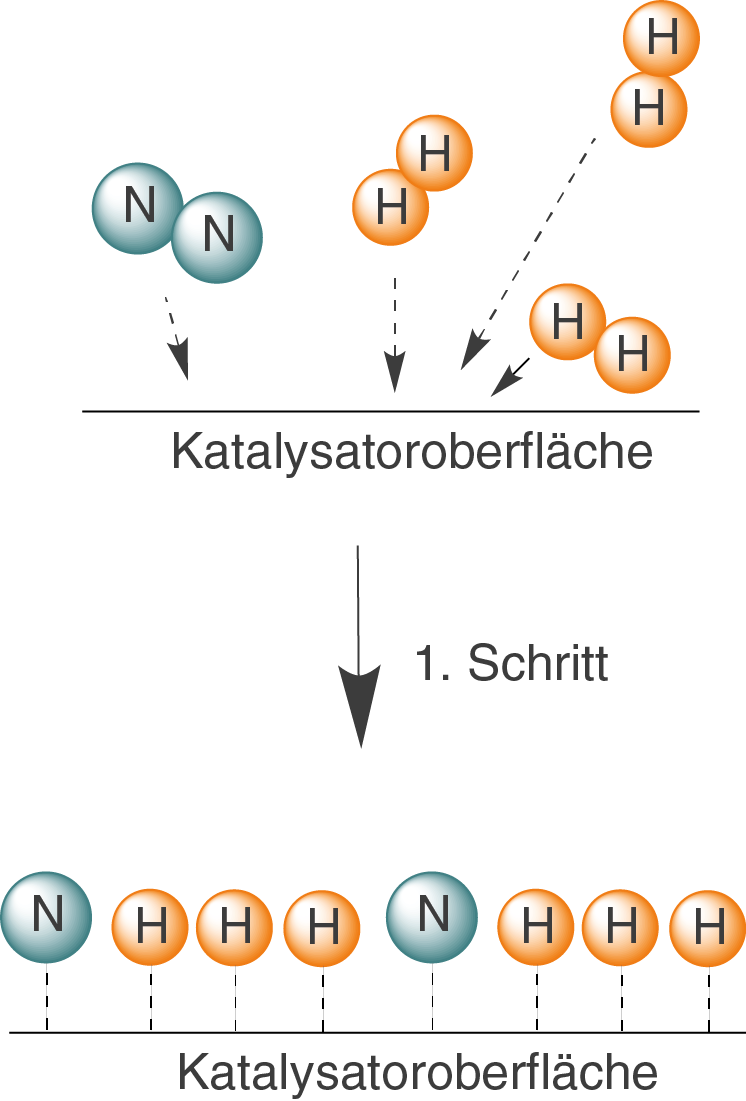
liegt Eisen sowohl als zweiwertiges als auch als dreiwertiges Ion vor. Dieser Eisen-Katalysator arbeitet erst bei den bereits angesprochenen, relativ hohen Temperaturen optimal. Wie du siehst liegt der Katalysator hier als Festphase vor, während die Reaktanden gasförmig sind. Demnach haben wir es hier mit einer heterogenen Katalyse zu tun, deren Schritte wir uns anhand der folgenden Schaubilder veranschaulichen können.
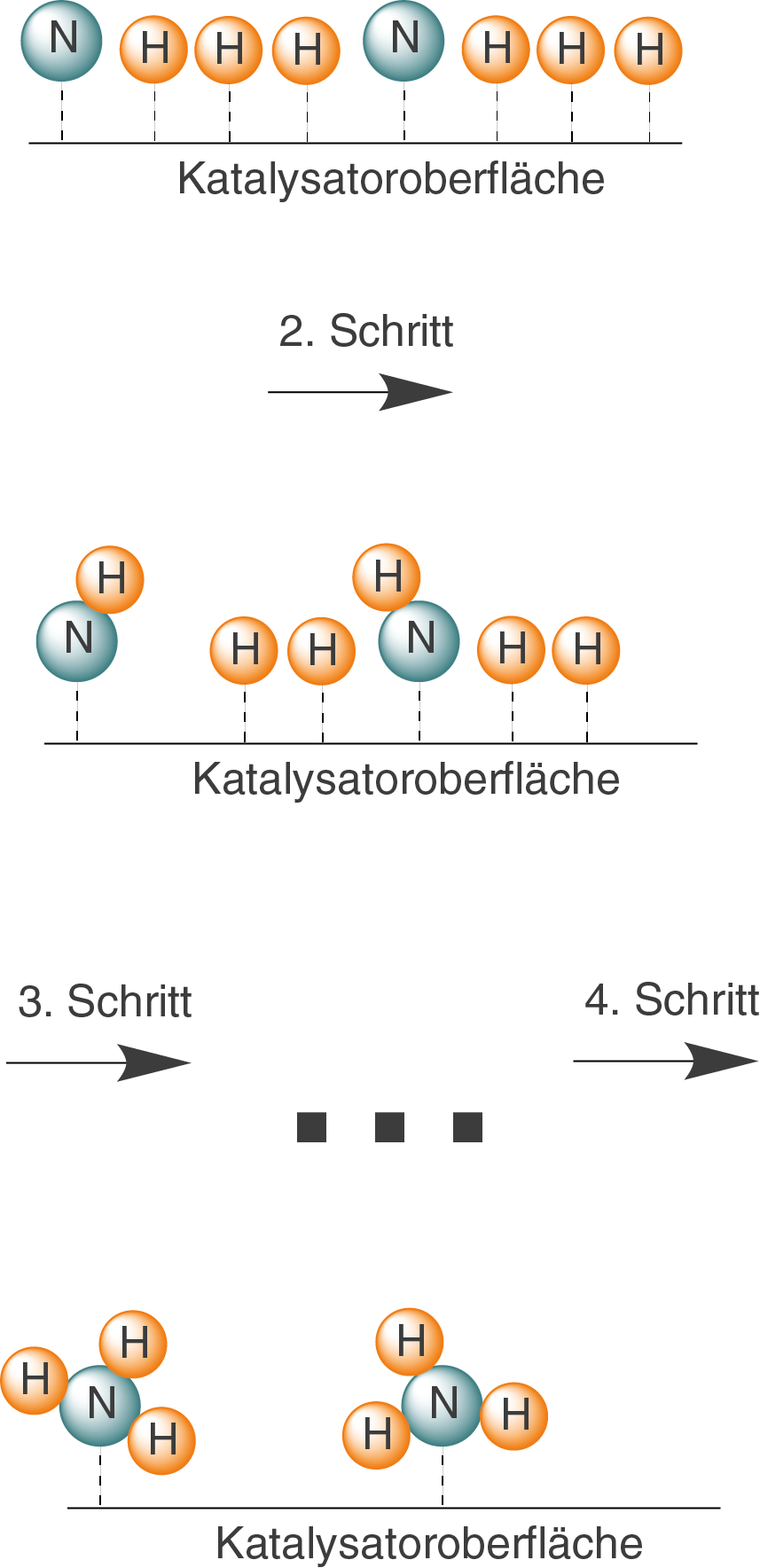
Im ersten Reaktionsschritt lagern sich Wasserstoff und Stickstoff an die Katalysatoroberfläche an und werden dort in einzelne, an der Oberfläche gebundene Atome gespalten. Der Prozess der Anlagerung wird Adsorption genannt.
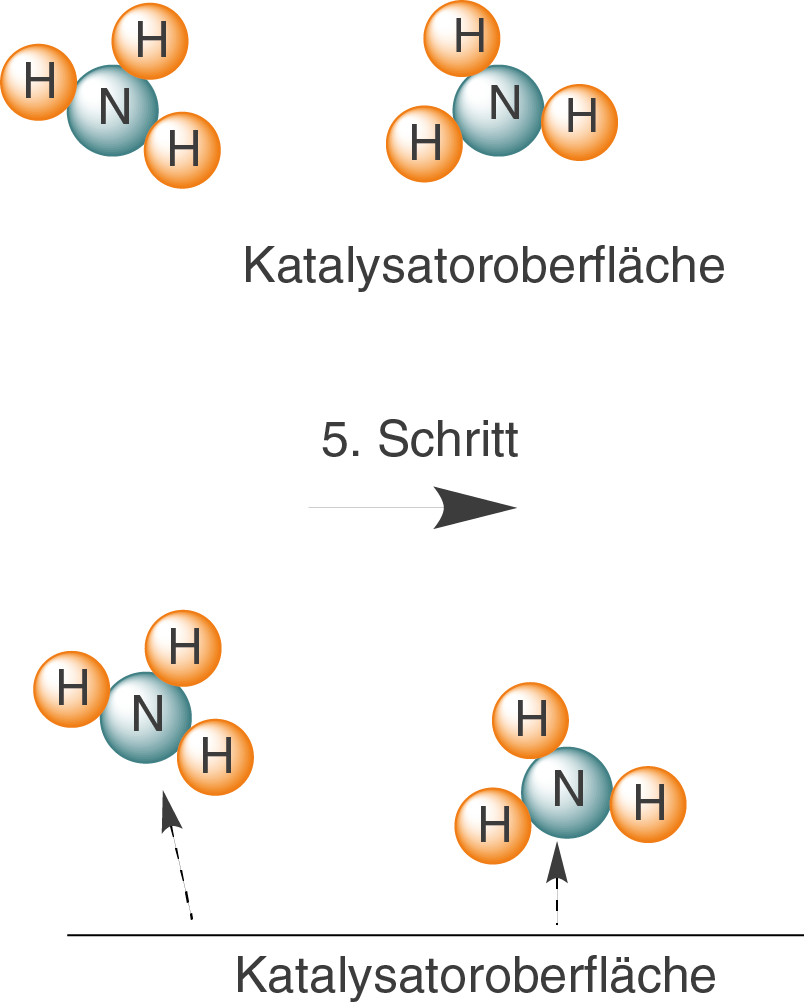
Schrittweise reagieren H-Atome mit einem N-Atom, sodass über einige Zwischenschritte Ammoniak entsteht.
Abschließend wird die Bindung zwischen dem neu gebildeten Ammoniak und der Katalysatoroberfläche gespalten, sodass als Produkt aus der Reaktion hervorgeht.
Obwohl dieses Verfahren bereits über 100 Jahre alt ist und auch heute noch die zentrale Methode für die Ammoniaksynthese auf der ganzen Welt darstellt, konnte der Katalyseprozess erst zu Beginn des 21. Jahrhunderts durch den Physikochemiker Gerhardt Ertl vollständig beschrieben und verstanden werden. Für diese bahnbrechende Leistung wurde er 2007 mit dem Nobelpreis für Chemie ausgezeichnet.