Einführung

Abb. 1: Wasser, das Element des Lebens oder doch eher eine Verbindung des Lebens?
Wasser, häufig wird es auch das
Element des Lebens genannt. Täglich nehmen wir diese Flüssigkeit zu uns, wir spülen Geschirr damit, wir wässern unsere Pflanzen oder wir säubern damit unsere Wäsche.
Wasser ist für uns einer der wichtigsten Stoffe überhaupt. Doch was genau ist Wasser? Ein Element oder doch eine Verbindung? All das wollen wir in diesem Skript einmal überprüfen.
Der Struktur von Wasser auf der Spur
Zuerst wollen wir herausfinden, ob Wasser nun ein
Element oder eine
Verbindung ist. Das wollen wir in einem Experiment herausfinden. Ein Element lässt sich nicht mehr in einzelne Teile zerlegen. Ein Element ist ein grundlegender Baustein. Wenn wir in der Lage wären, reines Wasser in andere Stoffe zu zerlegen, dann hätten wir es definitiv mit einer Verbindung zu tun.
Ein solches Experiment hat der Chemiker
August Wilhelm Hofmann durchgeführt. Er baute einen Glasapparat in dessen Mitte ein großer Wasserbehälter saß. Rechts und links davon schloss er eine Stromquelle an. Über den Anschlüssen der Stromquelle waren hohe Glasröhren mit einer Skala. Du kannst dir den Apparat ungefähr so vorstellen wie in Abbildung 2, weiter unten.
Als Hofmann nun Strom anlegte beobachtete er, dass an den Anschlüssen der Stromquelle sich
Blasen bildeten und in den beiden Glasröhren mit den Skalen sich
Gase ansammelten. Dabei war in einer Glasröhre ungefähr doppelt so viel Gas enthalten wie in der anderen.

Abb. 2: Hofmanns Apparatur: Strom wird angelegt und es entstehen zwei Gase.
Diese beiden Gase können wir nun getrennt voneinander untersuchen. Im
Skript über den
Sauerstoff haben wir uns bereits mit zwei wichtigen
Nachweismethoden beschäftigt. Zum einen wäre das die
Glimmspanprobe. Bei diesem Nachweis wird ein glimmendes Stück Holz in ein Gas gehalten. Wenn der Span heller glüht, dann wird damit
Sauerstoff (=
O2) nachgewiesen. In der Tat können wir bei der linken Glasröhre (die, die weniger Gas enthält) eine erfolgreiche Glimmspanprobe durchführen.
Es ist Sauerstoff entstanden.
Die zweite Nachweismethode ist die
Knallgasprobe. Dabei wird ein brennendes Feuerzeug an einen Behälter mit Gas gehalten. Wenn es einen Knall gibt, dann haben wir mit dieser Methode
Wasserstoff (=
H2) nachgewiesen. Die Knallgasprobe ist bei unserer rechten Glasröhre (die, die mehr Gas enthält) positiv.
Es ist Wasserstoff entstanden.
Was lernen wir also aus diesem Experiment? Wasser ist allem anschein nach kein Element, sondern eine
Verbindung. Wir waren in der Lage aus reinem Wasser zwei Gase, Wasserstoff und Sauerstoff, herzustellen. Zwar hat Hofmann noch eine verdünnte Säure in seine Apparatur zugegeben, das dient jedoch nur dazu, die Leitfähigkeit von Wasser zu erhöhen.
Wasser ist also eine Verbindung aus Sauerstoff und Wasserstoff. Doch in welchem Verhältnis? Vielleicht ja H
3O
2 oder eher HO
2? Wir erinnern uns an unsere Beobachtung. Eines der Gase, Wasserstoff, ist ungefähr in der doppelten Menge entstanden wie das andere Gas, Sauerstoff. Deshalb kommen wir zu dem Schluss, dass ein Molekül Wasser aus einem Sauerstoffatom und zwei Wasserstoffatomen besteht. Seine chemische Formel lautet also
H2O.
Eigenschaften von Wasser
| Name: |
Wasser |
| Chemische Formel |
H2O |
| Aggregatszustand (bei 20°C): |
flüssig |
| Erscheinung: |
geruchslose, durchsichtige Flüssigkeit |
| Molekülmasse: |
18 u (=29,890  10-27kg) 10-27kg) |
| Dichte: |
1,000 kg/l |
| Siedetemperatur: |
100°C |
| Schmelztemperatur: |
0°C |
Wasser besitzt eine Besonderheit, die sogenannte
Dichteanomalie. Das bedeutet, dass Wasser
bei etwa  C seine größte Dichte
C seine größte Dichte hat. Normalerweise steigt die Dichte eines Stoffes, je kälter er wird. Bei Wasser wird sie aber wieder geringer, wenn Wasser gefriert. Das liegt an der Struktur eines Wassermoleküls.
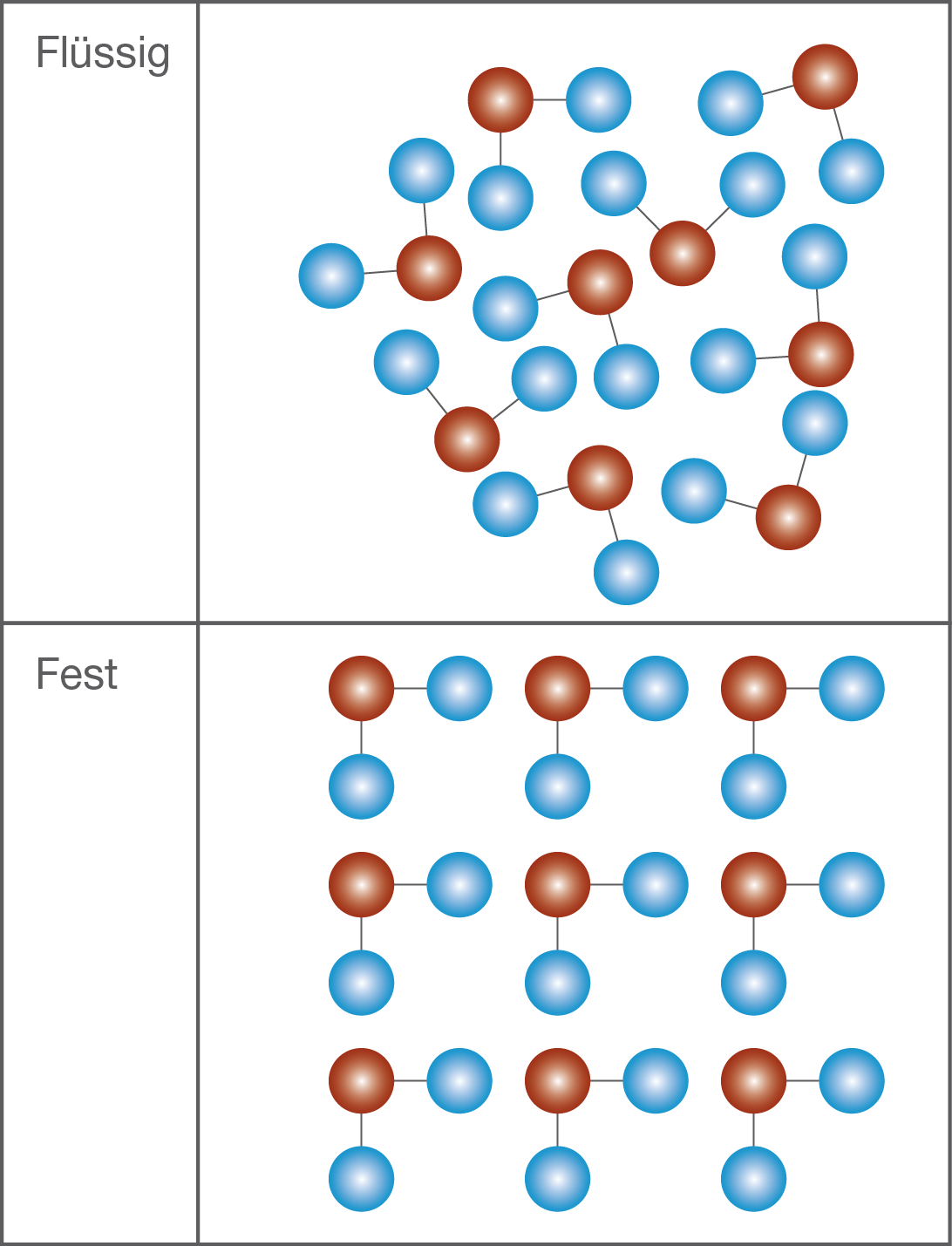
Abb. 3: Die gewinkelte Struktur von Wasser verursacht große Lücken, wenn Wasser gefriert.
Wasser ist ein gewinkeltes Molekül. Es sieht ungefähr aus wie ein V. An den Enden des V sitzen die Wasserstoffatome und an der Verbindungsstelle der zwei Striche ist das Sauerstoffatom. Wenn wir die Temperatur senken, dann bewegen sich die Wassermoleküle immer weniger und rücken immer näher zueinander. Wenn Wasser nun gefriert, dann ordnen sich die Moleküle in einem
festen Gitter an. Wie du in Abbildung 3 sehen kannst, entsteht dadurch ein
Gitter, das große Lücken aufweist. Dadurch kommt die Dichteanomalie zustande.
Was für Folgen hat das für uns? Der erste Vorteil besteht darin, dass Leben auch an den tiefsten und kältesten Winkeln der Erde im Wasser möglich ist. Denn egal wie tief wir tauchen, ob es das Wasser am Grund eines zugefrorenen Sees ist oder der tiefste Punkt im Marianengraben

unter der Meeresoberfläche. Das Wasser wird

C kalt sein. Somit ist es nicht gefroren und Fische können dort leben. Ein anderer Vorteil ist für uns im Sommer. Die Eiswürfel schwimmen in unserem Getränk oben. So bleibt die Limonade immer gekühlt.
Verwendung von Wasser
Jetzt haben wir uns Wasser einmal von der Struktur und von seinen Eigenschaften her näher angeschaut. Somit bleibt die Frage, wofür Wasser heutzutage verwendet wird.
Neben der Tatsache, dass Wasser eine sehr
wichtige Rolle in vielen Stoffwechselreaktionen in unserem Körper spielt, wird Wasser häufig als
Lösungsmittel verwendet. Sei es beim Spülen von Geschirr, dem Waschen von Wäsche oder auch in der Chemie.

Abb. 4: Solche hydraulischen Gelenke an Maschinen sind mit Wasser gefüllt.
Wasser wird jedoch auch oft als
Transportmittel verwendet. Ein Beispiel dafür ist die
Heizung. Wir erwärmen Wasser und pumpen es durch Rohre. Am Zielort angekommen gibt es seine Wärme an die Umgebung ab und wir können unsere Wohnung heizen. In der
Hydraulik wird Wasser auch als Druckübertragungsmedium verwendet. So etwas findest du z.B. bei Baggerarmen oder Bremsen im Auto.
Nicht zuletzt wird Wasser noch als ein Mittel zur
Brandbekämpfung verwendet. Es ist in der Lage große Mengen Wärme aufzunehmen und Sauerstoff, der den Brand nährt, vom Brandherd auszuschließen. Vorsichtig sollte man jedoch sein, wenn es sich um einen Metall- oder einen Fettbrand handelt. Löschen mit Wasser führt hierbei häufig zu heftigen Reaktionen und Stichflammen.
Du siehst, Wasser ist ein unheimlich vielseitiges Element, pardon an dieser Stelle müssen wir Empedokles und Aristoteles verbessern, eine vielseitige Verbindung. Ebenso vielfältig wie seine Anwendung ist jedoch auch der Name des Wassers. Denn Wasser kannst du auch bei seinem chemischen Namen „Dihydrogenmonoxid“ oder „Oxigeniumdihydrid“ rufen.
Bildnachweise [nach oben]
Public Domain
© 2016 - SchulLV.
© 2016 - SchulLV.
Public Domain



