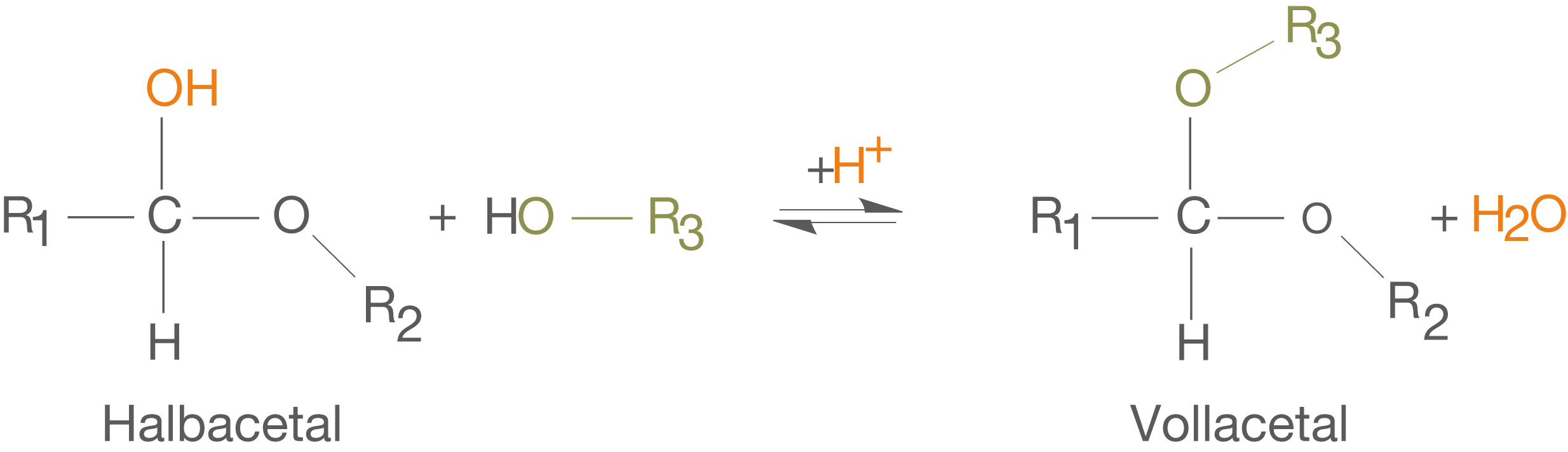Definition
Disaccharide (Zweifachzucker) stellen die häufigsten und einfachsten natürlichen Zucker dar. Viele natürliche Zucker liegen nicht in Form von Monosacchariden (Einfachzuckern) vor, sondern bilden Makromoleküle mit zwei bis mehreren tausenden Monomereinheiten (Monomer = kleinste molekulare Baueinheit). Wir betrachten in diesem Skript die einfachsten natürlichen Zucker, die Disaccharide, die sich aus zwei Monosacchariden zusammensetzen, welche aber nicht zwangsweise vom gleichen Typ sein müssen.

Die wichtigsten Eigenschaften der Disaccharide werden wir am Beispiel der Saccharose besprechen. An diesem Molekül werden wir uns die glycosidische Bindung anschauen und den Begriff des Vollacetals kennen und verstehen lernen. Daraufhin beschäftigen wir uns mit dem Phänomen der Rohrzuckerinversion und lernen in diesem Zusammenhang auch die Hydrolyse als Reaktionstyp kennen. Nach einem weiteren Kapitel, in welchem wir weitere wichtige Disaccharide in Form von Maltose, Lactose und Cellobiose kennen lernen, schließen wir das Skript mit einer Betrachtung des Verhaltens von Disacchariden in wässrigen Lösungen ab.
Disaccharide am Beispiel der Saccharose
Saccharose und ihre Monomere
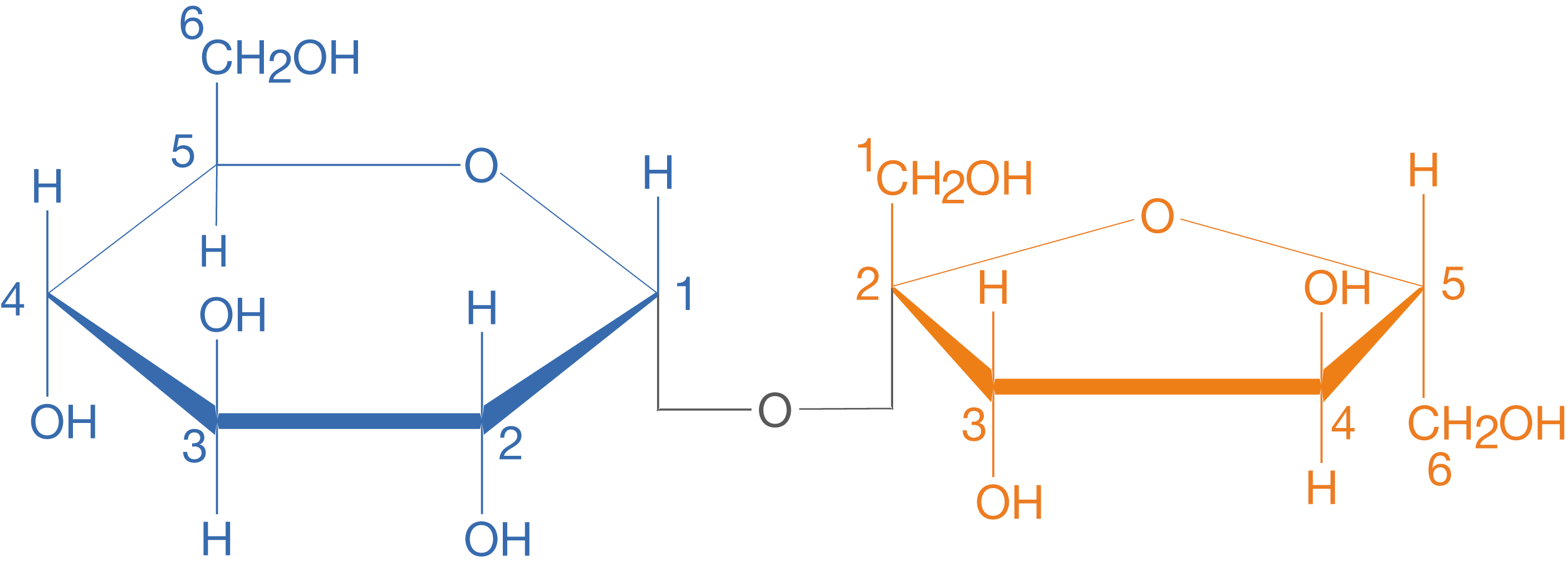
Das Disaccharid, mit dem wir alle schon in Berührung gekommen sind, ist die Saccharose. Wir kennen sie in Form des gewöhnlichen Haushaltszuckers. Saccharose ist aus einem Glucose- und einem Fructosemolekül aufgebaut:
In Abbildung 2 können wir sehen, wie die Molekülstruktur des Disaccharids Saccharose in der Haworth-Projektion dargestellt wird. Interessant ist nun die räumliche Orientierung des Fructosemoleküls sowie die schwarz eingezeichnete Bindung zwischen den beiden Monosacchariden. Ausführliche Informationen zu den Monosacchariden Glucose und Fructose findest du im ChemieLV-Skript Monosaccharide.
Orientierung der Monosaccharide
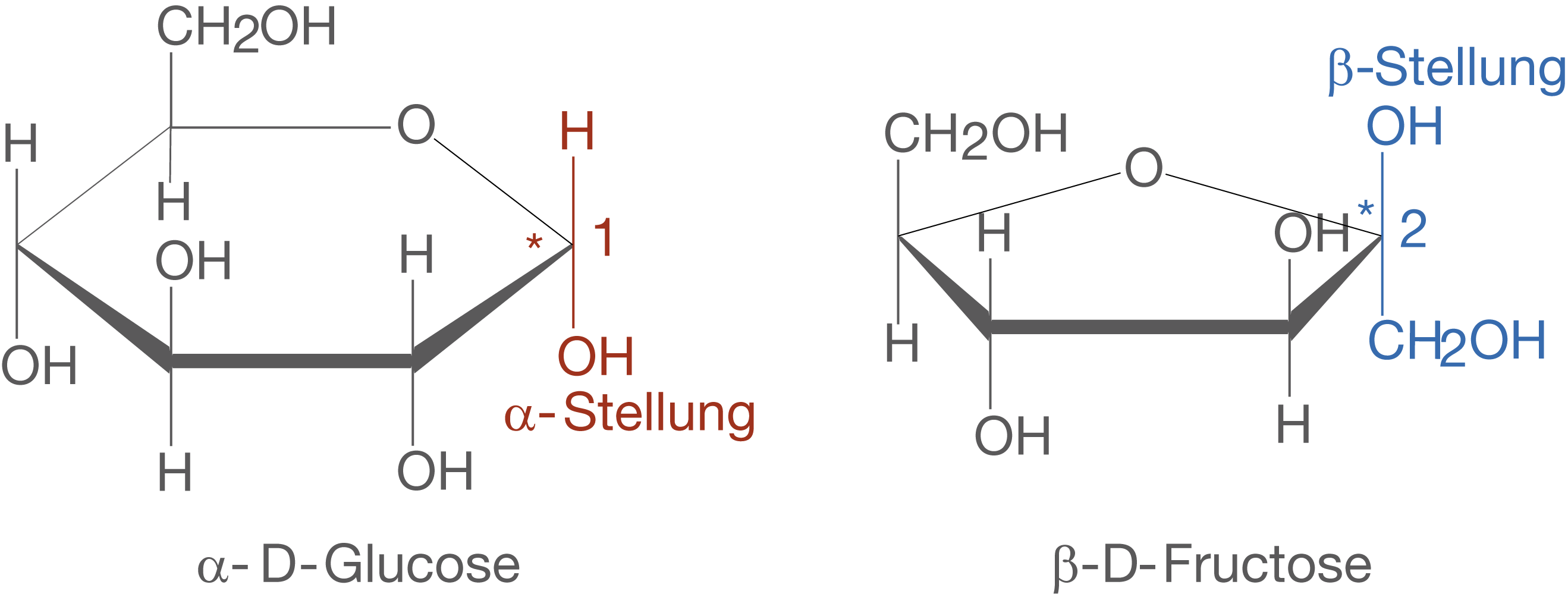
Wenn wir die Monomere der Saccharose genauer betrachten, dann fällt auf, dass es sich um -D-Glucose und
-D-Fructose handelt (vgl. Abb. 3).
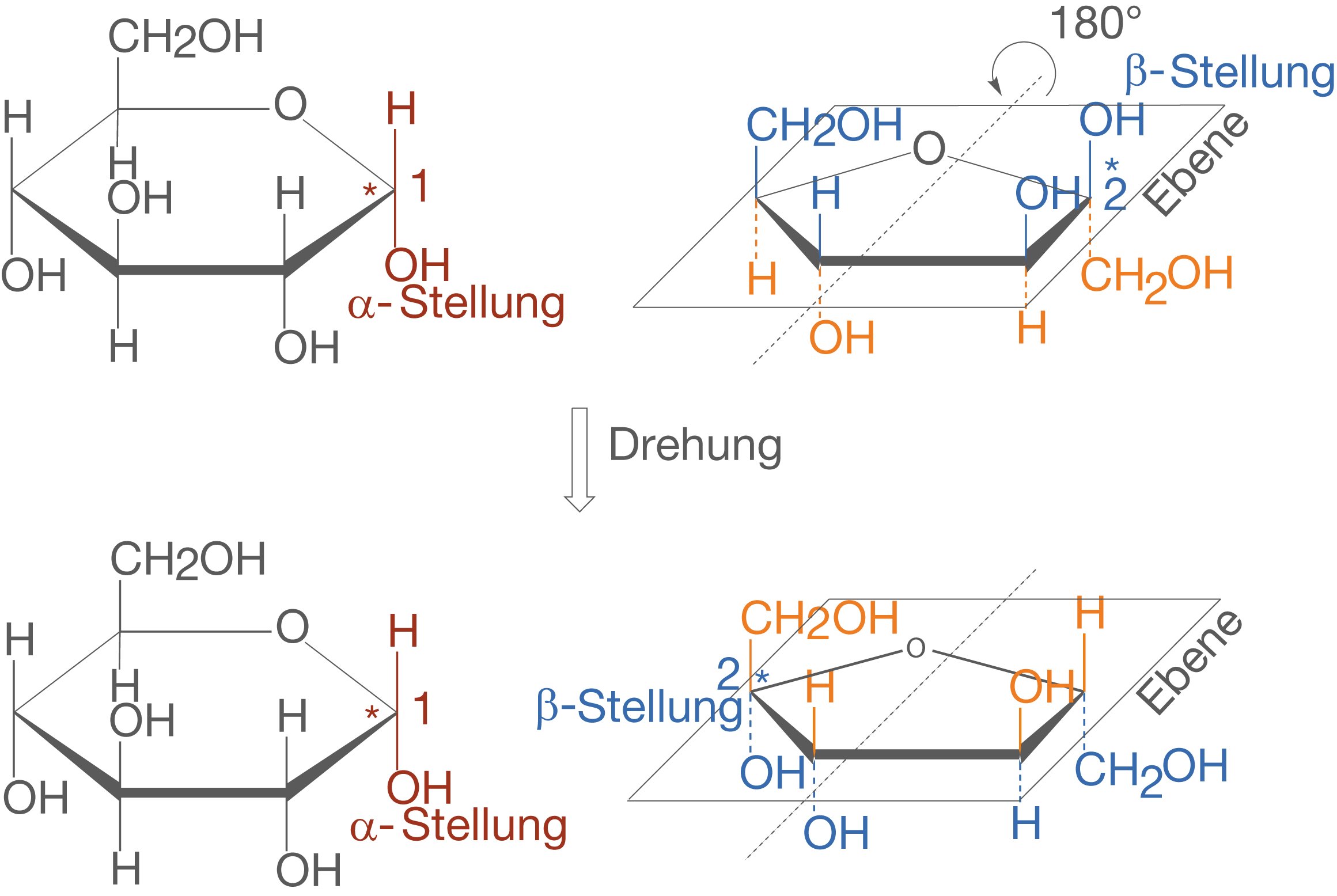
Anhand von Abbildung 2 können wir sehen, dass die beide Monomere über das C-1-Atom der Glucose sowie das C-2-Atom der Fructose verbunden sind. Betrachten wir vor diesem Hintergrund Abbildung 3, dann fällt auf, dass wir die Orientierung der Moleküle zueinander ändern müssen, damit eine solche Bindung möglich wird. Das bedeutet, dass wir das Molekül der -D-Fructose so drehen müssen, dass sich die die OH-Gruppen an den jeweiligen anomeren C-Atomen gegenüberstehen (vgl. Abb. 4).
- Blau markierte Substituenten stehen vor der Drehung über der Ebene, nach der Drehung darunter.
- Orange markierte Substituenten stehen vor der Drehung unter der Ebene, nach der Drehung darüber.
- Der Ring liegt in der Ebene.
Die glycosidische Bindung
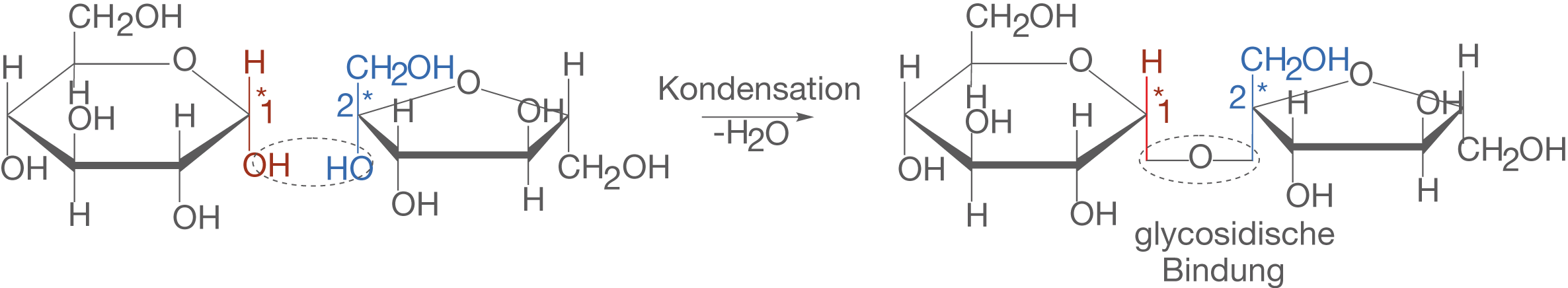
Nachdem wir die Orientierung derUnter Abspaltung von Wasser (Kondensationsreaktion) gehen die beiden Monosaccharide eine Bindung ein, die als glycosidische Bindung bezeichnet wird. Um genaue Informationen über die Bindungsverhältnisse zu erhalten, fließen die Eigenschaften der Monosaccharide in die Bindungsbezeichnung ein. Folgende Fakten sind für die relevante Bindung in Saccharose wichtig:
- Im Fall der Glucose liegt das
-Anomer vor und im Fall der Fructose das
-Anomer.
- Von der Glucose ist das C-1-Atom an der Bindung beteiligt, von der Fructose das C-2-Atom.
Vollacetale
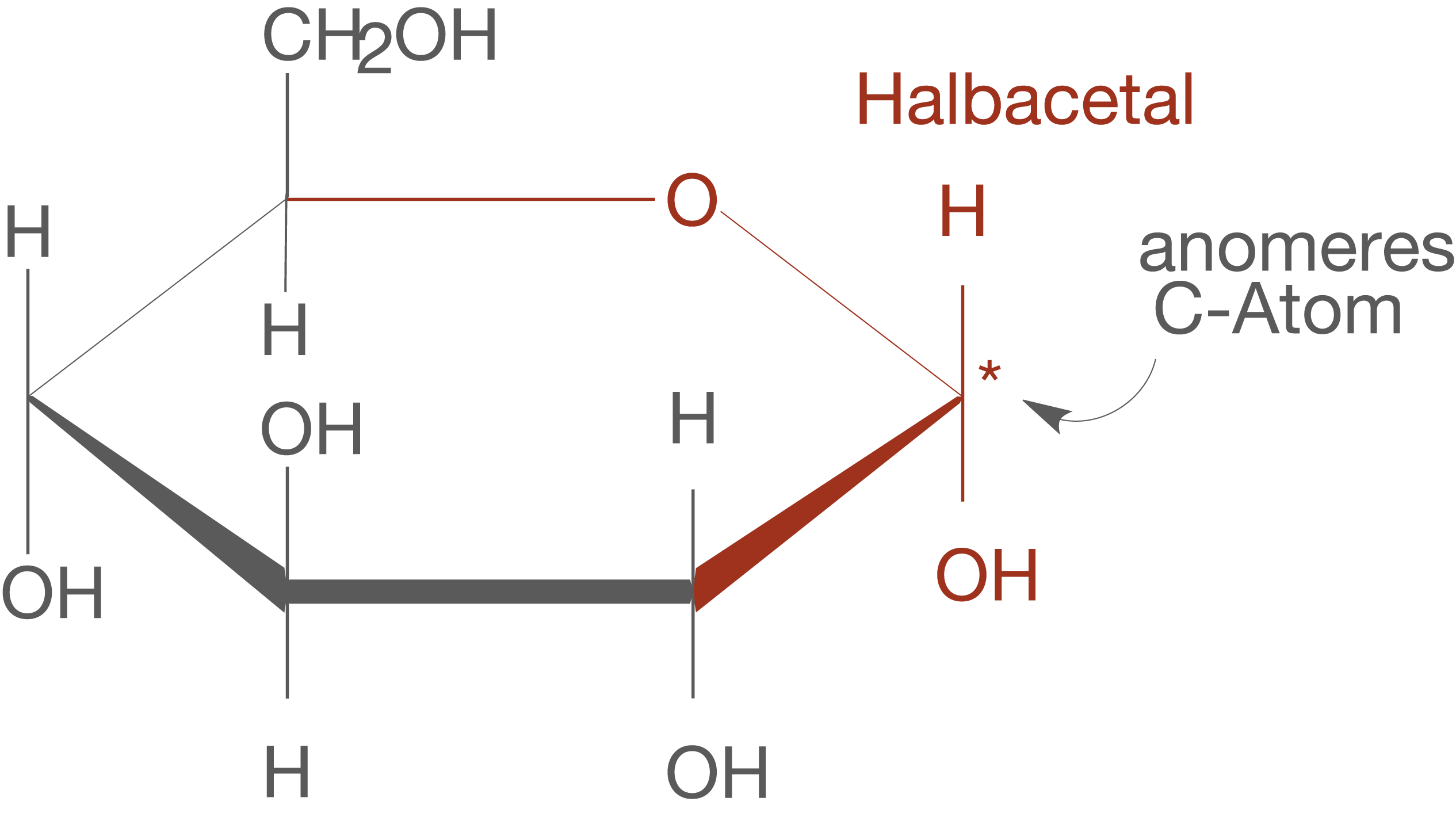
Im ChemieLV-Skript Monosaccharide haben wir bereits die Gruppe der Halbacetale kennen gelernt, zu denen cyclische Monosaccharide zählen (vgl. Abb. 6).Wir lassen dieses Halbacetal nun formal mit einem Alkohol reagieren, also mit einem Molekül, dass eine OH-Gruppe aufweist (vgl. Abb. 7). Wir haben eine ähnliche Betrachtung schon im ChemieLV-Skript Monosaccharide durchgeführt, wobei wir dort aber zunächst das Halbacetal kennen gelernt haben.
Hierbei handelt es sich um eine Kondensationsreaktion, da die Reaktion unter Abspaltung von Wasser (niedermolekulares Spaltprodukt) abläuft.
Anmerkung:
Die Kondensationsreaktion findest du auch im ChemieLV-Skript Polysynthese II: Polykondensation des Themengebiets Chemie der Makromoleküle. Dort haben wir Monomere zu einem Makromolekül verknüpft und so verschiedene Kunststoffe herstellen können. Das gleiche Prinzip findest du auch bei den Naturstoffen, wobei eine Kondensationsreaktion in diesem Fall zu natürlichen Makromolekülen führt.
Wir wollen diese Kondensationsreaktion nun ein wenig detaillierter betrachten, um zu verstehen, was hierbei geschieht.
Wichtig:
Der folgende Abschnitt hilft dir die Bildung des Vollacetals besser verstehen zu können. Dennoch wagen wir an dieser Stelle wieder einen Blick über den Tellerrand, was den Umfang der Betrachtung angeht. Du solltest aus diesem Kapitel insbesondere die Reaktion aus Abbildung 7 kennen und die folgenden Informationen als Unterstützung sehen.
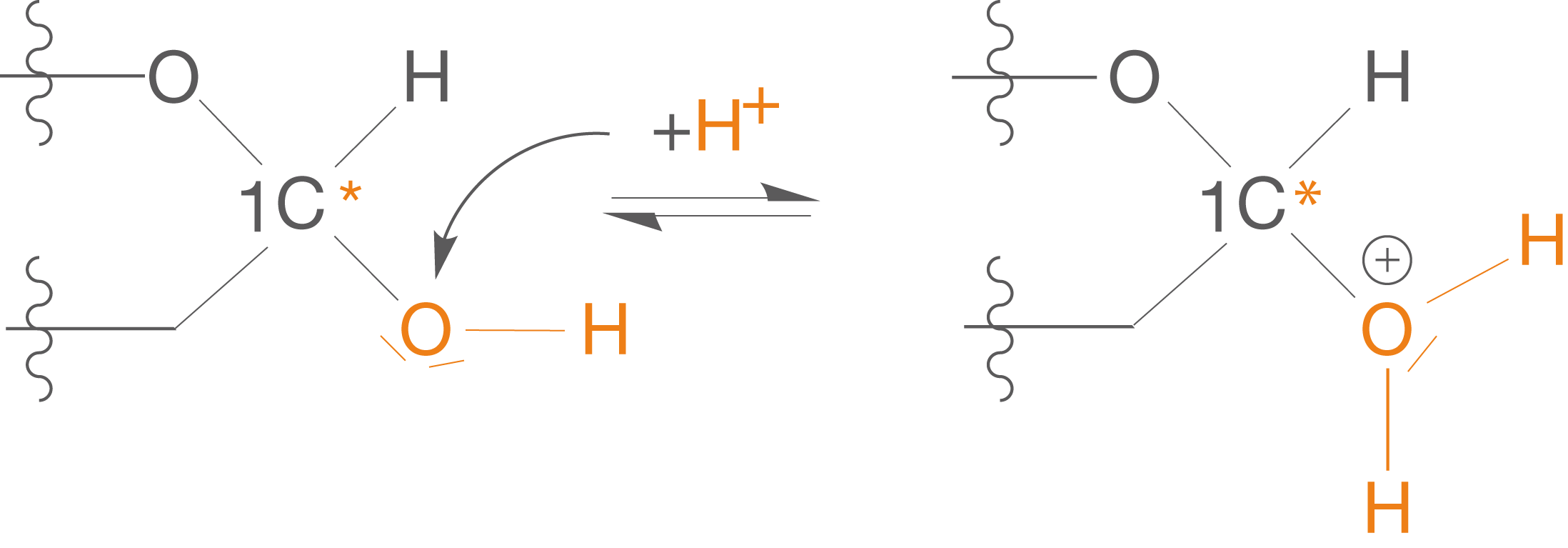
(1) Aktivierung der OH-Gruppe am anomeren C-Atom
Du konntest bereits in Abbildung 7 sehen, dass bei der Acetalbildung eine Säure () als Katalysator Verwendung findet. Bedenke: Es gibt kein freies
in wässriger Lösung sondern nur
, welches wir aber aus Gründen der Einfachheit hier nicht schreiben. Der Katalysator wird während dieser Reaktion wie üblich nicht verbraucht.
Das greift an einem freien Elektronenpaar des Sauerstoffs der OH-Gruppe an (vgl. Abb. 8).
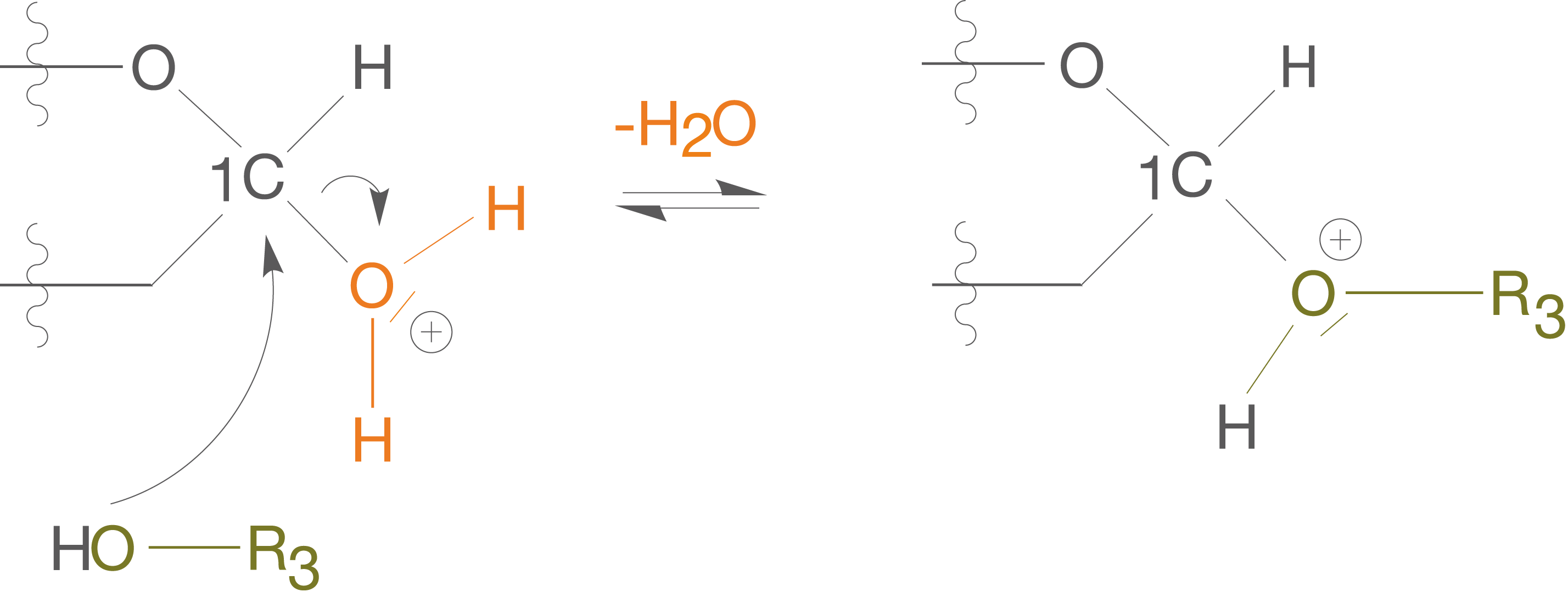
(2) Angriff des Alkohols unter Abspaltung von Wasser
Der Angriff im ersten Schritt findet zwar an der OH-Gruppe statt, erlaubt aber nun der OH-Gruppe des Alkohols mit dem anomeren C-Atom zu reagieren. Dieses wird im ersten Schritt positiv polarisiert.
In diesem Reaktionsschritt kommt es zur für die Kondensationsreaktion charakteristischen Abspaltung des Wassermoleküls, während der Alkohol aufgrund seiner freien Elektronenpaare am anomeren positiv polarisierten C-Atom angreifen kann (vgl. Abb. 9).
(3) Abspaltung des -Kations
Im letzten Schritt der Reaktion spaltet sich das -Kation wieder ab und wir erhalten so unser gewünschtes Vollacetal und den unverbrauchten Katalysator (
-Kation) (vgl. Abb. 10).
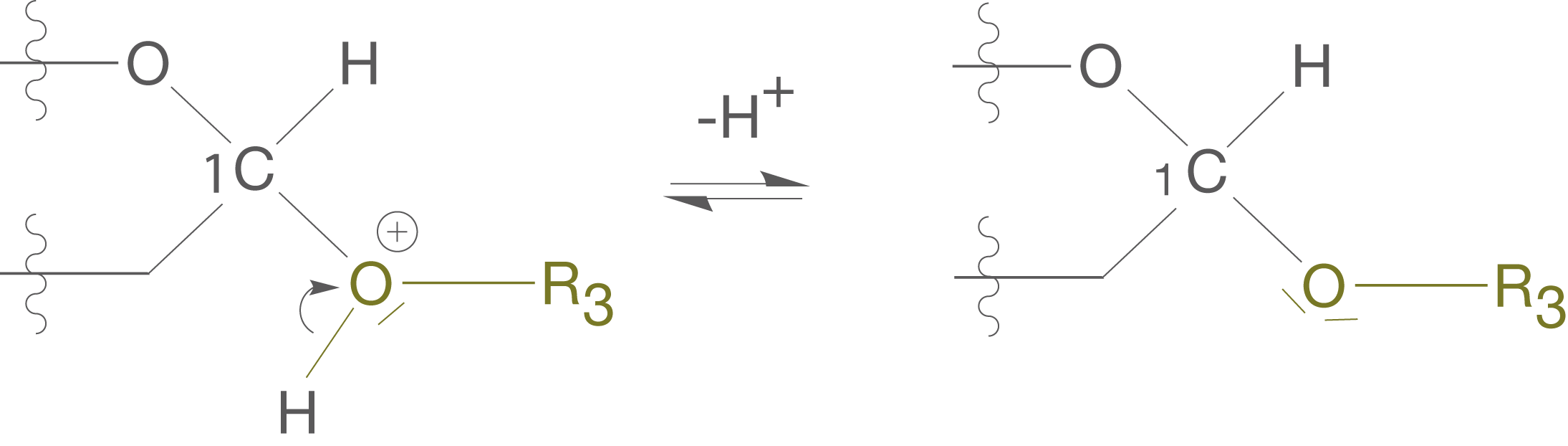
Die Kondensationsreaktion läuft folglich in drei Schritten ab, welche wir mit der Darstellung in Abbildung 7 nicht erahnen konnten. Der Katalysator ermöglichte diese Reaktion überhaupt erst, da er maßgeblich dafür verantwortlich ist, dass sich das -Molekül abspalten kann.
Rohrzuckerinversion und Hydrolyse
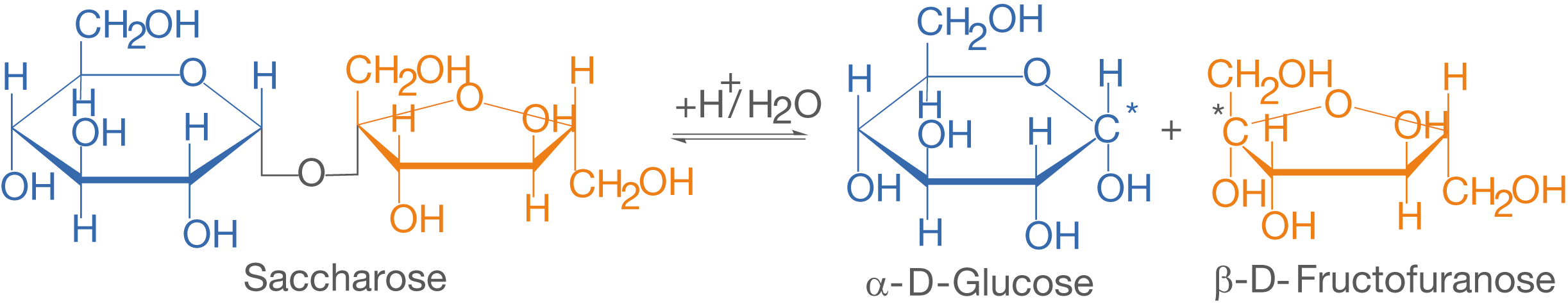
Wenn wir Saccharose in Wasser lösen und den spezifischen Drehwinkel Hydrolyse der Saccharose
Die Änderung des spezifischen Drehwinkels können wir in sauren Lösungen () beobachten. In diesen kann die sogenannte Hydrolyse der Saccharose ablaufen. Hierbei wird das Saccharosemolekül in Anwesenheit von
und
gespalten und es entstehen die entsprechenden Monomere
-D-Glucose und
-D-Fructofuranose (vgl. Abb. 11).
Beachte die Orientierung der -D-Fructofuranose!
Rohrzuckerinversion
Durch die hydrolytische Spaltung von Saccharose erhalten wir die beiden entsprechenden Monosaccharide. Nach der Spaltung liegen also sowohl -D-Glucose als auch
-D-Fructofuranose in der wässrigen Lösung vor. An dieser Stelle wird nun das Phänomen der Mutarotation wichtig, welches wir im Rahmen des ChemieLV-Skripts Monosaccharide am Beispiel der
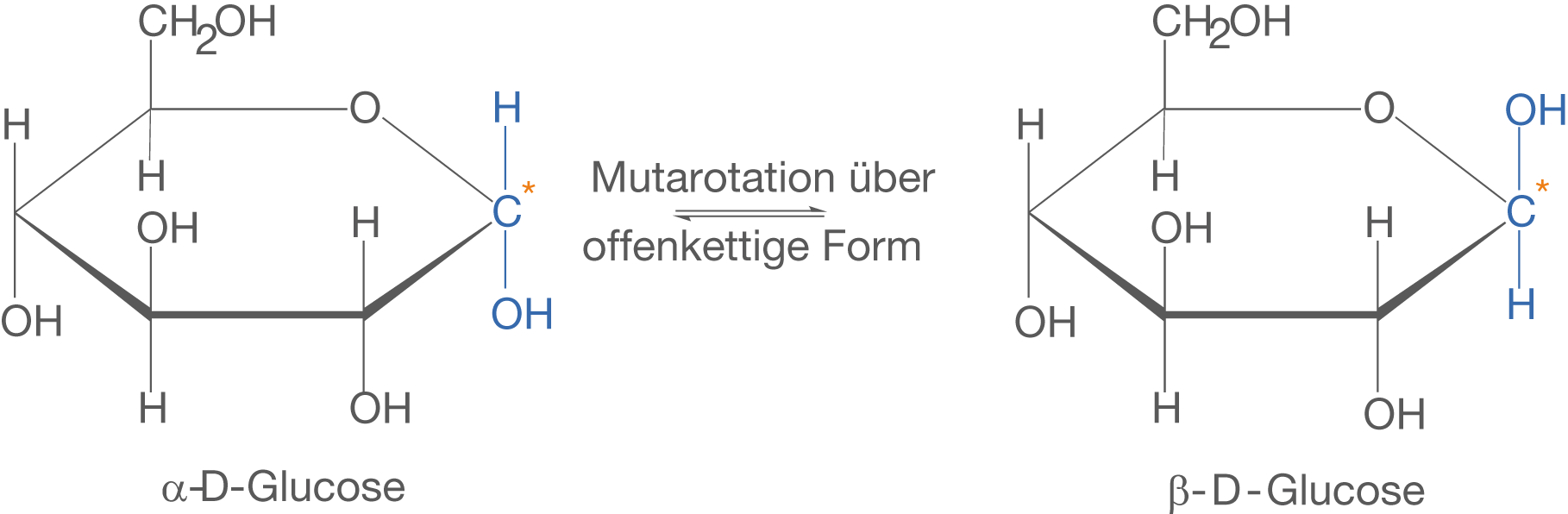
-D-Glucose detailliert besprechen. Beide Monosaccharide zeigen hier die Eigenschaft der Mutarotation, sodass wir in der Summe auf vier unterschiedliche Moleküle kommen (vgl. Abb. 12 und 13).
Durch die Mutarotation liegt Glucose sowohl als -D-Glucose als auch als
-D-Glucose vor (vgl. Abb. 12).
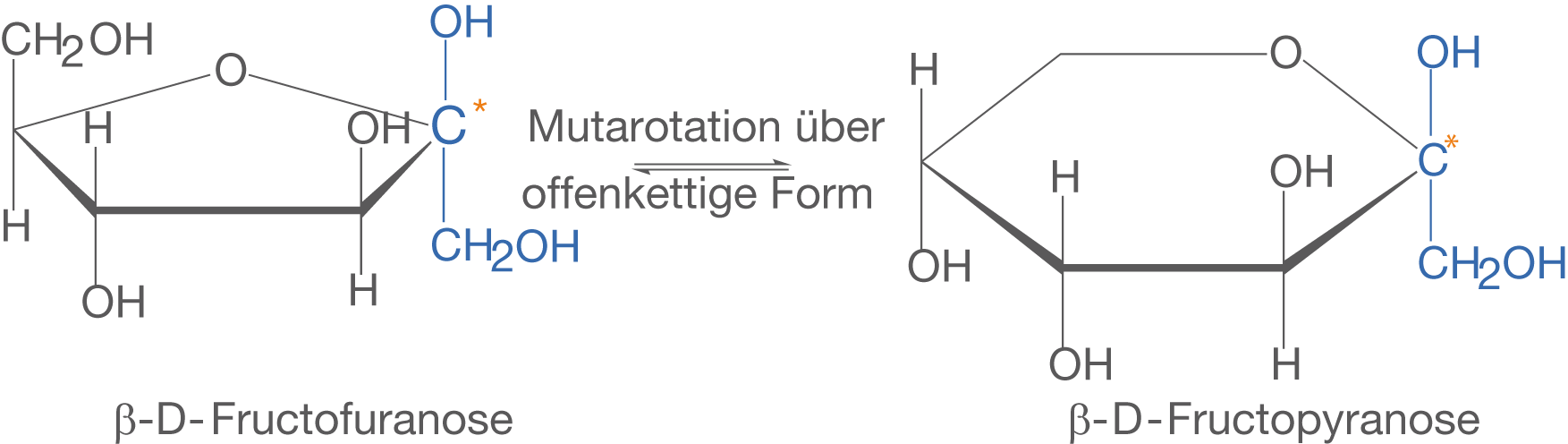
Im Fall von Fructose führt die Mutarotation zu einem Gemisch aus -D-Fructofuranose und
-D-Fructopyranose. Aus diesem Grund haben wir auch in diesem Kapitel ausdrücklich von Fructofuranose gesprochen, da wir die Strukturinformation der Furanose (vgl. ChemieLV-Skript Monosaccharide) nun im Zusammenhang mit der Mutarotation benötigen. Die optische Aktivität ergibt sich nun anteilsmäßig aus den optischen Aktivitäten der enthaltenen Verbindungen, wobei sich der spezifische Drehwert zu
ergibt. Die Tatsache, dass sich dieser spezifische Drehwert von
nach
ändert, verleiht diesem Phänomen die Bezeichnung der Inversion: Es handelt sich um eine Inversion des Vorzeichens; es wurde umgedreht. In der Natur tritt die Rohrzuckerinversion bei Honig auf. Dabei nutzen die Bienen das Enzym Invertase, um Saccharose zu spalten. Im Anschluss ist das gleiche Phänomen zu beobachten, wie gerade besprochen.
Weitere Disaccharide
Maltose und ihr Monomer
Ein weiteres wichtiges Disaccharid ist die Maltose, welche auch als Malzzucker bekannt ist. Die Maltose entsteht beim Mälzen, also dem kontrollierten Keimen von Getreide und findet sich beispielsweise in Bier wieder. In dem Sinne „Hopfen und Malz, Gott erhalt‘s“. Abb. 15: Ein Glas Bier, welches Maltose enthält
Abb. 15: Ein Glas Bier, welches Maltose enthält
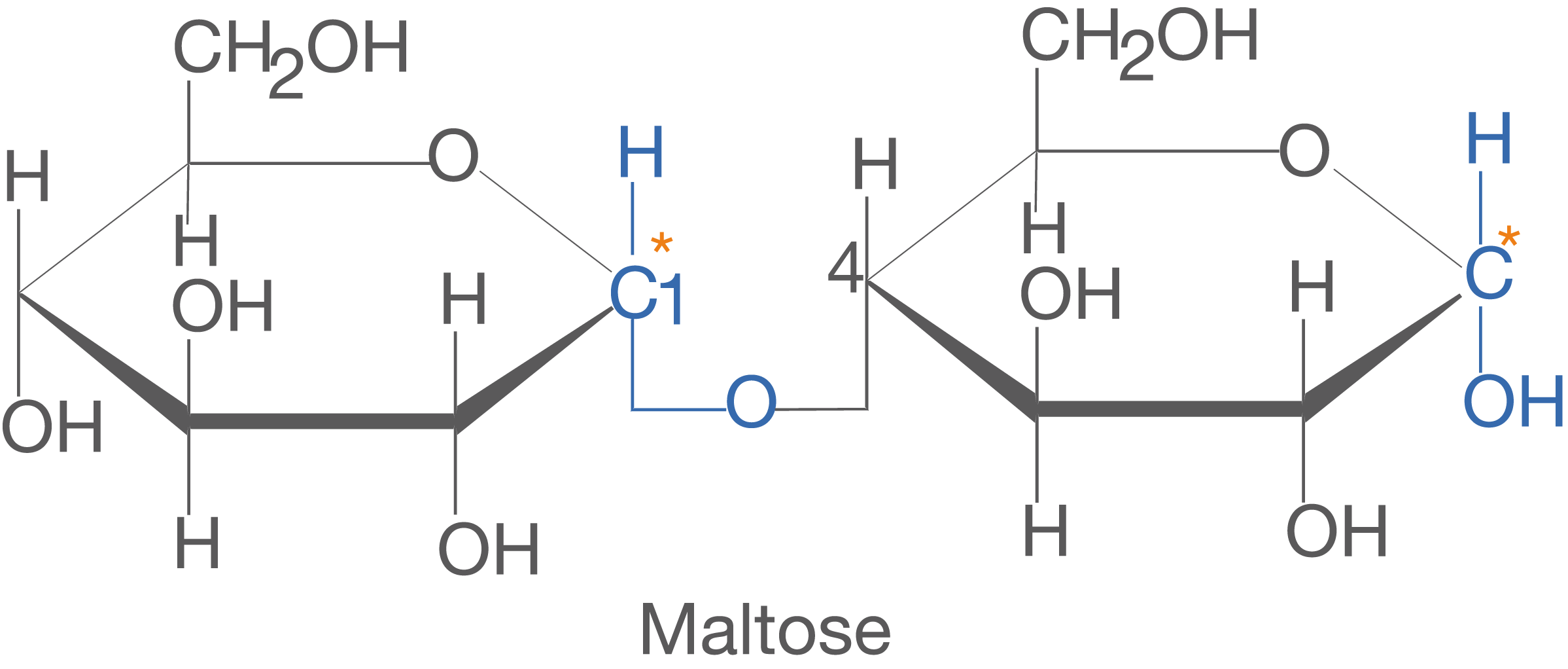
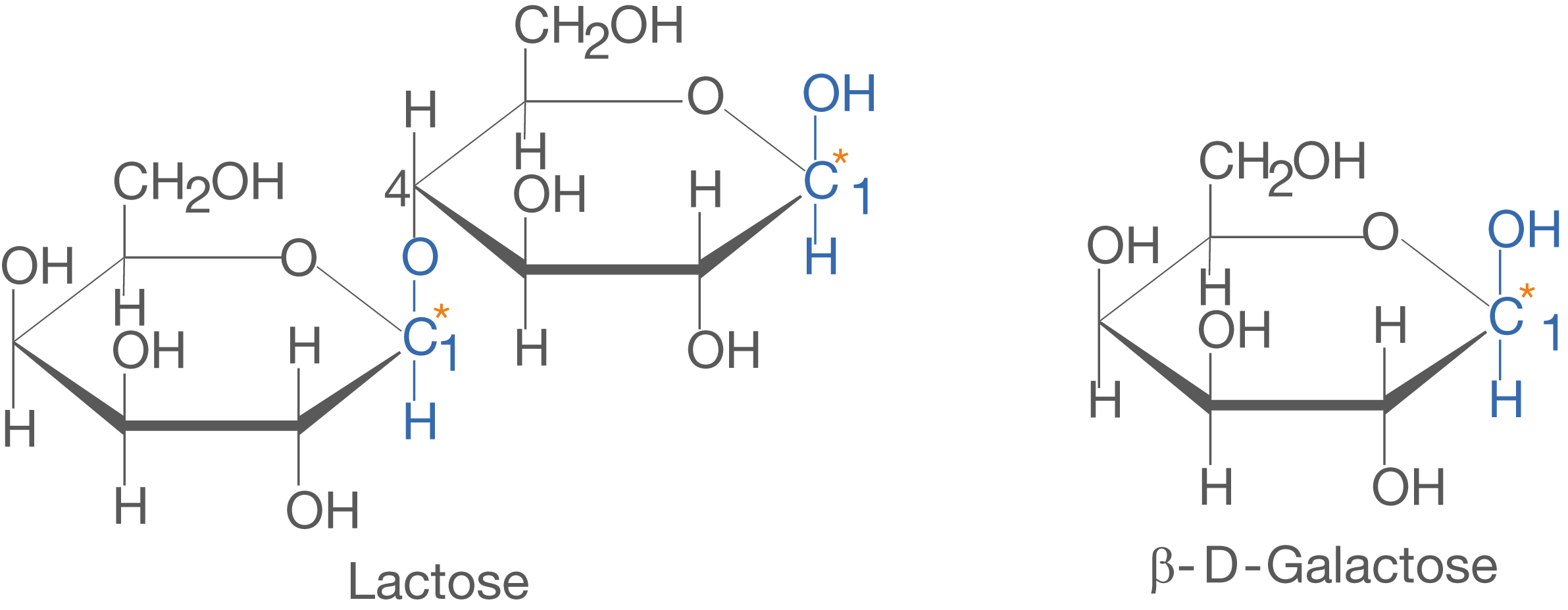
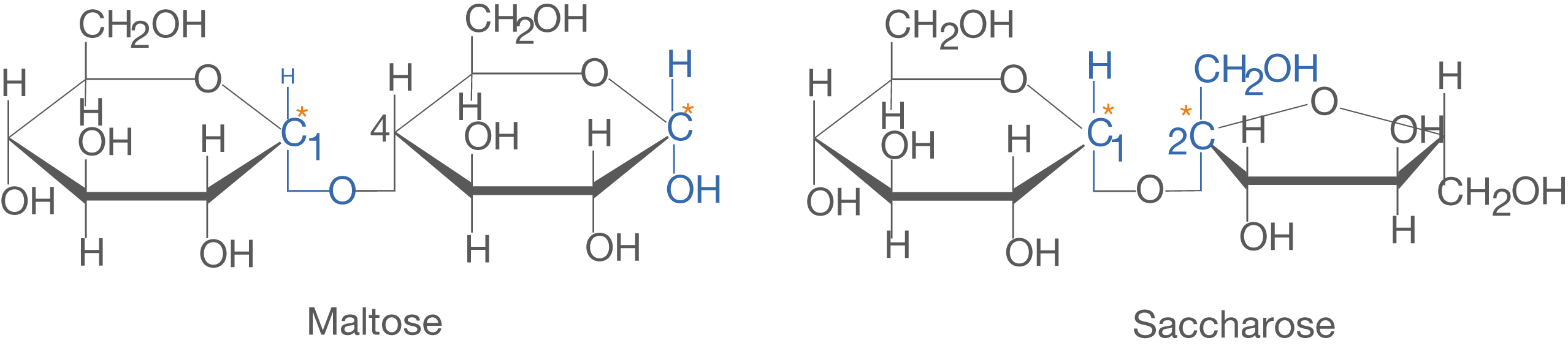
Maltose besteht aus zwei -D-Glucose Molekülen und ist
-1,4-glycosidisch verknüpft. Das heißt, dass das C-1-Atom des einen Monomers über die glycosidische Bindung mit dem C-4-Atom des zweiten Monomers verknüpft ist.
Lactose und ihre Monomere
Eines der gesellschaftlich wohl bekanntesten Disaccharide ist die Lactose oder auch Milchzucker.Die Bekanntheit der Lactose ist aber wohl vor allem auf den Begriff an sich beschränkt, der vor allem im Zusammenhang mit der Lactoseintoleranz zu einem etwas zweifelhaften Ruhm gefunden hat.
Lactose ist aus den beiden Monosacchariden -D-Glucose und
-D-Galactose aufgebaut. Beide Moleküle sind in Lactose
-1,4-glycosidisch verknüpft. Galactose gehört ebenso wie Fructose und Glucose zu den natürlichen Monosacchariden und unterscheidet sich von Glucose in der Stellung der OH-Gruppe am C-4-Atom.
Disaccharide in wässrigen Lösungen
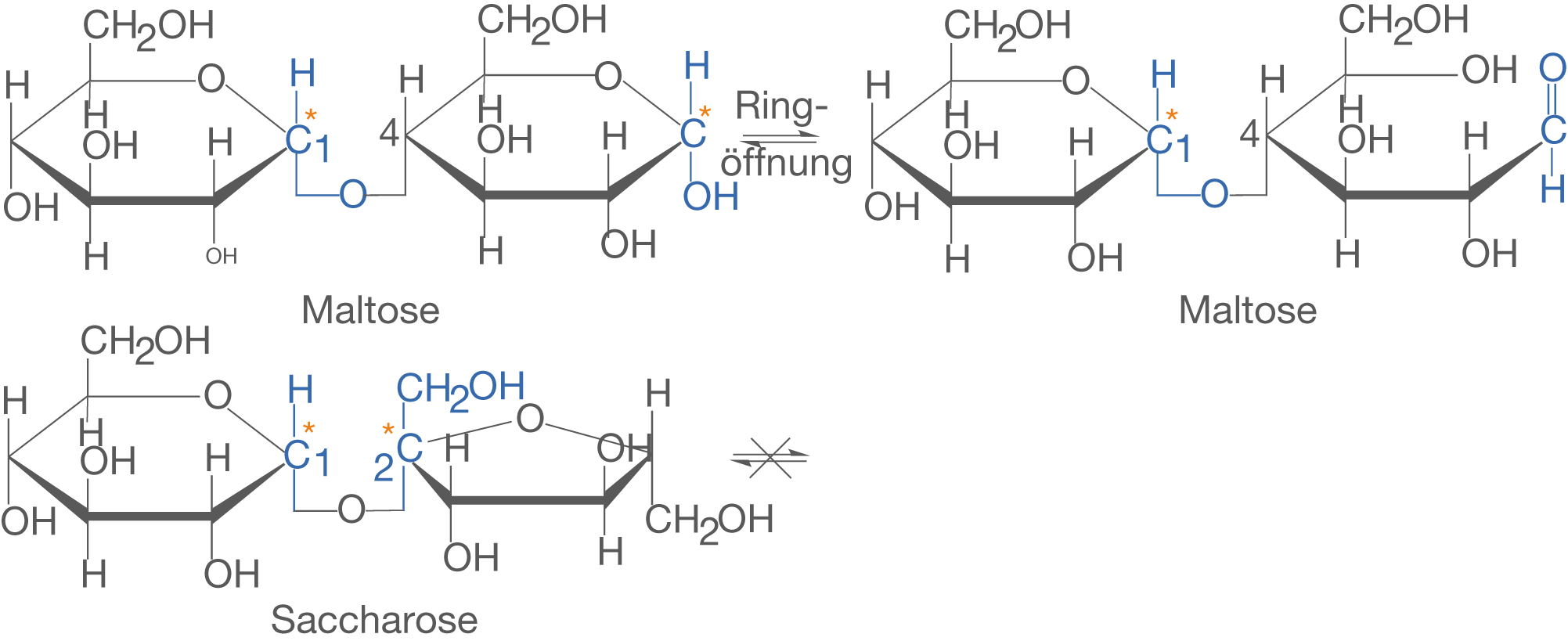
Wir wollen uns abschließend mit Disacchariden in wässrigen Lösungen beschäftigen. Hierbei betrachten wir beispielhaft Saccharose und Maltose. In diesem Kapitel geht es uns insbesondere um die Eigenschaft des reduzierenden Zuckers, welche in wässrigen Lösungen eine freie Aldehydgruppe aufweisen (vgl. ChemieLV-Skript Monosaccharide). Wir vergleichen nun Saccharose und Maltose (vgl. Abb. 17) und schauen nach, ob eine freie Aldehydgruppe auftreten kann oder nicht.Uns interessieren an dieser Stelle die glycosidischen Bindungen und die Beteiligung der anomeren C-Atome. Im Fall von Maltose liegt eine -1,4-glycosidische Bindung vor und das anomere C-Atom des rechten Glucose-Monomers ist an keiner weiteren Bindung beteiligt.
Im Fall der Saccharose sind die Monomere -1,2-glycosidisch verknüpft: Sowohl das anomere C-Atom der Fructose, als auch das der Glucose ist an der Bindung beteiligt. Wenn das anomere C-Atom nicht an einer glycosidischen Bindung beteiligt ist, kommt es in wässriger Lösung zur Öffnung des Rings (vgl. ChemieLV-Skript Monosaccharide) (vgl. Abb. 18).
Im Fall der Maltose findet im Gegensatz zur Saccharose eine Öffnung des Rings statt. Das ist dadurch möglich, dass das anomere C-Atom des zweiten Monomers der Maltose nicht an der glycosidischen Bindung beteiligt ist. Somit ist hier eine freie Aldehydgruppe vorhanden, die auf Proben für reduzierende Zucker anspringt. Im Gegensatz dazu steht die Saccharose. Hier sind die beiden anomeren C-Atome von Glucose und Fructose an der glycosidischen Bindung beteiligt, was eine Öffnung des Rings verhindert.
Disaccharide, deren glycosidische Bindung nicht zwischen den beiden anomeren C-Atomen geknüpft ist, weisen in wässrigen Lösungen die Eigenschaften reduzierender Zucker auf. Aufgrund der Ringöffnung liegt hier eine freie Aldehydgruppe vor, welche durch Proben wie die Tollens- und die Fehling-Probe nachgewiesen werden können (vgl. ChemieLV-Skript Monosaccharide).
Zusammenfassung
- Die einfachsten natürlichen Zucker sind die Disaccharide, welche aus zwei Monosacchariden aufgebaut sind.
- Saccharose, gewöhnlicher Haushaltszucker, besteht aus
-D-Glucose und
-D-Fructose.
- Die Bindung zwischen zwei Monosacchariden wird glycosidische Bindung genannt. In die Bindungsbezeichnung fließt die Bezeichnung des anomeren an der Bindung beteiligten C-Atoms sowie die Nummer der an der Bindung beteiligten C-Atome ein.
- Disaccharide zählen zu den Vollacetalen, die durch eine Kondensationsreaktion (Abspaltung von Wasser) entstehen.
- Die hydrolytische Spaltung von Saccharose führt zur Bildung eines Gemischs optisch aktiver Substanzen. Die Änderung des Drehwerts von positiv nach negativ gibt diesem Phänomen seinen Namen: Rohrzuckerinversion.
- In der Natur findet die Rohrzuckerinversion beispielsweise bei der Honigproduktion durch Bienen statt, die Saccharose mithilfe des Enzyms Invertase spalten.
- Maltose (Malzzucker) ist aus zwei
-D-Glucose Molekülen aufgebaut, welche
-1,4-glycosidisch verknüpft sind.
- Lactose (Milchzucker) setzt sich aus
-D-Glucose und
-D-Galactose zusammen, welche
-1,4-glycosidisch verknüpft sind.
- Cellobiose ist das Produkt der hydrolytischen Spaltung von Cellulose und ist aus zwei
-D-Glucose Molekülen aufgebaut, welche
-1,4-glycosidisch verknüpft sind.
- Disaccharide, die freie anomere C-Atome aufweisen, zeigen in wässrigen Lösungen die Eigenschaften reduzierender Zucker, da nach der Öffnung des Rings freie Aldehydgruppen vorliegen.
- Reduzierende Zucker lassen sich mittels der Fehling- und der Tollensprobe nachweisen.