Tenside
Definition
In diesem Skript beschäftigen wir uns mit der Stoffklasse der Tenside, die aufgrund ihrer besonderen strukturellen Eigenschaften bspw. Anwendung in Form von Waschmitteln finden. Gleichzeitig wollen wir die Tenside von den Seifen unterscheiden lernen und die Unterschiede aufzeigen und verstehen.



Tenside
Tenside sind grenzflächenaktive Substanzen, die einen amphiphilen Charakter aufweisen. Wir wollen dem Begriff der Amphilie in Zusammenhang mit der Struktur von Tensiden das nächste Kapitel widmen. Unter Amphiphilie verstehen wir die Eigenschaft eines Moleküls gleichzeitig hydrophil und lipophil zu sein. Daraufhin wenden wir uns dann den Grenzflächen zu.
Struktureller Aufbau von Tensiden - Amphiphilie
Tenside sind grundsätzlich immer gleich aufgebaut; sie weisen ein polares und ein unpolares Ende auf. Während das unpolare Ende im Regelfall aus langen C-Ketten besteht, kann das polare Ende variieren. Das bedeutet, dass Tenside aufgrund der unterschiedlichen Bereiche innerhalb des Moleküls sowohl mit polaren, als auch mit unpolaren Lösungsmitteln wechselwirken können. Diesen Umstand beschreibt die Eigenschaft der Amphiphilie: Amphiphile Substanzen sind sowohl in polaren als auch in unpolaren Lösungsmitteln lösbar.
Bezüglich des polaren Endes können wir Tenside rein strukturell in vier Gruppen unterteilen: anionische, kationische, nicht-ionische und amphotere (zwitterionische) Tenside.
Anionische Tenside
Unter dem Begriff der anionischen Tenside fassen wir diejenigen zusammen deren polare Gruppe eine negative Ladung trägt.
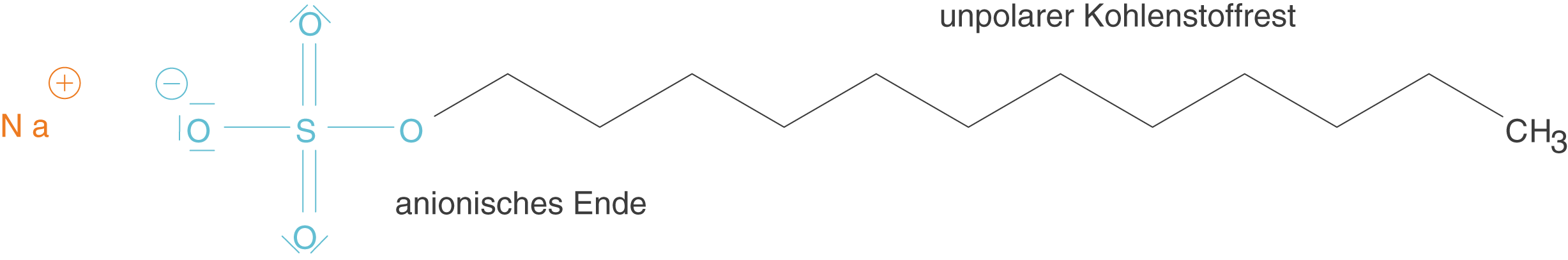
Abb. 2: Anionische Tenside weisen anionische Gruppen auf, die den polaren Charakter mit sich bringen
In Abbildung 3 siehst du beispielhaft das Natriumlaurylsulfat als Beispiel eines anionischen Tensids. Der endständige Sulfatrest ist hierbei das polare anionische Ende. Das unpolare Ende wird von einer C-Kette aus 12 C-Atomen aufgebaut.
Kationische Tenside
Im Falle der kationischen Tenside trägt die polare Gruppe eine positive Ladung.
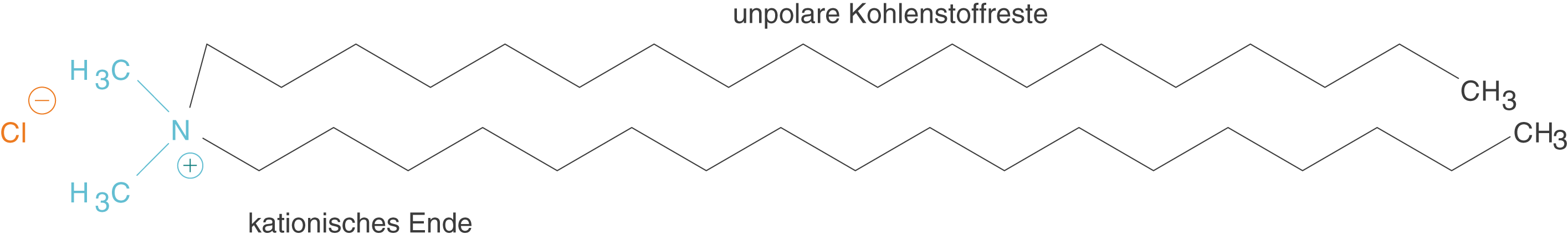
Abb. 3: Kationische Tenside weisen kationische Gruppen auf, die den polaren Charakter mit sich bringen
In Abbildung 3 ist ein beispielhaftes kationisches Tensid dargestellt: Distearyldimethylammoniumchlorid (DSDMAC). Kationische Tenside sind meistens quartäre Amine, also Stickstoffatome, an denen vier C-Reste hängen. Die vier Substituenten am N-Atom rufen eine positive Ladung hervor.
Nicht-ionische Tenside
Nicht-ionische Tenside tragen keine Ladung, wie aus der Bezeichnung bereits hervorgeht. Dahingegen weist der polare Teil des Moleküls polare Reste auf (vgl. Abb. 4).
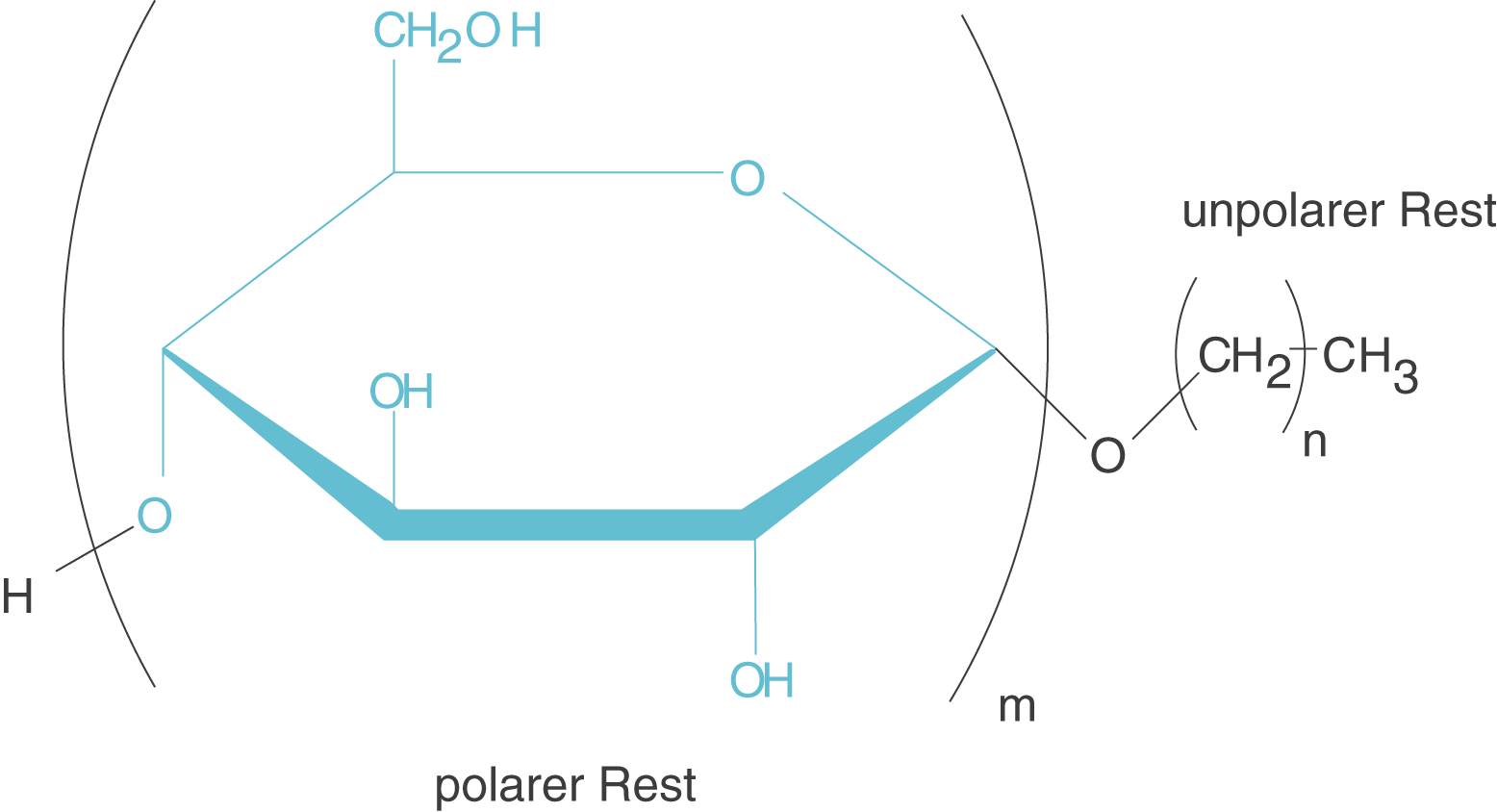
Abb. 4: Nicht-ionische Tenside weisen nicht-ionische polare Gruppen auf
Ein Beispiel für ein nicht-ionisches Tenside sind die sogenannten Alkylpolyglycoside (APG). Hier finden wir am einen Ende ein Glucosemolekül vor, welches selbst polar ist, im Gegensatz zu dem unpolaren Alkylrest.
amphotere Tenside
Die amphoteren Tenside werden auch als zwitterionische Tenside bezeichnet. Sie tragen sowohl eine negative als auch eine positive Ladung. Das Konzept der Zwitterionen kennen wir bereits von den Aminosäuren!
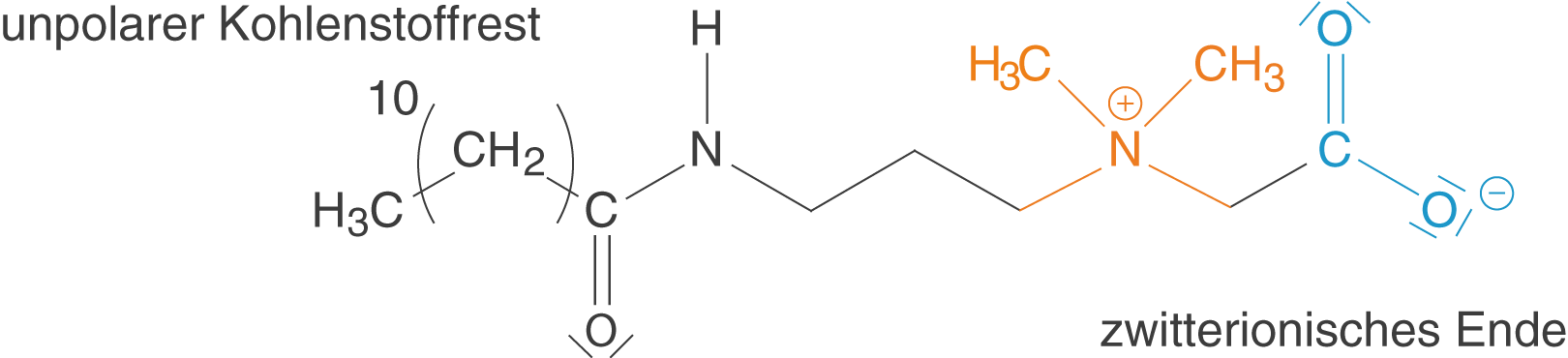
Abb. 5: Zwitterionische Tenside tragen sowohl eine positive als auch eine negative Ladung
Das in Abbildung 5 dargestellte Molekül zählt zu der Gruppe der Betaine und stellt ein amphoteres Tensid dar. Du kannst sehen, dass der zwitterionische Charakter durch die deprotonierte Carboxygruppe (blau) und die quartäre Ammoniumgruppe (orange) hervorgerufen wird.
Grenzflächenaktivität und Tenside
Grenzflächen
Bevor wir uns um die Grenzflächenaktivität von Tensiden kümmern können, müssen wir zunächst den Begriff der Grenzfläche klären. Interessanterweise kennst du bereits eine ganze Menge Grenzflächen aus dem Alltag. Grenzflächen finden wir zwischen zwei Phasen. Unter einer Phase verstehen wir einen Teil eines Systems in dem es keine sprunghaften Änderungen physikalischer Eigenschaften gibt. Wir wollen die neuen Begrifflichkeiten gleich an Beispielen klären.
Unterschiedliche Aggregatszustände
Wenn du Nudeln kochen willst und Wasser in einen Topf füllst, dann findest du eine Grenzfläche zwischen dem Wasser im Topf und der Luft darüber. Wir haben dabei zwei Phasen vorliegen: das Wasser und die Luft darüber.
Ein anderes Beispiel bezieht sich auf einen Stein, den du in einen See wirfst. Hier haben wir nun ebenfalls eine Grenzfläche zwischen dem festen Stein und dem flüssigen Wasser. Du findest Grenzflächen also auf jedenfall dort, wo sich die Aggregatszustände zweier Stoffe unterscheiden (vgl. Abb. 6).
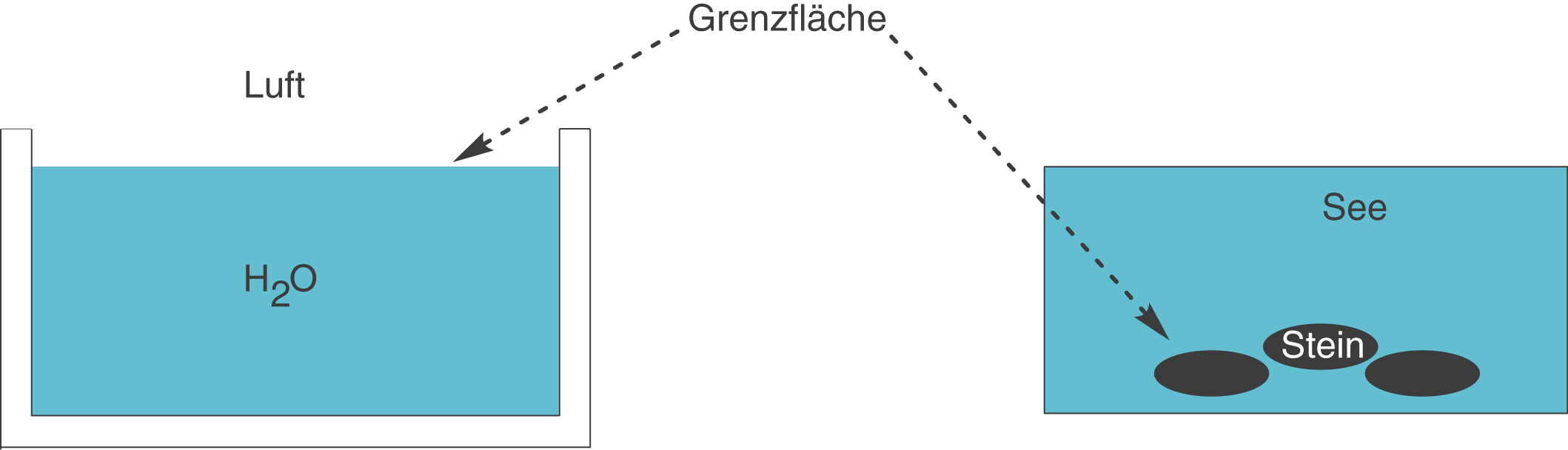
Abb. 6: Grenzflächen zwischen Phasen unterschiedlicher Aggregatszustände
Gleiche Aggregatszustände
Wichtig ist jedoch, dass wir auch die Grenzflächen beachten, die sich zwischen zwei Phasen mit gleichen Aggregatszuständen ausbilden. Betrachten wir beispielsweise einen Topf mit Nudelwasser in welches wir Öl geben. Das Öl wird aufgrund seiner geringeren Dichte oben auf dem Wasser schwimmen. Wenn wir richtig viel Öl verwenden, dann erhalten wir ein Bild wie in Abbildung 7 dargestellt.
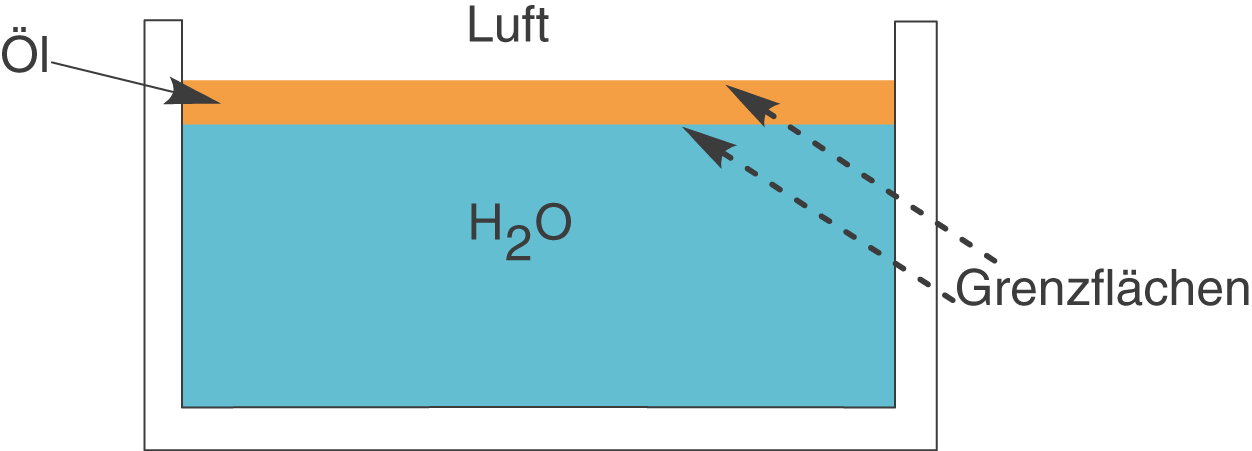
Abb. 7: Grenzflächen zwischen Phasen gleicher Aggregatszustände
Wenn wir ganz genau hinsehen, dann fällt auf, dass wir hier sogar zwei Grenzflächen vorliegen haben: Wasser - Öl und Öl - Luft.
Grenzflächenaktivität und Oberflächenspannung
Stoffe, die sich bevorzugt an Grenzflächen anlagern, werden als grenzflächenaktiv bezeichnet. Tenside sind aufgrund ihrer speziellen Molekülstruktur, die wir unter 2.1 kennen gelernt haben ganz besonders grenzflächenaktiv. Dabei richten sich die Moleküle eines Tensids immer so aus, dass die polaren Enden innerhalb der polaren Phase liegen und die unpolaren innerhalb der unpolaren Phase (vgl. Abb. 8).
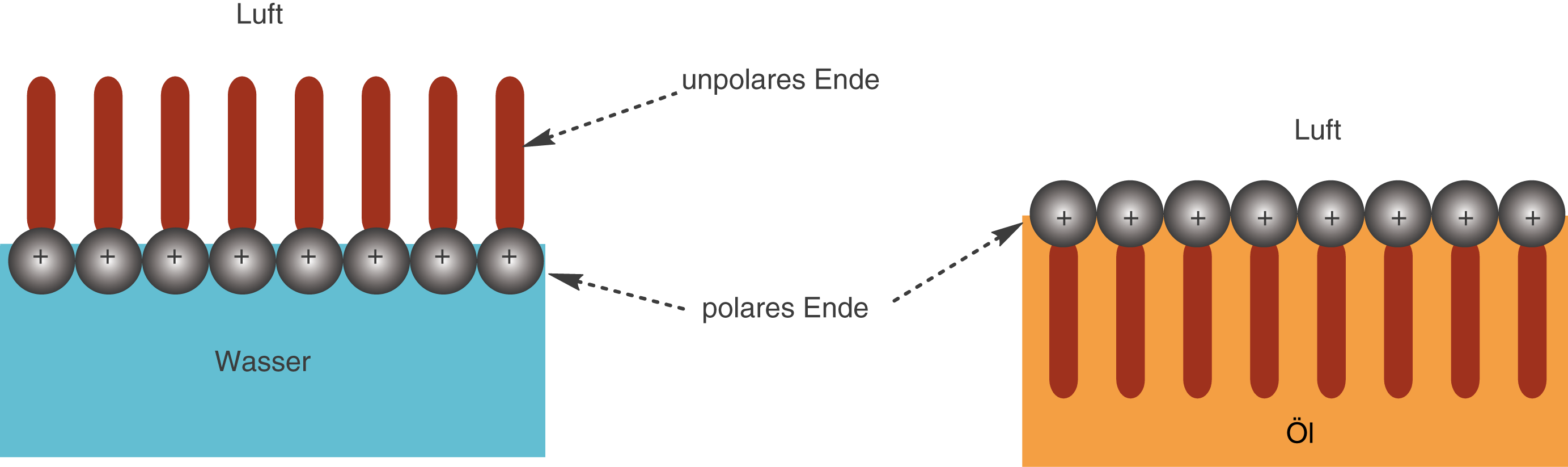
Abb. 8: Ausrichtung von Tensidmolekülen an Grenzflächene
Die Tensidmoleküle stellen wir vereinfacht dar, indem wir das polare Ende mit einem Plus markieren und das unpolare Ende als braunen Balken darstellen. Du kannst sehen, wie sich die Tensidmoleküle an den Grenzflächen zwischen den beiden Phasen Wasser - Luft bzw. Öl - Luft anreichern. Je nach Polarität des Lösungsmittels musst du die Orientierung der Enden berücksichtigen: Die polaren Enden befinden sich beim linken Beispiel im Wasser und die unpolaren befinden sich an der Luft.
Die Folge dieser mononuklearen Tensidschicht an der Grenzfläche ist die Senkung der Oberflächenspannung des Wassers. Die Oberflächenspannung bildet sich aufgrund unterschiedlicher Einflüsse auf die Moleküle an den Grenzflächen aus (vgl. Abb. 9).
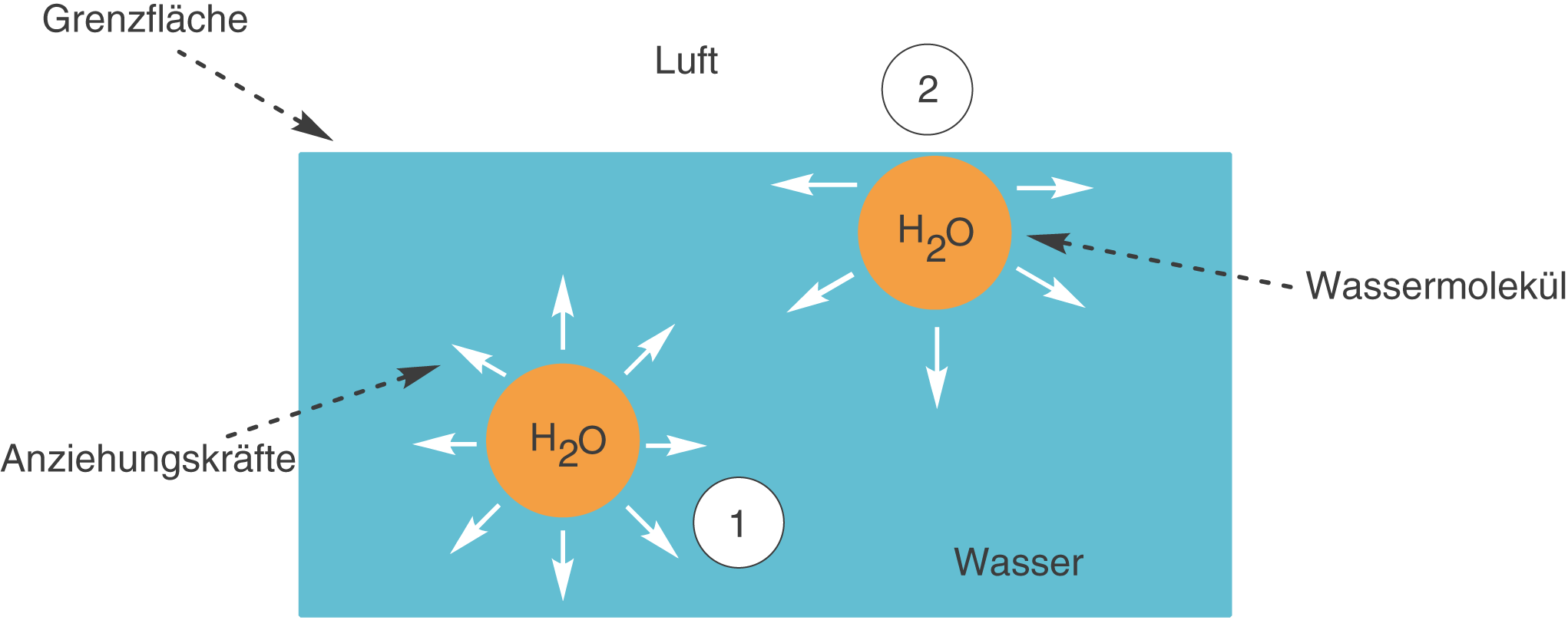
Abb. 9: Oberflächenspannung am Beispiel von Wasser
Wir schauen uns die Situationen der beiden mit 1 und 2 gekennzeichneten Wassermoleküle an, um den Begriff der Oberflächenspannung zu erklären:
- Das Wassermolekül ist umgeben von anderen Wassermolekülen. Somit wirken von allen Seiten die gleichen Anziehungskräfte auf das Molekül; diese gleichen sich also aus.
- Ein Wassermolekül an der Grenzfläche ist nur auf einer Seite von Wassermolekülen umgeben, die eine Anziehungskraft aufbringen: Das Wassermolekül wird gleichsam ins Innere der Phase gezogen. Hier entsteht also eine Spannung aufgrund der Unausgeglichenheit der Kräfteverhältnisse an der Grenzfläche. Diese Spannung nennt man Oberflächenspannung.
Tenside sind nun in der Lage diese Oberflächenspannung von bspw. Wasser deutlich zu vermindern, was dazu führt, dass Fasern besser benetzt werden können.
Tenside und Seifen
Seifen in wässrigen Lösungen
Wir wollen damit beginnen uns das Verhalten der Seifen in wässrigen Lösungen anzuschauen. Dazu erinnern wir uns daran, dass es sich bei Seifen um die Salze der Fettsäuren handelt. Wir haben es also effektiv mit einem Feststoff zu tun, den wir in Wasser lösen werden. Wir betrachten beispielhaft eine Seife des Typs R-COONa. Lösen wir diese Seife in Wasser, dann können wir folgendes Lösungsgleichgewicht formulieren:
Im Weiteren interessiert uns das Verhalten des Säureanions in wässriger Lösung ().
Basisches Verhalten
Fettsäuren sind relativ schwache Basen, womit ihre korrespondieren Basen relativ starke Basen sind. Diese Eigenschaft wird daran deutlich, dass Seifenlösungen stark alkalisch reagieren und deshalb auch als Seifenlaugen bezeichnet werden.
Das Ergebnis ist das Ausfallen der festen Fettsäuren aus der wässrigen Lösung.
Reaktion mit
- Kalkseifenbildung
Wasser unterscheidet sich von Ort zu Ort in seiner Zusammensetzung. Eine wichtige Kenngröße ist die Härte des Wassers, die insbesondere auch durch die Stoffmengenkonzentration an -Ionen bestimmt wird. Je härter das Wasser, desto höher ist die angesprochene Stoffmengenkonzentration. Die Folge können wir anhand der folgenden Reaktionsgleichung erkennen:
Durch die Anwesenheit der Calcium-Kationen fallen hier wiederum Seifen aus. Dabei handelt es sich um sogenannte Kalkseifen, die schwer lösliche Verbindungen von Calcium und Fettsäureanionen darstellen. Das Ergebnis können weiße Streifen auf der Wäsche sein, die nach dem Waschgang auftauchen.
Protonierung in sauren Lösungen
Wir kennen das basische Verhalten von Fettsäureanionen bereits in Anwesenheit von Wasser. Liegen nun andere Säuren vor, d.h. haben wir es effektiv mit sauren Lösungen zu tun, dann kommt es auch zur Protonierung des Säureanions.
Hier kommt es also wiederum zum Ausfallen der unpolaren Fettsäuren, sodass die Waschwirkung effektiv verloren geht. Des Weiteren wird so der natürliche Säureschutzmantel der Haut geschwächt, was zu Rötungen und Reizungen der Haut führen kann.
Wir sehen also, dass Seifen einige Nachteile mit sich bringen, die Tenside kompensieren müssen.
Tenside als Reinigungsmittel
Wir können nun die Struktur der Tenside sowie die Informationen über die Grenzflächenaktivität ausnutzen, um die Rolle der Tenside als Reinigungsmittel anzusprechen. Dabei können wir grob gesehen folgende Aspekte unterscheiden:
- Rolle als Lösungsvermittler (Emulsions- und Suspensionsvermögen)
- Erhöhung des Benetzungsvermögens durch Senkung der Oberflächenspannung
Diese Aspekte wollen wir in diesem letzten Kapitel dieses Skripts erarbeiten und verstehen.
Vorteile gegenüber Seifen
Zunächst wenden wir uns den Vorteilen der Tenside gegenüber den Seifen zu. Im Gegensatz zu letzteren sind wässrige Lösungen von Tensiden im Normalfall neutral und nicht basisch, was weder zum Ausfallen von Feststoffen noch zu schädigenden Einflüssen durch das sehr alkalische Milieu führt.
Weiterhin reagieren alle Tensidtypen kaum bis gar nicht mit Calcium- und Magnesiumkationen. Somit wird das Ausfallen von Calcium bzw. Magnesiumsalzen verhindert, was im Bezug auf die Seifen zu störenden Bildung von schwer löslichen Kalkseifen geführt hat. Dementsprechend können Tenside auch in harten Wässern ihre Wirkung entfalten.
Nicht-ionische Tenside, wie die oben genannten Alkylpolyglycoside sind biologisch gut abbaubar. Damit werden eventuelle Umweltproblematiken vorbeugend umgangen und es kommt nicht zur ausgeprägten Schaumbildung in natürlichen Systemen.
Der Waschvorgang und die Mizellenbildung
Zum Abschluss wenden wir uns dem Waschvorgang an sich zu. Dazu betrachten wir eine verschmutze Faser, die wir mithilfe von Tensiden in einer wässrigen Lösung reinigen wollen (vgl. Abb. 10).
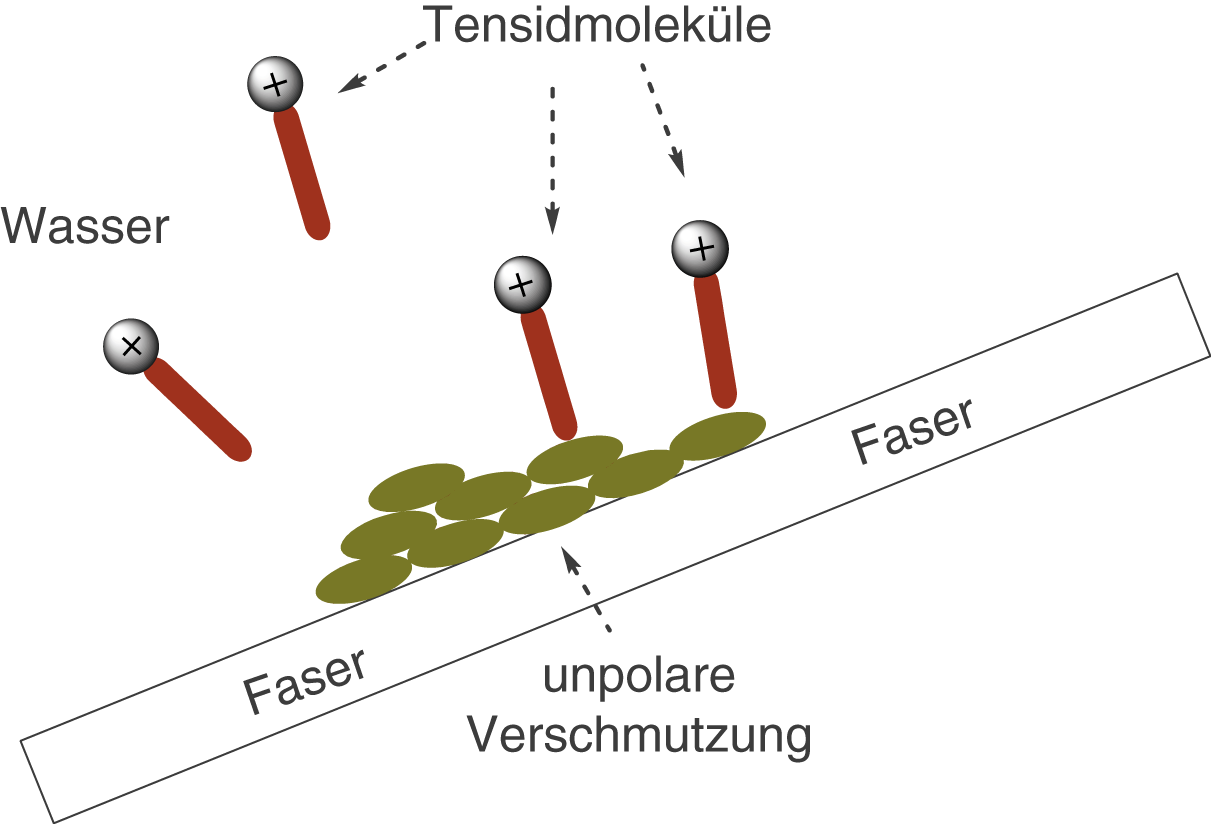
Abb. 10: Tensidmoleküle wechselwirken mit den Partikeln einer unpolaren Verschmutzung
Die unpolaren Enden der Tenside wechselwirken mit den unpolaren Partikeln (bspw. Öl) einer Verschmutzung. Lagern sich immer mehr Tensidmoleküle auf diese Art und Weise an, dann führt dies dazu, dass sich die Partikel langsam von der Faser ablösen (vgl. Abb. 11).
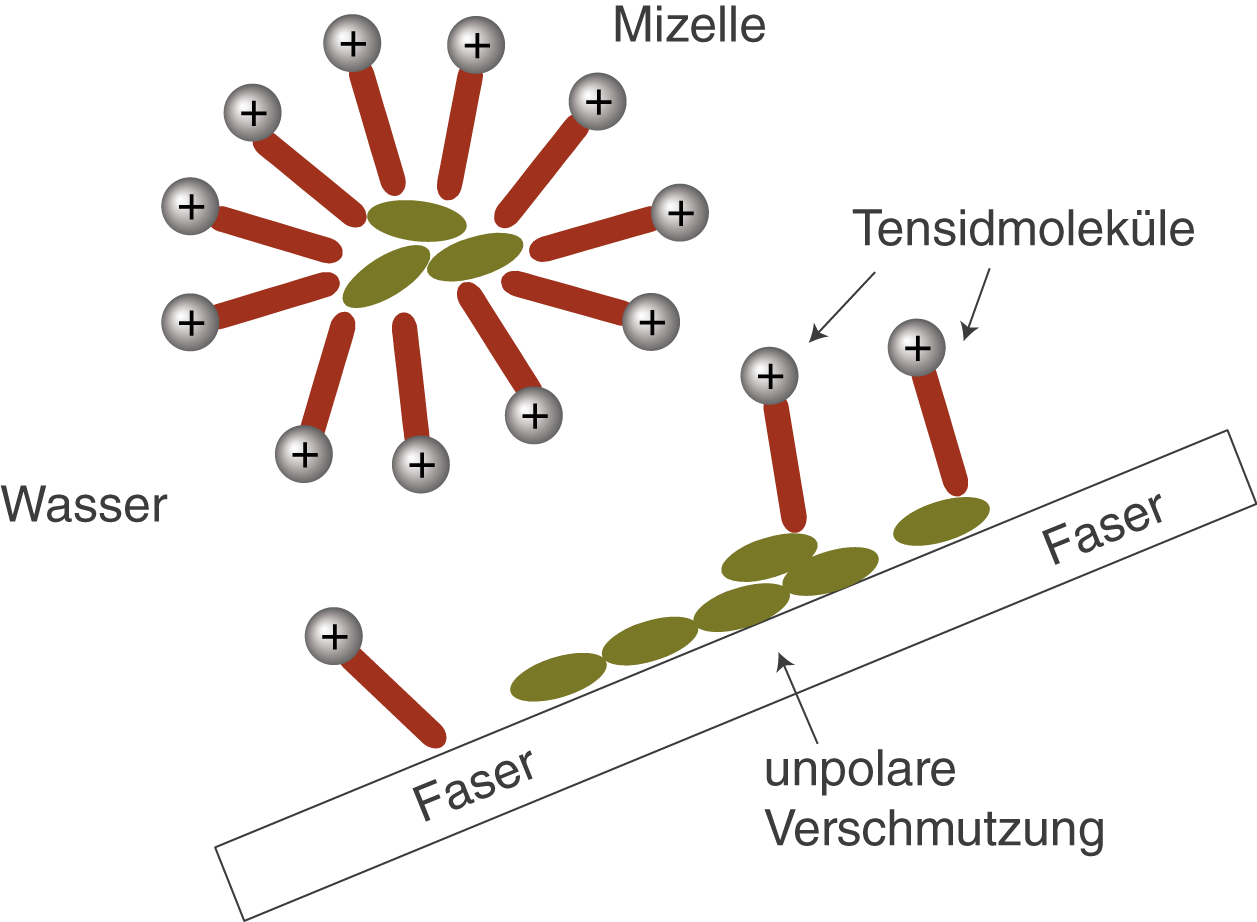
Abb. 11: Ablösung der unpolaren Schmutzpartikel unterstützt durch die Tensidmoleküle
Abgelöste Schmutzpartikel sind von einer Vielzahl von Tensidmolekülen umgeben, die alle so orientiert sind, dass das unpolare Ende mit dem Schmutzpartikel wechselwirkt, während die polaren Enden nach außen in die wässrige Lösung zeigen. Die so entstanden kugelförmigen Gebilde werden Mizellen genannt. In diesem Zusammenhang fällt nun der Begriff des Lösungsvermittlers. Aufgrund er Mizellenstruktur, die auf den Eigenschaften der Tensidmoleküle basiert, kommt es dazu, dass die Schmutzpartikel auf eine gewisse Art und Weise in Lösung gehen können. Dabei sind sie von Tensidmolekülen eingeschlossen (vgl. Abb. 12).
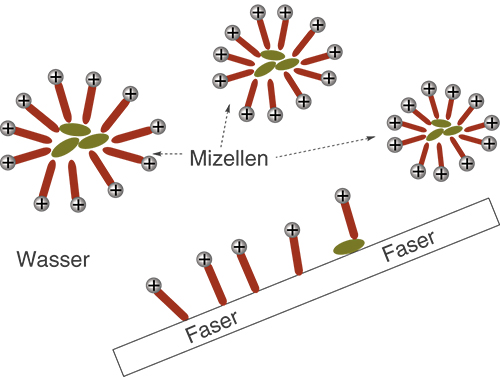
Abb. 12: Dispersion der Mizellen
Die Schmutzpartikel werden nach und nach durch Mizellenbildung in Lösung überführt. Es kommt zur Dispersion der Mizellen innerhalb des Wassers. Das Dispergiervermögen der wässrigen Tensidlösung beschreibt die Effektivität dieses Prozesses und umfasst sowohl das Emulsionsvermögen bzgl. flüssiger Verunreinigungen, als auch das Suspensionsvermögen im Fall fester Verunreinigungen. Haben wir bspw. Staub auf einer Hose, so bildet sich eine Suspension aus, wenn es zur Mizellenbildung kommt. Bei Staub handelt es sich um einen Feststoff. Im Fall von öligem Schmutz kommt es dahingegen zur Ausbildung einer Emulsion, solange der Schmutz einen flüssigen Aggregatszustand aufweist.
Zusammenfassung
- Tenside sind grenzflächenaktive Substanzen, die einen amphiphilen Charakter aufweisen.
- Amphiphilie bezeichnet die Eigenschaft eines Moleküls gleichzeitig hydrophil und lipophil zu sein.
- Tenside werden in kationische, anionische, nicht-ionische und amphotere Tenside unterschieden.
- Zwischen zwei Phasen bilden sich Grenzflächen aus: Hier ändern sich die physikalischen Eigenschaften eines Systems schlagartig.
- Es gibt Grenzflächen zwischen Substanzen aller Kombinationen der bekannten Aggregatszustände fest, flüssig und gasförmig.
- Stoffe, die sich bevorzugt an Grenzflächen anlagern, werden als grenzflächenaktiv bezeichnet. Tenside bilden mononukleare Schichten an Grenzflächen aus.
- Diese mononukleare Tensidschicht an den Grenzflächen senkt die Oberflächenspannung von Wasser.
- Die Oberflächenspannung von Flüssigkeiten kommt durch die ungleichen Kräfteverhältnisse auf die Moleküle an den Grenzflächen zu Stande.
- Seifen bilden stark basische Lösungen, führen zur Bildung von Kalkseifen bei Kontakt mit harten Wässern und werden in sauren Lösungen protoniert, was zum Ausfallen schwer löslicher Fettsäuren führt.
- Tenside weisen die Nachteile von Seifen nicht auf.
- Tenside wirken als Lösungsvermittler und erhöhen das Benetzungsvermögen.
- Mizellen sind kugelförmige Gebilde, die durch Wechselwirkungen von Tensidmolekülen mit partikulären Substanzen zustande kommen. Dabei ragen die polaren Enden nach außen, was dazu führt, dass die Schmutzpartikel im inneren eingeschlossen sind, während sich die Mizellen frei im Wasser bewegen können.